病例分享 | 颈部淋巴结EBV阳性弥漫性大B细胞淋巴瘤一例
时间:2025-06-05 12:09:06 热度:37.1℃ 作者:网络
病史:
男性,62岁,既往无淋巴瘤病史及免疫缺陷病史,因“发现血小板减少4月,伴全身淋巴结肿大1月”入院。
辅查:
专科检查:全身未见淤点、瘀斑,背部见色素沉着,颈部、腋窝触及肿大淋巴结,眼睑轻度水肿。
浅表淋巴结彩超(图1):
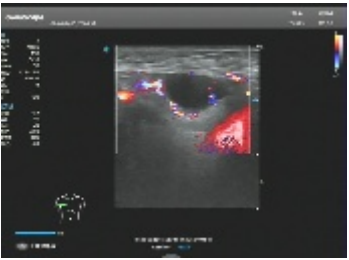
图1 浅表淋巴结彩超示颈部探及多枚实性低回声结节,边界清。
双侧颈部、锁骨上下、腋窝、腹股沟区处探及多枚实性低回声结节,边界清,部分形态饱满,皮髓质分界不清楚,较大约25mm;结节内见点状血流信号。
患者考虑淋巴瘤可能,故取淋巴结活检行病理检查。
组织病理活检:
1.大体肉眼观(图2):淋巴结1枚,15mm×15mm×6mm,切面灰褐实性,质地细腻。
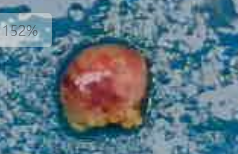
图2 大体观,淋巴结1枚,切面灰褐实性,质地细腻。
2.镜下观(图3-图7):低倍镜下,淋巴结基本结构消失,未见淋巴滤泡,增生的淋巴样细胞弥漫分布;高倍镜下,肿瘤细胞为相对单一的大的转化淋巴细胞,可见中心母细胞样(圆形或卵圆形,胞质伊红,核圆形或卵圆形、部分呈分叶状,泡状核,染色质细,有2~4个靠近核膜的小核仁,通常胞质较少,嗜双色性或嗜伊红性)或免疫母细胞样(瘤细胞单个中位核仁,嗜碱性的胞质,有时伴浆细胞分化),增生的大细胞形态不典型,核分裂象多见,背景中可见小淋巴细胞及组织细胞,炎症背景相对较少。
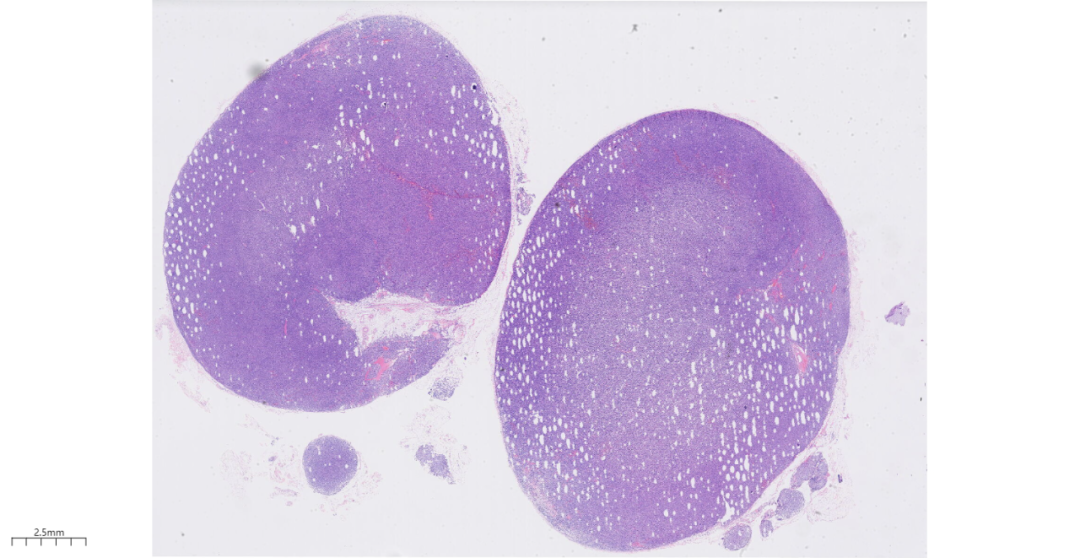
图3 低倍镜下,淋巴结基本结构消失,未见淋巴滤泡。
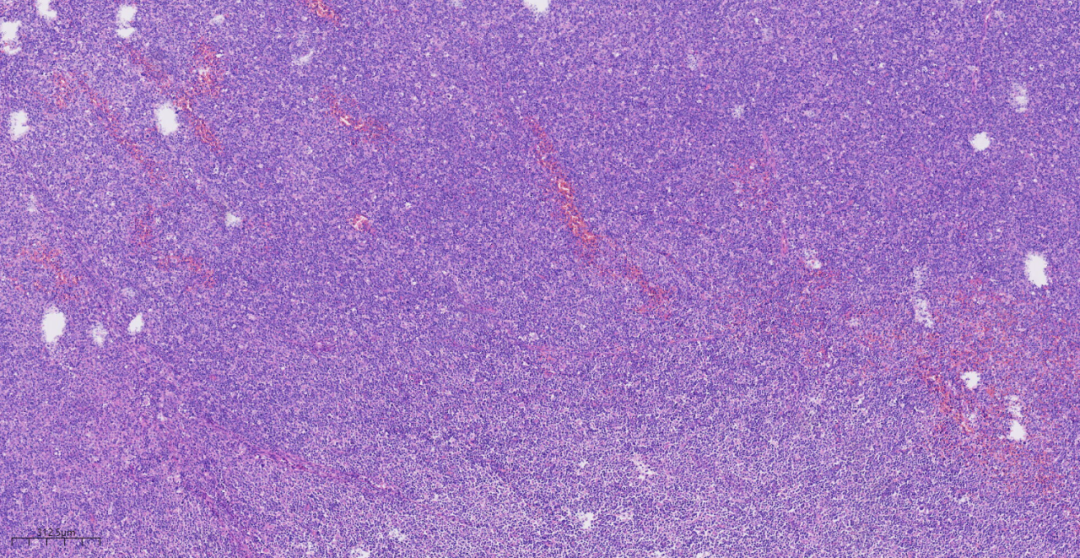
图4 中倍镜下,淋巴滤泡结构消失,由弥漫分布的淋巴样细胞增生。
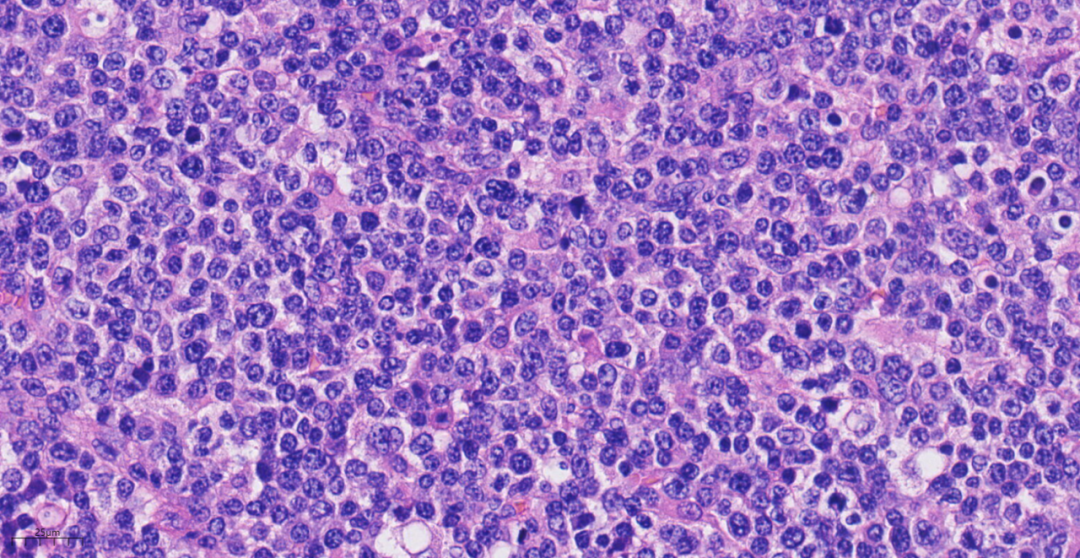
图5 高倍镜下,肿瘤细胞为相对单一的大的转化淋巴细胞或免疫母细胞大细胞。
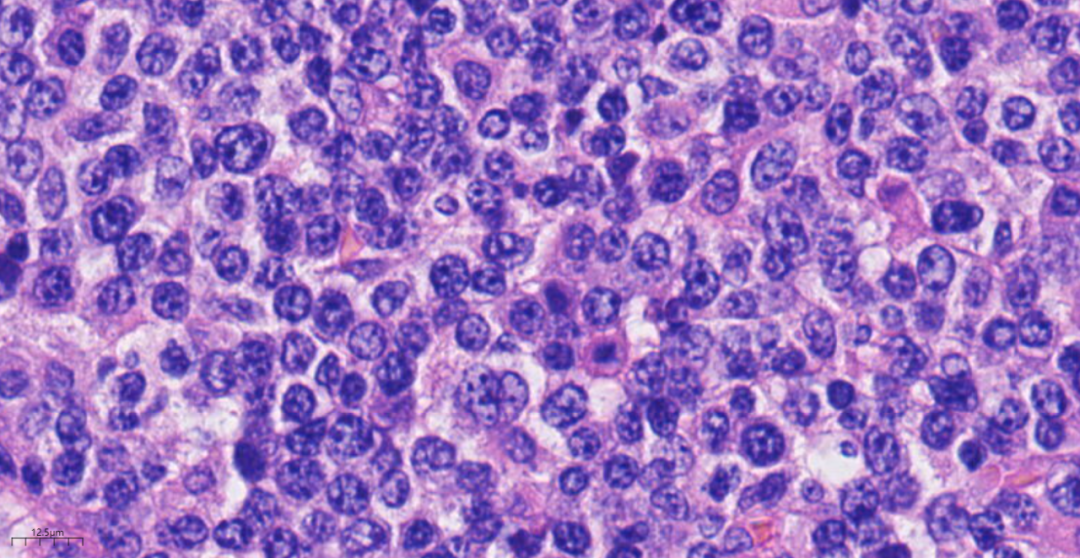
图6 高倍镜下,可见肿瘤细胞为中心母细胞为主,其间也可免疫母细胞。
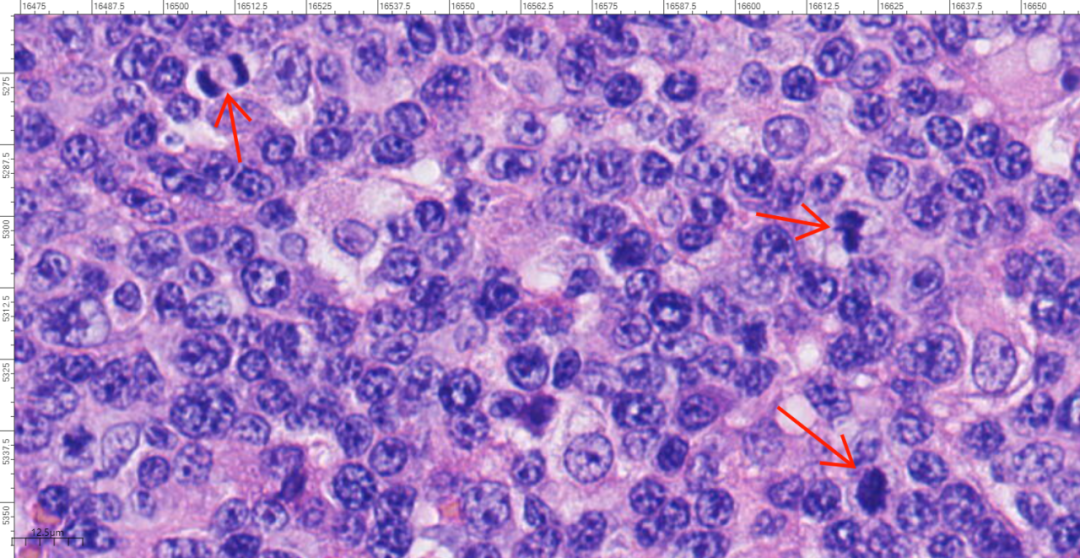
图7 高倍镜下,肿瘤细胞形态不典型,核分裂象多见。
3.免疫组化及分子病理检测(图8-图15):
免疫组化示肿瘤细胞LCA(+),CD20(+),PAX-5(+),CD3(-),CD4(-),CD5(-),CD8(-),CyclinD1(-),CD10(-),BcL-6(-),MUM1(+),PD-1(-),CD163(-),ALK(-),CD30(部分+),CD15(-),CD56(-),EBV(个别细胞+),CD21(未见FDC网),Ki-67(70%+)。
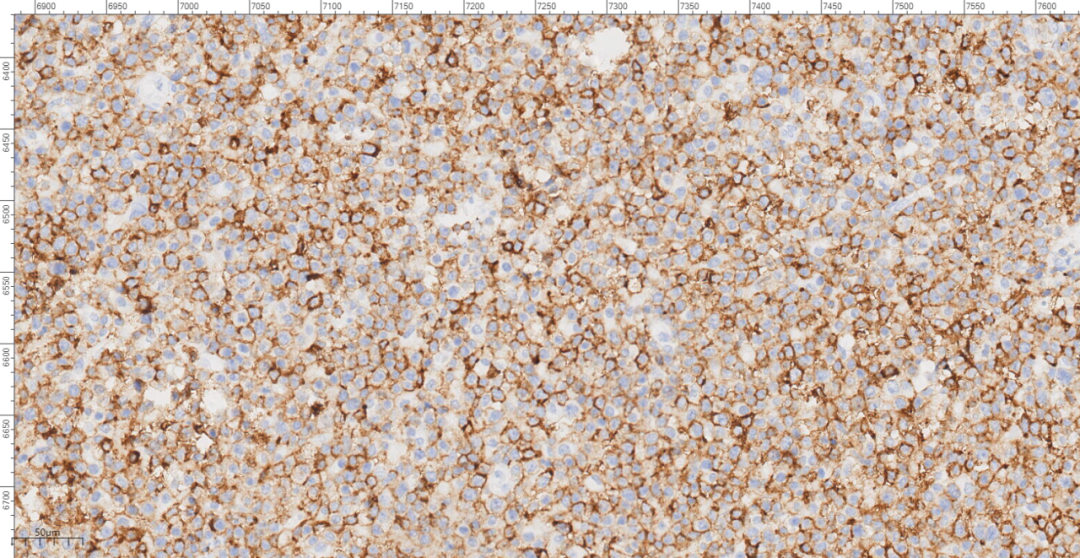
图8 免疫组化示肿瘤细胞LCA(+)。
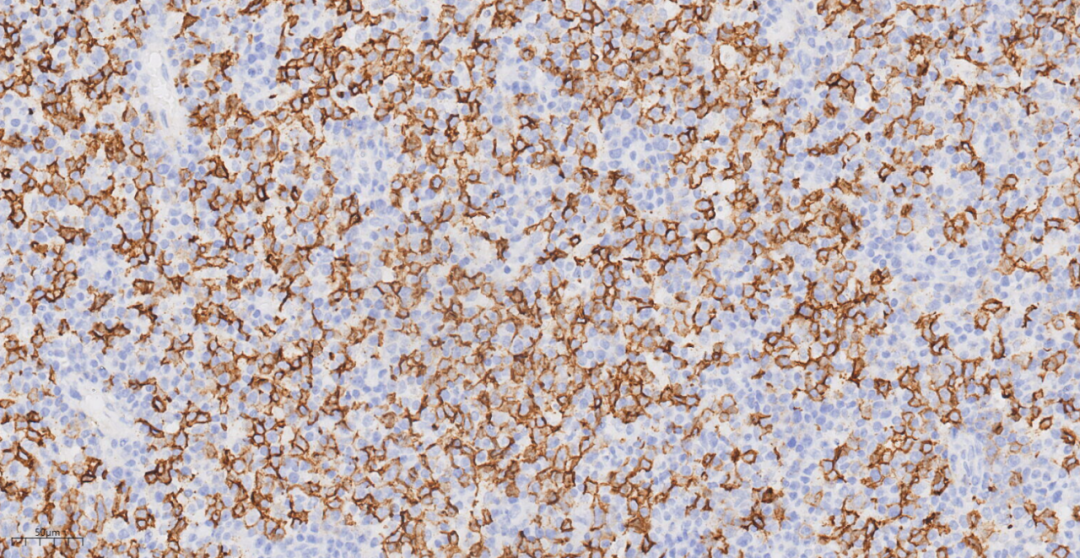
图9 免疫组化示肿瘤细胞CD20(+)。
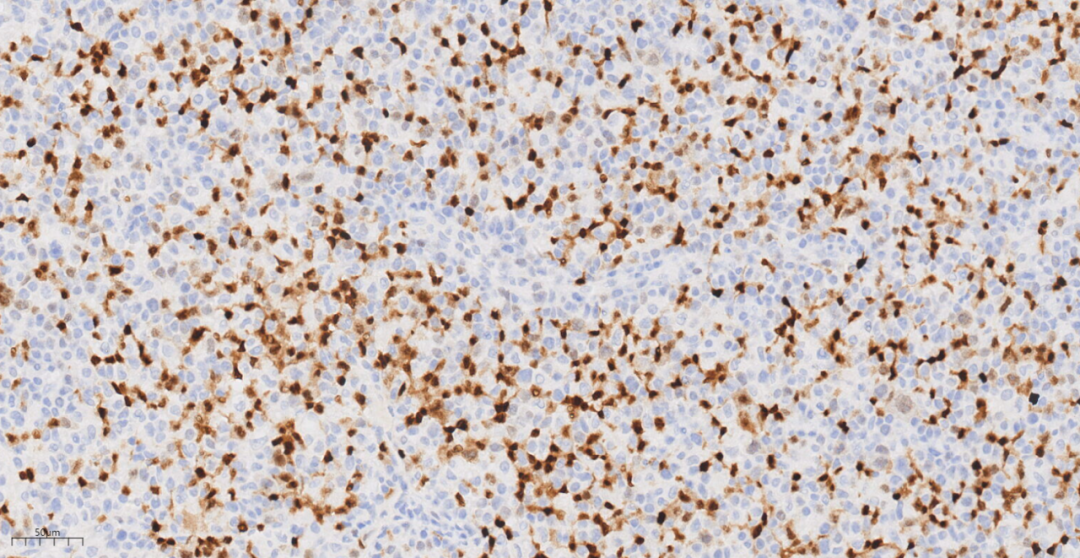
图10免疫组化示肿瘤细胞PAX-5(+)。
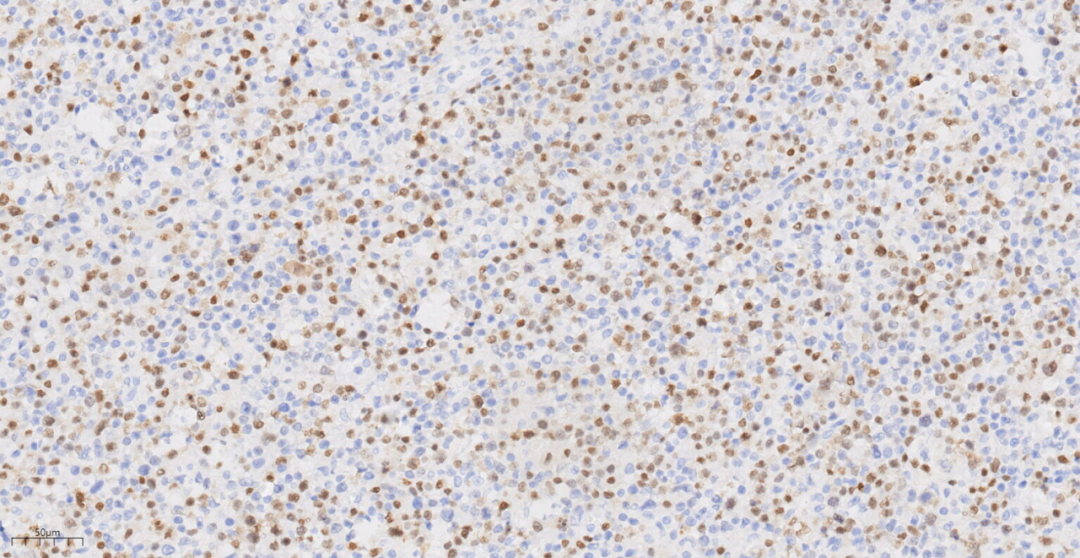
图11 免疫组化示肿瘤细胞MUM1(+).
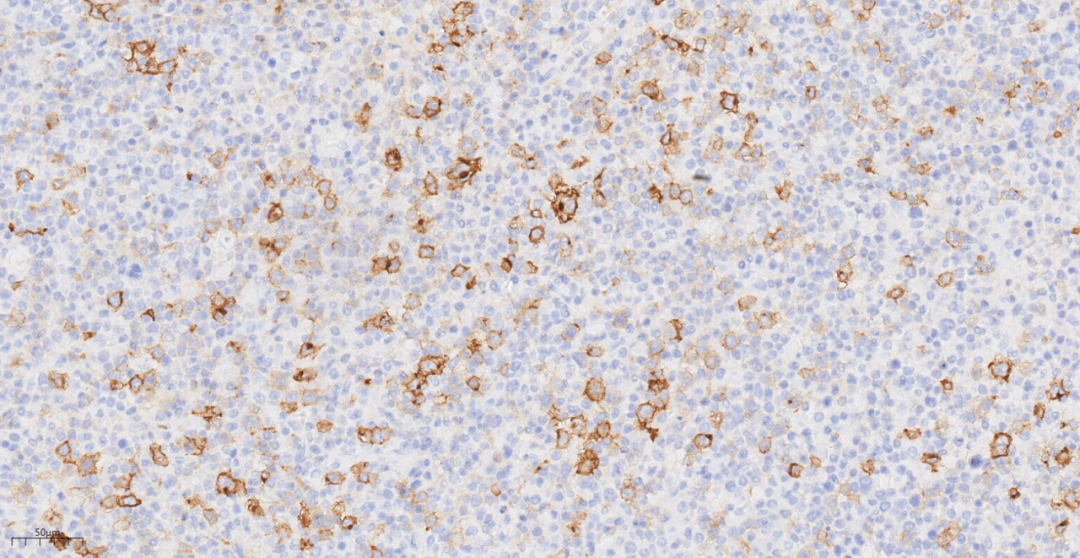
图12 免疫组化示肿瘤细胞CD30(部分+).

图13 免疫组化示肿瘤细胞CD21(未见FDC网).
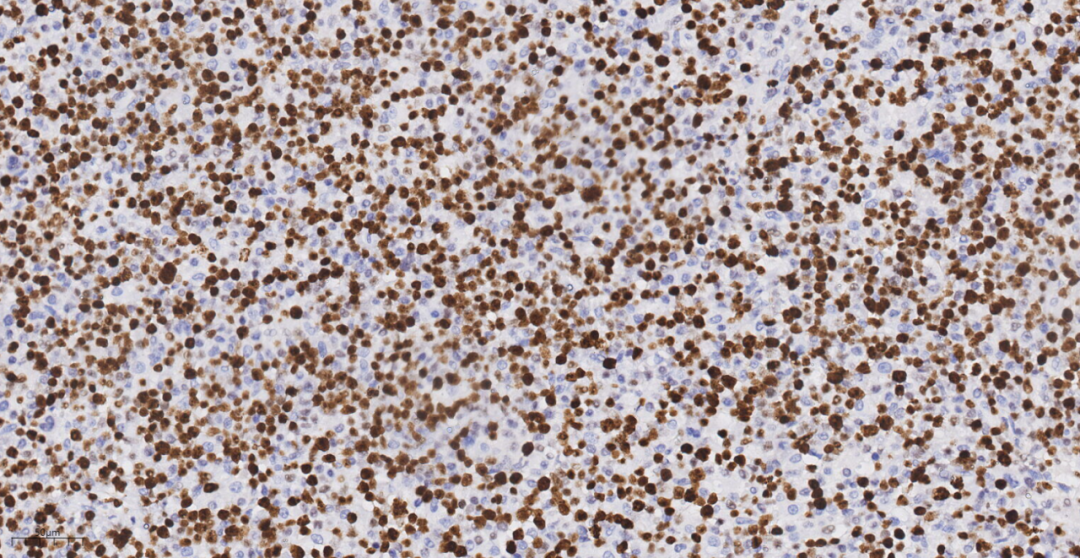
图14 免疫组化示肿瘤细胞Ki-67(70%+).
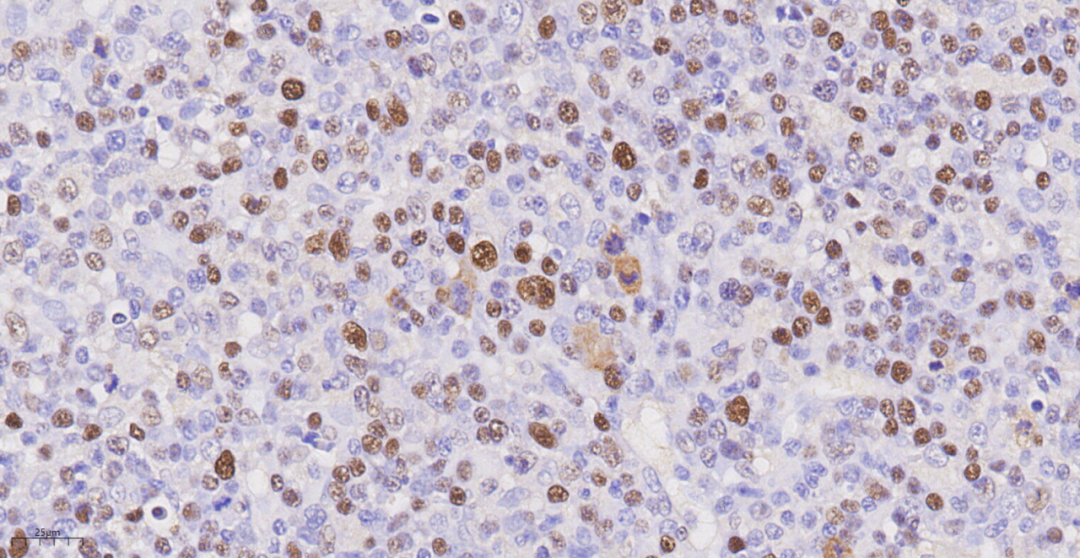
图15 分子病理检测结果示肿瘤细胞EBER/ISH(+)。
分子病理检测结果:
1、样本IG基因克隆性重排(+),TCR基因克隆性重排(-);
2、EBER/ISH(+)。
病理诊断:(右颈部)淋巴结EBV阳性弥漫性大B细胞淋巴瘤。
讨 论
1.背景:
EBV阳性的DLBCL,非特指型(EBV+DLBCL-NOS),最初是由Oyama等于2003年在22名日本老年患者中描述的,其与慢性炎症相关,是DLBCL中一种比较罕见的类型,EBV+DLBCL通常在老年患者中发病,可能与老年人的免疫功能失调,易受EBV感染,并可能患上自体免疫性疾病和恶性肿瘤有关。淋巴造血组织肿瘤WHO分类(2008)曾将老年人EBV阳性弥漫大B细胞淋巴瘤单独列出,定义为50岁以上、无任何已知免疫缺陷背景的侵袭性B细胞淋巴瘤,后续多组研究发现该亚型亦可见于年轻人和儿童。WHO分类2016年修订版,即命名为“EBV阳性弥漫大B细胞淋巴瘤,非特指”。
2. EBV+DLBCL的临床病理特征
2.1临床特点
EBV+DLBCL可发生于任何年龄,中位年龄为71岁,男性常见(男女比为1.5:1)。大多数患者为临床晚期(Ann Arbor分期Ⅲ或IV期),国际预后指数(interational prognostic index,IP)高,B症状(发热、盗汗、体重下降)常见。大多数患者乳酸脱氢酶(LDH)水平升高,血清EBV DNA阳性,EBV IgG阳性率高达90%,提示病毒重新激活。与年轻患者相比,老年患者多为侵袭性临床过程,临床分期和IPI评分较高;病变多见于结外,常累及皮肤、胃肠道或肺。高达89%年轻患者表现为淋巴结病变。
2.2病理学特征
镜下观:
EBV+DLBCL,NOS的组织形态学可分为以大细胞多形性淋巴瘤和单形性免疫母细胞样大细胞淋巴瘤两类。
(1)大细胞多形性淋巴瘤常表现为在多种反应性炎细胞、浆细胞和组织细胞混合背景中分布多少不一的中心母细胞、免疫母细胞或Hodgkin/Reed-Sternberg(H/RS)细胞,可见上皮样肉芽肿,类似经典型霍奇金淋巴瘤或富于T/组织细胞的大B细胞淋巴瘤。根据大细胞和H/RS细胞的多少进一步分为:
①多形性弥漫大B细胞淋巴瘤模式,以转化的中心母细胞和免疫母细胞为主,仅散在少数H/RS细胞。
②霍奇金淋巴瘤模式:肿瘤细胞以H/RS细胞为主。
③多形性淋巴增生性疾病模式:混合背景中体积大的肿瘤细胞比例低,无H/RS细胞。
(2)单形性大细胞淋巴瘤则表现为肿瘤细胞为相对单一的大的转化淋巴细胞或免疫母细胞。不同形态学亚型的临床预后意义尚有争议。此外,地图样坏死、肿瘤细胞呈浆细胞分化和血管侵犯被视为相对特异的组织学特征。
免疫表型:肿瘤细胞表达多种B细胞表面标记,至少50%的肿瘤细胞表达CD20,部分具有浆细胞/浆母细胞样分化特点的肿瘤细胞不表达CD20。CD19、CD79a、PAX5、OCT2、BOB1和MUM 1阳性。LMP-1可模拟CD40受体的激活、诱导NF-kB/IRF-4的本构性激活,导致BCL-6表达下调,故多为Non-GCB/ABC表型(Hans分型)。CD30阳性率可达68%,且预后较差。BCL-2多为阳性。多数病例Ki67指数高于70%。CD15、CD10阴性。
分子遗传学:EBV+DLBCL,NOS呈免疫球蛋白重链基因lgH的单克隆性重排。c-myC、BCL-2和BCL-6基因拷贝数增加,但BCL-2、BCL-6或c-myc的易位少见;可见t(9;14)(p13;q23)染色体易位。EB病毒驱动的发病机制仅依赖于数量有限的额外驱动突变,可出现T细胞受体基因重排“受限”或寡克隆,不易发生MYD88和/或CD79B 基因突变。
3.鉴别诊断:
EBV+DLBC主要应与以下肿瘤相鉴别:
(1)反应性病变,如老年人EBV再活化引起的传染性单核细胞增多症:组织结构破坏不明显,常常为扩张的滤泡间区伴小血管增生。滤泡间区小到中等大小的淋巴细胞、浆细胞、免疫母细胞混合浸润,可出现类似R-S细胞样的免疫母细胞:克隆性分析呈多克隆增生。
(2)血管免疫母细胞T细胞淋巴瘤(angioimmunoblastic T cell lymphoma, AITL)常不破坏皮质外周淋巴窦,可见残存的滤泡。增生细胞小~中等大,轻度异型,胞质淡染,核膜清楚,可形成高度特征性的花斑状结构。滤泡树突细胞增多,明显的高内皮细胞小静脉也是该肿瘤的一个特征。少数病例可见散在的R-S样细胞。T细胞系标志物(CD2、CD3、CD5)呈阳性,可见CD21+滤泡树突状细胞网。此外,AITL具有正常滤泡辅助T细胞表型,即CD3、CD10、CXCL13和PD-1阳性。病变组织中存在的转化B细胞通常EBV阳性,但肿瘤细胞EBV阴性。
(3)富含T细胞/组织细胞的大B细胞淋巴瘤(T-cell/histiocyte-rich large B-cell lymphoma, THRLBL)也可见到类似于中心母细胞或R-S样细胞的肿瘤细胞,但肿瘤细胞EBV多为阴性,CD30阴性,且背景由数量不等的CD68+组织细胞及CD3+CD5+细胞构成。若病例中缺乏一定数量的组织细胞,且中~大B细胞成簇分布时,不应诊断为THRLBL,而应考虑DLBCL-NOS。此外,若发现THRLBL中肿瘤细胞表现出霍奇金样细胞的形态且EBV阳性,则应考虑诊断EBV+DLBCL-NOS。
(4)经典型霍奇金淋巴瘤:50%以上的R-S样细胞、表达B细胞特异性转录因子0CT2和BOB1;超过30%的背景小淋巴细胞为细胞毒性T细胞。
(5)淋巴瘤样肉芽肿病:具有免疫缺陷的临床背景,90%累及肺,其他常见部位包括脑、肾、肝和皮肤,罕见淋巴结或脾脏首发。
(6)Burkitt淋巴瘤:主要的鉴别要点是肿瘤细胞表达CD10、BCL6,不表达BCI2;伴有MYC基因易位。
(7)浆母细胞淋巴瘤:大多数病例继发于免疫缺陷;主要表现为结外病变,且典型病变局限于口腔:口腔外可原发于鼻腔、胃、肠、肝、肺、睾丸、骨等;瘤细胞呈浆母细胞样或中心母细胞样;免疫表型为终末期分化B细胞、浆细胞表型。与老年人EBV阳性的DLBCL不同的是,肿瘤细胞通常是不表达CD20、CD45,表达MUM1CD138、CD38。
(8)原发渗出性淋巴瘤:大部分患者伴有HIV感染,重叠感染EBV;以浆液渗出而无肿块形成为表现,最常见部位为胸腔、心包腔和腹腔,常单腔受累。渗出液离心涂片见大免疫母细胞、浆母细胞、间变细胞等多种形态,可见H/R-S样细胞。肿瘤细胞表达CD45,但缺乏全B细胞标记,常表达EMA、CD30和浆细胞相关抗原(CD138、CD38)。HHV-8相关潜伏蛋白LANA1核阳性,EBER原位杂交阳性,但LMP1阴性。
(9)慢性炎症相关DLBCL:90%见于长期脓胸背景,大多数病变发生于体腔和狭窄腔道。大多数瘤细胞多为CD20和CD79阳性,部分呈浆细胞分化而丢失CD20和/或CD79a、表达IRF4/MUM1和CD138。可有CD30表达。偶尔可见肿瘤细胞尚同时表达一个或多个T细胞标记(如CD2、CD3、CD4和/或CD7)。原位杂交示EBER阳性,呈EB病毒川型潜伏感染模式(LMP-1+/EBNA-2+)。
4.治疗及预后
目前临床上最常用的EBV+DLBCL,NOS治疗方案为CHOP或R-CHOP,但治疗效果不理想,预后比EBV阴性DLBCL患者差。探索中的EBV针对性治疗策略包括通过靶向EBNA-1分子抑制EBNA-1磷酸化来消除EBV基因组;典型抗疱疹病毒联合裂解期诱导剂;构建EBV特异性细胞毒性T细胞;EBV特异性过继免疫疗法;LMP-1导向的针对CD19等肿瘤相关标记物的嵌合抗原受体(CAR)T细胞等。靶向PD-1/PD-L1的免疫疗法、CD30单抗维布妥昔、靶向潜伏膜蛋白1(latent membrane protein-1,LMP-1)的嵌合抗原受体T细胞(chimeric antigen receptor T-Cell immunotherapy,CAR-T)疗法有望为患者提供更有效的治疗方案。
*本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1]高源,潘玙,宋立玲,等.EBV阳性弥漫大B细胞淋巴瘤27例患者的临床病理特征及预后[J].临床与病理杂志,2024,44(06):799-808.
[2]叶明,李泽霖,闫淑芳,等.EB病毒阳性弥漫大B细胞淋巴瘤的临床病理特征[J].华中科技大学学报(医学版),2023,52(01):83-87.
[3]朱星瑶,农卫霞,陶林,等.非特指型多形性EBV阳性弥漫大B细胞淋巴瘤1例[J].临床与实验病理学杂志,2022,38(12):1527-1528.DOI:10.13315/j.cnki.cjcep.2022.12.027.
[4]陈光亮,吴方恬,曹军宁.非特指EBV阳性弥漫大B细胞淋巴瘤的研究进展[J].中国癌症杂志,2022,32(03):258-267.DOI:10.19401/j.cnki.1007-3639.2022.03.009.
[5]胡晓梅,邱宗建,杨映红.EBV阳性弥漫大B细胞淋巴瘤18例临床病理分析[J].临床与实验病理学杂志,2019,35(08):953-956.DOI:10.13315/j.cnki.cjcep.2019.08.017.
[6]温晶晶.EBV阳性弥漫大B细胞淋巴瘤的临床特征及二代组学研究[D].福建医科大学,2018.
[7]Bourbon E, Maucort-Boulch D, Fontaine J, Mauduit C, Sesques P, Safar V, Ferrant E, Golfier C, Ghergus D, Karlin L, Lazareth A, Bouafia F, Pica GM, Orsini-Piocelle F, Rocher C, Gros FX, Parrens M, Dony A, Rossi C, Ghesquières H, Bachy E, Traverse-Glehen A, Sarkozy C. Clinicopathological features and survival in EBV-positive diffuse large B-cell lymphoma not otherwise specified. Blood Adv. 2021 Aug 24;5(16):3227-3239. doi: 10.1182/bloodadvances.2021004515.
[8]刘彤华,《刘彤华诊断病理学》第4版.
[9]Ok CY, Papathomas TG, Medeiros LJ, Young KH. EBV-positive diffuse large B-cell lymphoma of the elderly. Blood. 2013 Jul 18;122(3):328-40. doi: 10.1182/blood-2013-03-489708.
[10]Ferry JA, Sohani AR, Longtine JA, Schwartz RA, Harris NL. HHV8-positive, EBV-positive Hodgkin lymphoma-like large B-cell lymphoma and HHV8-positive intravascular large B-cell lymphoma. Mod Pathol. 2009 May;22(5):618-26. doi: 10.1038/modpathol.2009.36.
[11]Ohashi A, Kato S, Okamoto A, Inaguma Y, Satou A, Tsuzuki T, Emi N, Okamoto M, Nakamura S. Reappraisal of Epstein-Barr virus (EBV) in diffuse large B-cell lymphoma (DLBCL): comparative analysis between EBV-positive and EBV-negative DLBCL with EBV-positive bystander cells. Histopathology. 2017 Jul;71(1):89-97. doi: 10.1111/his.13197.


