【JCO】BTK抑制剂治疗套细胞淋巴瘤的现有证据及治疗建议
时间:2025-06-23 12:12:25 热度:37.1℃ 作者:网络
BTK抑制剂治疗MCL
套细胞淋巴瘤(MCL)仍是一种具有侵袭性、不常见且异质性强的B细胞恶性肿瘤,会缩短患者的相对总生存期(OS)。其特征是在多线治疗过程中基因组不稳定性逐渐增加,疾病进展加速,以及对治疗产生耐药性。随着治疗线数的增加,患者的生存预后显著恶化,而优化所有患者群体的一线治疗是改善患者预后和生存的最佳策略。在复发性疾病中,针对B细胞受体通路的共价布鲁顿酪氨酸激酶(cBTK)抑制非常有效,cBTK抑制剂单药治疗已成为复发性MCL的标准治疗方案。在一线治疗中BTK抑制剂也具有良好的数据,表明BTKi应成为广泛患者群体中标准一线治疗的一部分,并将在未来成为非化疗组合方案的核心。
《Journal of Clinical Oncology》近日发表综述,总结了cBTK抑制剂治疗MCL的试验数据,讨论了一线整合cBTK抑制剂治疗策略的证据强度和质量,表明在一线治疗中加入cBTK抑制剂具有获益,并提出了治疗原则的建议。

BTK抑制剂治疗复发难治性MCL
BTK抑制已成为复发或难治性(R/R)套细胞淋巴瘤(MCL)患者的关键治疗靶点。伊布替尼、阿可替尼、泽布替尼、奥布替尼均在不同地区获得批准,作为共价BTK抑制剂(cBTKi)单药治疗用于R/R MCL。这三种口服cBTKi药物通常耐受性良好,显示出明确的疗效,总缓解率(ORR)在70%到80%之间,中位无进展生存期(PFS)在14到33个月之间。伊布替尼单药治疗的汇总试验数据显示,与后续复发相比,首次复发时在缓解深度和生存方面的效果最佳。目前尚未有这三种药物在MCL中进行的头对头比较研究。尽管没有BTK抑制与免疫化疗对比的随机试验,但国际非试验系列研究表明,在早期复发(疾病进展在24个月内[POD24]、晚期复发[非POD24]以及中枢神经系统复发)的患者中,cBTK抑制的疗效优于免疫化疗。
很多研究尝试通过以cBTK抑制剂为基础的方案来提高R/R MCL患者的缓解率和生存率。联合用药的伙伴包括蛋白酶体抑制剂、免疫调节剂,以及最成功的BCL2抑制剂。SYMPATICO试验表明,与伊布替尼单药治疗相比,伊布替尼-维奈克拉联合治疗在R/R MCL中提高了完全缓解率(CRR)、ORR和PFS,尽管该联合治疗尚未获得批准,且在当前随访中尚未观察到OS获益。伊布替尼-维奈克拉联合治疗会增加血液毒性及感染风险,并需要仔细监测和对肿瘤溶解综合征进行风险评估。伊布替尼-维奈克拉在R/R MCL中的最佳应用尚未完全明确。然而,对R/R MCL中cBTKi-BCL2i联合治疗的研究为它们在一线治疗中的开发铺平了道路。
BTK抑制剂联合CD20单抗一线治疗MCL
多个II期临床试验评估了cBTKi和抗CD20单抗联合方案在MCL一线治疗中的疗效(表1)。
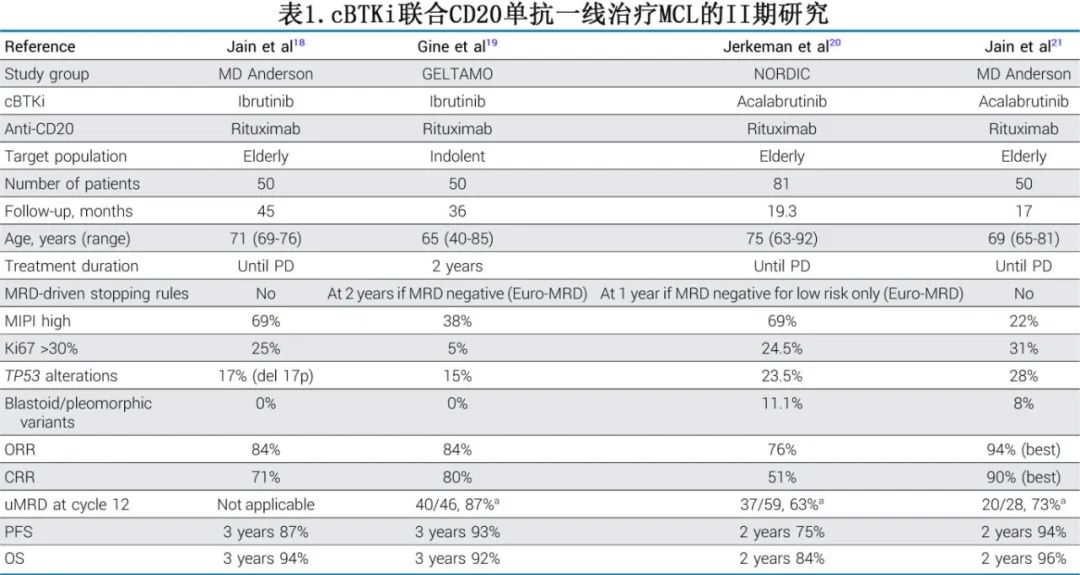
这些试验最初在老年患者、不适合接受大剂量化疗的患者和/或低危特征患者中开展,随后扩展到所有患者群体。GELTAMO研究纳入惰性无症状MCL患者(定义为非母细胞性、Ki67 < 30%且无>3厘米的肿瘤包块),在50例接受伊布替尼-利妥昔单抗(IR)治疗的患者中,12个周期后的ORR为84%,其中包括80%的CRR,以及87%的患者在外周血中达到微小残留病(MRD)阴性状态。中位随访时间为36个月,估计的3年PFS为93%。在获得MRD阴性的35例患者中,24例(69%)停用了伊布替尼:其中5例在停药后3到20个月MRD转阳,观察到1例临床复发。重要的是,MCL国际预后指数(MIPI)和TP53状态对PFS有显著影响,尽管样本量较小。
在同一时期,Jain等人报告了IR方案(持续应用直至疾病进展或不可接受的毒性)在≥65岁且无母细胞性形态或高Ki67的患者中的结果。在50例接受治疗的患者中,最佳ORR为84%(71% CRR)。3年PFS和OS分别为87%和94%。值得注意的是,有21例患者因不良事件(AE)停用伊布替尼,其中包括22%的患者出现≥3级房颤,从而凸显了在接受该联合治疗之前进行全面心血管风险基线评估的必要性。部分缓解的患者肿瘤中富集KMT2D、FAT4、ROS1、CARD11、ATM、NOTCH1、CCND1和FAT1基因突变,以及SMARCA4基因扩增或KMT2C基因缺失,并且在基因表达分析中B细胞受体通路呈上调状态。
几年后,北欧研究团队在≥60岁老年患者人群中启动了一项类似研究,采用第二代cBTKi阿可替尼与利妥昔单抗(AR)联合治疗,唯一的区别是该研究没有基于风险因素的排除标准。在这些老年患者中,AR在缓解方面与IR表现相当(ORR为95%,CRR为90%)。对于低危患者(即非母细胞性形态,无TP53突变:占74%的人群),一个内置的MRD引导的停药规则允许在达到MRD阴性的患者在1年后停止治疗,56%的低危患者发生停药。高危患者(占所有入组患者的26%)计划持续接受AR治疗直至疾病进展或不可接受的毒性。当高Ki67被纳入高危组时,与低危MCL患者相比,2年PFS显著较差,仅为38%,而低危患者的2年PFS为96%。相对于一个根据MIPI和性别匹配的、接受利妥昔单抗-化疗的合成对照组,AR似乎可改善PFS和OS,尽管这种跨人群分析存在局限性。
另一项单独的II期试验研究了阿可替尼-利妥昔单抗(AR)联合方案,阿可替尼持续使用直至疾病进展或不可接受的毒性,在老年fit且通常风险较低的患者群体中进行。患者在入组时根据深入的心脏评估获得心脏许可。2年PFS为92%,传统高危特征未产生影响。这些研究中患者基线特征的差异可能解释了结果的差异。
总体而言,这些试验表明,在考虑基于cBTKi和抗CD20的双药方案用于MCL一线治疗时,风险分层方法非常重要,低危患者明显受益。此外,这些低危MCL患者可能从基于MRD的限时治疗策略中获益,但该方法仍需要进一步完善。具有高危特征(如母细胞性形态、高Ki67或TP53突变)的患者并未从这种双药联合方案中获得足够的获益,可能需要采用其他方法。
cBTKI-BCL2i联合CD20单抗和其他三药方案用于一线治疗
多个II期研究评估了新型三药方案在MCL一线治疗中的应用,旨在增强治疗的协同性、缓解深度和持久性(表2)。
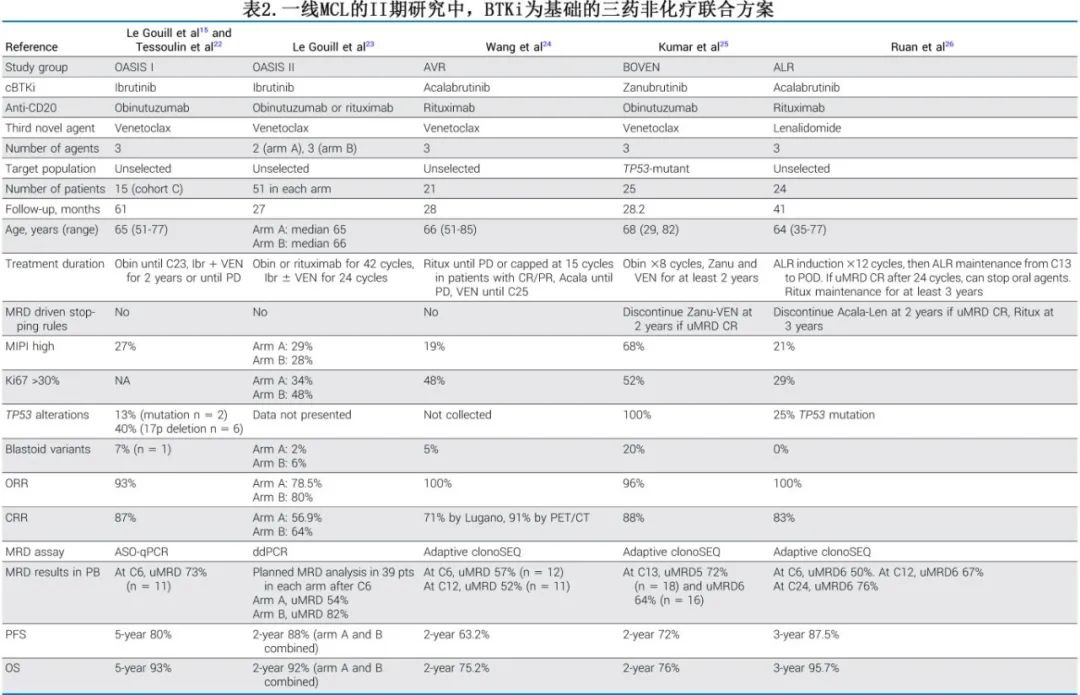
在R/R MCL的临床前模型和临床研究(如AIM和SYMPATICO研究)中,将维奈克拉等药物加入cBTKi中已证明具有协同作用,从而为在初治MCL中应用三药方案提供了有力依据。
OASIS I研究是一项I/II期试验,评估了伊布替尼、奥妥珠单抗和维奈克拉三联方案在R/R MCL中的应用。在C队列中,15例初治患者接受三药方案,包括具有高危特征的患者,如TP53异常(n=8)和多形性变异(n=1)。6个周期治疗的ORR为93%(CRR为87%),其中73%(n=11)通过等位基因特异性寡核苷酸聚合酶链反应(PCR)达到外周血uMRD。中位随访时间为14个月,该队列的1年PFS为93.3%,1年OS为100%。长期数据显示,5年PFS和OS估计值分别为80%和93%,反映出可获得持久缓解。
阿可替尼、维奈克拉和利妥昔单抗在21例初治患者中显示出100%的ORR,CRR为71%,通过ET-CT评估的CRR为91%。在28个月的随访中,2年PFS和OS分别为63%和75%。生存结果受到COVID-19相关死亡(n=5)的不利影响,这些未接种疫苗的患者在COVID-19大流行早期死亡。
泽布替尼、维奈克拉和奥妥珠单抗(BOVen)方案专门针对TP53突变初治MCL患者进行了研究,采用基于MRD的停药方法。在25例患者中,最佳ORR为96%(CRR为88%)。2年PFS和OS分别为72%和75%,与该高危亚组的历史化疗免疫治疗结果相比具有优势。在完成24个周期的18例患者中,11例达到uMRD(ClonoSEQ,10⁻⁶灵敏度),并保持缓解状态,但随访时间有限。需要进一步随访以评估这些高危患者中临床和分子缓解的持久性。
另一种用于初治MCL的无化疗三药方案是ALR方案(阿可替尼、来那度胺和利妥昔单抗),该方案纳入免疫调节剂来那度胺,并在2年后对口服药物以及3年后对利妥昔单抗进行基于MRD的停药。观察到较高比例的3级皮疹。最佳ORR和CRR分别为100%和83%;3年PFS和OS分别为87.5%和95.7%,TP53突变患者倾向于PFS较差。
在比较双药与三药非化疗cBTKi方案方面,OASIS II随机II期试验提供了重要的对比数据。该研究评估了伊布替尼联合抗CD20(利妥昔单抗或奥妥珠单抗;A组)对比伊布替尼、抗CD20(利妥昔单抗或奥妥珠单抗)和维奈克拉(B组)。维奈克拉的加入增强了疗效,在第6周期后,B组通过数字滴定PCR检测到的uMRD率显著高于A组(分别为82%和54%)。然而尚不清楚是否能转化为长期PFS和OS获益,因为这些结果在首次无效性分析中未单独报告,且随访时间较短。B组耐受性良好,但与A组相比毒性增加,包括更高的腹泻发生率(主要是低级别)、心脏事件以及≥3级中性粒细胞减少症。尽管三联方案显示出更强的治疗活性,但其增加的毒性可能限制其在frail或老年患者中的应用,这些患者可能更适合双药方案。然而三药方案可能成为高危亚组(如TP53突变患者)的标准治疗,并可能更有效地促进基于MRD的有限期治疗策略。
纳入cBTKi的一线随机II/III期研究
近期四项大型III期临床试验针对MCL患者一线治疗中应用cBTKi的不同问题进行了评估(表3)。
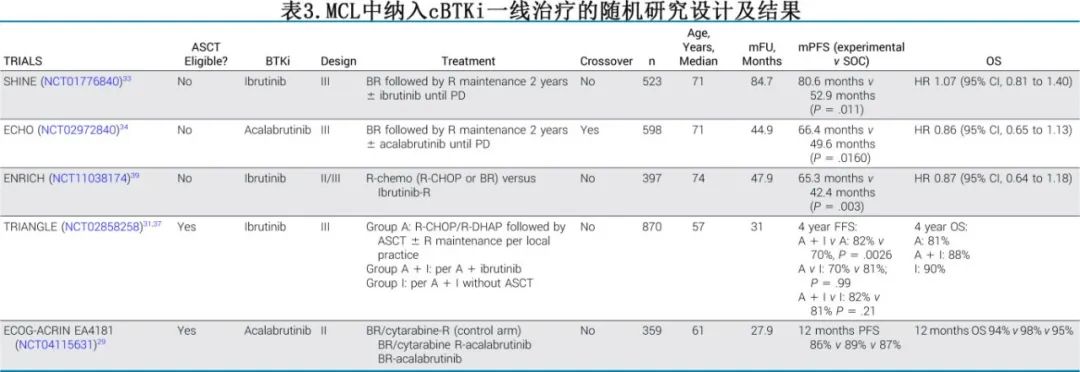
对于不适合接受自体干细胞移植(ASCT)的患者,两项研究分别评估了不同的cBTKi(SHINE研究中的伊布替尼和ECHO研究中的阿可替尼)持续应用直至疾病进展或出现不可接受的毒性,并采用了类似的设计。两项研究均表明,在苯达莫司汀-利妥昔单抗(BR)方案基础上添加持续的cBTKi治疗,随后进行利妥昔单抗维持治疗,可显著延长PFS,但并未改善OS。这两项研究均以PFS为主要终点,并且都达到了主要终点。两项研究均未专门针对OS进行设计或具备足够的统计效能。在SHINE研究中,伊布替尼组的OS呈现出劣于对照组的趋势,与该组中因毒性导致的死亡人数较多有关。而在ECHO研究中,由于疾病控制的改善,并未观察到这种趋势。尽管ECHO研究允许安慰剂组患者在疾病进展后交叉接受阿可替尼治疗(这是设计上的一个关键差异),但两组的OS并无差异。美国FDA最近(2025年1月)批准苯达莫司汀-阿可替尼联合方案用于不适合ASCT的初治MCL患者。与SHINE研究不同的是,ECHO研究的实验组呈现出OS获益的趋势,尤其是在进行预设的COVID-19敏感性分析时,这种趋势更为明显。这两项研究引发出一个关键问题:序贯治疗(即先进行化疗免疫治疗,随后在复发时使用cBTKi)是否足够。两项研究均未专门设计来回答这一问题,但在ECHO研究中,随机分配到对照组的患者中有69%在疾病进展后接受了cBTKi治疗。一些观察性数据集可能为这些决策提供参考。在澳大利亚的一项研究中,约7%的MCL患者在接受二线治疗之前死于淋巴瘤,这一数据为将cBTKi纳入初始治疗提供了依据。相比之下,由美国梅奥诊所牵头的一项大型美国联盟研究分析了491例接受一线BR方案治疗后序贯二线cBTKi治疗的MCL患者的无事件生存期2(EFS2)。采用这种方法的中位EFS2为68.1个月,与ECHO研究中苯达莫司汀-阿可替尼组的中位PFS(66.4个月)大致相当。这种前瞻性试验队列与回顾性数据集之间的比较存在固有局限性,包括ECHO研究中COVID-19事件的影响以及基线特征的差异。然而,观察性数据集中s-MIPI高危患者的比例更高(40% vs 24%),而TP53突变率(11% vs 7%)和母细胞性/多形性组织学的比例(13%)相似。正如预期,两项研究中将cBTKi与BR联合使用均增加了AE的发生率,其中最常见的是中性粒细胞减少症和腹泻。伊布替尼的加入导致房颤发生率更高,在SHINE研究中,苯达莫司汀-伊布替尼组的房颤发生率为13.9%,而ECHO研究中苯达莫司汀-阿可替尼组为6.7%。两项研究中的高血压、出血和关节痛发生率相似。SHINE研究主要在COVID-19大流行之前进行,伊布替尼-BR组与BR组之间因COVID-19导致的死亡人数差异很小(3例 vs 2例)。相比之下,ECHO研究是在大流行期间进行的,阿可替尼组的COVID-19相关事件(所有级别、≥3级和5级)发生率均高于安慰剂组(分别为41% vs 30%、20% vs 17%和9.4% vs 6.7%)。在老年患者群体中,选择一线治疗方案时应谨慎考虑苯达莫司汀和cBTKi联合时带来的心血管风险和免疫抑制增加。
在适合移植的患者中,将cBTKi与免疫化疗联合使用的获益也很明显。在TRIANGLE研究中,870例患者被随机分配到三个治疗组之一:利妥昔单抗、环磷酰胺、多柔比星、长春新碱、泼尼松(R-CHOP)/利妥昔单抗、地塞米松、高剂量化疗阿糖胞苷、顺铂(R-DHAP),序贯进行自体干细胞移植(ASCT)(A组);R-CHOP +伊布替尼/R-DHAP,序贯ASCT,再进行2年的伊布替尼维持治疗(A+I组);R-CHOP + 伊布替尼/R-DHAP,不进行ASCT,随后进行2年的伊布替尼维持治疗(I组)。在LYMA研究结果确认ASCT后利妥昔单抗维持治疗的OS获益后,所有组的患者均被允许根据研究者判断接受利妥昔单抗维持治疗。在主要分析中,中位随访时间为31个月,含伊布替尼组在ORR和无失败生存期(FFS)方面均优于对照组。在4年随访后,TRIANGLE研究确认含伊布替尼组在OS方面优于对照组。在某些高危亚组(Ki-67 > 30%、高p53表达和母细胞性组织学)中,A+I组在FFS方面显示出优于I组的非显著趋势。因此,尽管不能排除ASCT对少数患者具有潜在获益,但已知ASCT会增加毒性,而TRIANGLE研究的总体结果表明,在伊布替尼可用的情况下,可以省略ASCT,作者建议I组可视为这一较年轻患者群体的新标准治疗。重要的是要强调,由于毒性增加,伊布替尼不能与诱导治疗中的大剂量阿糖胞苷联合使用。
所有三项研究均在不同人群中进行,包括cBTKi联合利妥昔单抗维持治疗。无论是否联合ASCT,cBTKi维持治疗似乎具有可耐受性,并能延长疾病控制的持续时间。cBTKi维持治疗的最佳持续时间仍未确定。
ENRICH研究是首个比较一线无化疗策略(IR)与免疫化疗(研究者选择的BR或R-CHOP)的试验,显示IR延长PFS,但并未改善OS。值得注意的是,试验组的获益仅在与R-CHOP亚组的比较中观察到,而非与BR亚组的比较中。IR组3-4级中性粒细胞减少症的发生率较低,且生活质量改善更快,尽管心脏毒性更大(22%的全级别和6%的≥3级房颤)。因此,ENRICH研究将抗CD20联合cBTKi(伊布替尼)无化疗方案定位为一线治疗中的相关选择,为无化疗的一线治疗时代铺平了道路。
尽管是II期设计(而非III期),ECOG-ACRIN EA4181研究将年龄小于70岁的MCL患者随机分配到三个治疗组之一:苯达莫司汀-利妥昔单抗联合大剂量化疗阿糖胞苷和利妥昔单抗(BR/HDAC)、BR/HDAC联合固定疗程的阿可替尼(BR/HDAC-A)以及苯达莫司汀联合固定疗程的阿可替尼(BR-A)。主要终点是PET完全代谢缓解(CMR)和通过ClonoSeq检测的uMRD率(<10⁻⁵)。主要分析集包括260例基线克隆序列明确且治疗结束时有MRD结果的患者。由于缺乏优越性导致BR-A组提前关闭。所有组的PET CMR/uMRD率均较高,尽管阿可替尼的加入并未改善疗效,但其联合阿糖胞苷时导致了更大的毒性(血液学和发热性中性粒细胞减少症)。这与TRIANGLE研究结果形成对比,在TRIANGLE研究中,伊布替尼在大剂量阿糖胞苷期间暂停给药,从而突显了这种给药策略的重要性。相对较短的中位随访时间(28个月)和研究设计(允许研究者自行决定巩固治疗方案)使得难以就固定疗程阿可替尼对PFS和OS的影响得出明确结论,尽管在12个月时点它们似乎相似。目前尚不清楚较年轻患者(即≤65岁)是否可以合理地接受BR-A来替代TRIANGLE方案,而目前,TRIANGLE方案是唯一在大型随机试验中显示出优于标准治疗方案的PFS和OS的治疗方案。然而,对于不适合接受蒽环类或铂类药物治疗的较年轻患者,BR-A可能是一种可能的诱导治疗选择。
尽管存在亚组分析的局限性,但这四项III期研究均未明确识别出从添加cBTKi中获益更多(或更少)的MCL患者亚组,表明无论患者的具体特征如何,所有患者均能从一线添加cBTKi中获益。
R/R MCL cBTKi治疗后的其他BTK靶向治疗
cBTKi在MCL患者初始治疗中的成功,导致了开发对这些药物耐药患者有效的药物的需求。尽管在TRIANGLE研究中采用固定疗程的cBTKi可能为再次治疗提供机会,但大多数MCL患者最终仍会在这些药物治疗后经历疾病进展。可逆的非共价BTK(ncBTK)抑制剂匹妥布替尼因此开发出来,以克服C481S突变(C481S突变导致许多接受伊布替尼治疗的CLL患者获得性耐药)。尽管大多数MCL患者在出现cBTKi耐药时是通过非C481S依赖机制实现的,但BRUIN研究者证明匹妥布替尼在这种情况下非常有效。在BRUIN研究的MCL II期队列中,主要疗效队列包括在I/II期中接受治疗的前90例既往接受过cBTKi治疗的患者。中位年龄为70岁,患者既往接受过中位3线治疗,其中78%的患者具有中危或高危简化MCL国际预后指数(s-MIPI)评分。ORR为58%(CRR 20%)。在最近一次更新中,使用了更大的数据集(152例患者),并提供了更多关于高危亚组的信息:尽管亚组样本量较小,但在母细胞性(6/15,40%)或多形性(8/17,47%)组织学、TP53突变(13/30,43%)和Ki67 ≥ 30%(20/45,44%)的患者中,ORR相似。同样,根据既往使用的cBTKi,ORR并无差异:伊布替尼(n=59;ORR 59%)、阿可替尼(n=31,ORR 58%)或泽布替尼(n=6,ORR 50%)。13例既往接受过CAR-T细胞治疗的患者ORR数值较低(38%),与最近从美国学术联盟公布的观察数据集中的结果相似(n=13,ORR 31%)。在III期随机BRUIN-321研究中,匹妥布替尼正在与医生选择的cBTKi进行比较,用于未接受过BTKi治疗的R/R MCL患者。主要终点是PFS,主要疗效分析预计将在不久的将来进行。
另一种可逆的ncBTKi药物Nemtabrutinib也在cBTKi失败后的MCL中作为单药治疗进行评估,包括BELLWAVE-003研究(目前尚未有结果公布),以及Ib期WAVELINE-006研究的C队列,与ROR1抗体偶联药物Zilovertamab Vedotin联合使用。在28例接受治疗的患者中,目前ORR为64%(CRR 32%),但Nemtabrutinib单药治疗的疗效仍需等待单药治疗研究数据公布后才能明确。
BTK蛋白降解剂是一类新型药物,通过与BTK和E3泛素连接酶结合,形成三元复合物,导致多泛素化和降解,从而降低BTK蛋白水平。这一类中临床进展最快的药物是BGB-16673、NX-5948和ABBV-101。BGB-16673的I期CaDAnCe研究的初步数据包括4例接受过cBTKi治疗的MCL患者,观察到1例缓解。该研究正在进行中,并且在其他疾病亚型(包括CLL、惰性B细胞淋巴瘤和华氏巨球蛋白血症)中显示出令人鼓舞的疗效。值得注意的是,既往接受过共价和非共价BTK抑制剂治疗的患者也出现了缓解,其安全性与其它BTK抑制剂相似,瘀伤是最常见的AE。研究仍在招募患者,预计会有更多MCL患者的更多数据。NX-5948的I期研究早期数据也显示出前景,CLL队列中初步疗效令人鼓舞。研究正在招募MCL患者。ABBV-101的I期研究正在进行中,目前尚无数据公布。
未来范式
基于近期在前瞻性临床试验中生成的关于一线应用BTKi的数据,作者在图1中提出了一个潜在的未来症状性套细胞淋巴瘤(MCL)一线治疗管理原则,但也应认识到BTKi的可用性受限于地理区域、报销和获取途径。
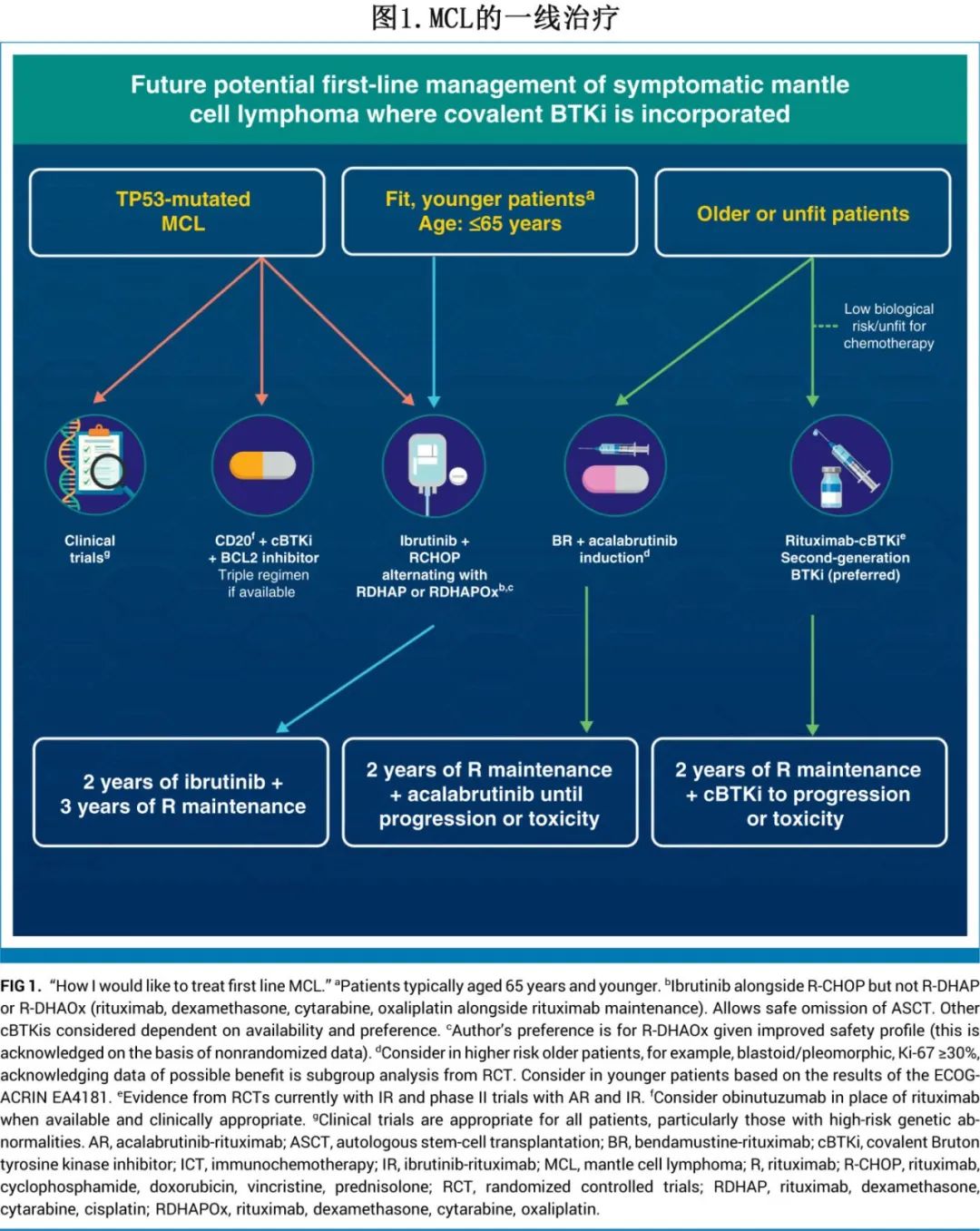
尽管TRIANGLE研究的结果使得ASCT巩固治疗变得过时,但年轻/fit对比老年/unfit的二分法仍然大致有效,因为大多数前瞻性试验都是基于这种分类设计的。对于年轻患者,鉴于TRIANGLE研究中观察到的OS获益,以及含伊布替尼组(I组和A+I组)以及A+I组的额外毒性,作者支持采用R-CHOP-伊布替尼/R-DHAP/Ox诱导治疗,随后进行伊布替尼和利妥昔单抗维持治疗,并安全地省略ASCT。根据可用性和偏好,其他毒性较小的第二代cBTKi也可以替代伊布替尼。对于老年或体能较差的患者,ECHO研究的积极结果促使美国FDA批准苯达莫司汀-阿可控替尼(BR-A),为适合化疗的患者提供了一种新的标准治疗选择。来自随机ENRICH和II期ALTAMIRA试验的最新证据表明,利妥昔单抗和cBTKi的联合方案为生物学风险较低的疾病患者(定义为无TP53异常、经典组织学和低Ki67 < 30%)以及不适合接受全剂量免疫化疗的患者提供了一种安全且高效的治疗选择。在这两种策略中,应进行2年的利妥昔单抗和cBTKi维持治疗,直至疾病进展或出现毒性,除非有强有力的证据表明需要改变。重要的是,对于TP53突变患者,作者强调目前缺乏明确的标准治疗,并建议所有患者参加临床试验,或者如果可用,考虑抗CD20-cBTKi-BCL2i三联方案(基于BOVen和OASIS I研究数据)。
随着一线治疗逐渐纳入持续和固定疗程的cBTKi治疗,R/R MCL的未来治疗策略将利用新的治疗工具,包括CD19 CAR-T细胞治疗、非共价BTK抑制以及目前正在研究的其他疗法,如双特异性抗体、BTK降解剂和ROR1抗体偶联药物。在图2中,作者提出了一个潜在的未来治疗原则,针对接受一线基于cBTKi治疗后R/R MCL患者的可用疗法。
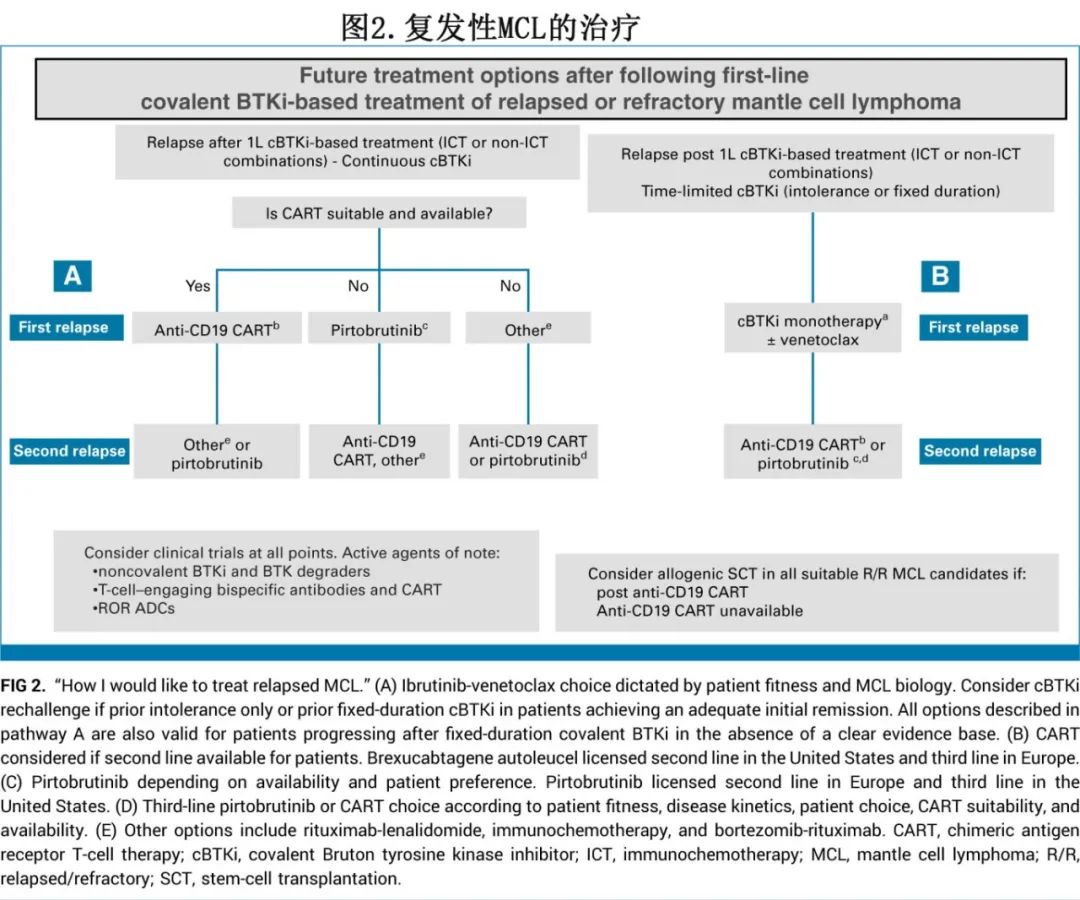
对于在初始有限疗程cBTKi治疗中获得缓解和足够缓解的患者,应在首次复发时考虑使用cBTKi(单独或联合维奈克拉)进行再治疗。关于cBTKi再治疗的有限数据突显了未来研究的必要性,以基于临床和分子特征识别最佳候选者。对于在持续一线cBTKi治疗中进展的患者,推荐使用CD19 CAR-T细胞治疗,例如brexucabtagene autoleucel,因为ZUMA-2研究中报告了其高疗效,最佳ORR为91%,CRR为68%,中位PFS为25.8个月,尽管少数患者是在二线环境中接受治疗的。如果CAR-T细胞治疗不适用或不可用,那么非共价BTKi 匹妥布替尼是一种耐受性良好且广泛适用的口服选择。BRUIN研究显示,在既往接受过cBTKi治疗的患者中,匹妥布替尼的ORR为58%,CRR为20%,中位PFS为7.4个月。对于具有高危特征且有合适供者的年轻、fit患者,异基因干细胞移植(SCT)仍然是某些R/R MCL患者的潜在治愈选择。其他历史上可用的治疗方案,如非交叉耐药的化疗免疫治疗、利妥昔单抗和来那度胺,在cBTKi治疗后显示出适度疗效。这强调了迫切需要通过临床试验入组来定义新的疗法,并完善R/R MCL患者在cBTKi治疗后的治疗策略。
总之,MCL的治疗正在迅速转变,随着新型非化疗药物的出现,许多患者的治疗效果得到了改善。近年来,cBTKi是最突出的例子,正如本文所述,将其纳入一线治疗的方向是明确的。尚未回答的问题是,哪些联合策略(可能利用化疗或非化疗方法)将最优化地惠及哪些患者群体。需要进一步了解和研究生物学风险、治疗的最佳时长、MRD的效用和动力学以及联合治疗的毒性,以推动进展,进一步提高MCL患者的生存率。
参考文献
Toby A. Eyre et al. Mantle Cell Lymphoma: Optimal Treatment With Bruton Tyrosine Kinase–Targeted Approaches. JCO 0, JCO-25-00146 DOI:10.1200/JCO-25-00146


