PCI并发症处理:冠脉动脉相关并发症(25年PCI指南)
时间:2025-08-13 12:09:06 热度:37.1℃ 作者:网络
经历了四十多年的发展,经皮冠状动脉介入治疗(PCI)已经成为冠心病治疗的重要手段。然而,即使技术再成熟,PCI操作的全过程中,每一个环节都可能引发严重的冠状动脉相关并发症。这些并发症一旦发生,往往来势汹汹,直接威胁患者生命。
2025年中国PCI指南在并发症防治方面进行了重要更新,强调预防为主、及时识别、快速救治的理念。熟练掌握冠状动脉相关并发症的预防策略,是确保患者安全的基本要求。每一位介入医师都应该对这些"不速之客"保持足够的警惕。

冠状动脉急性闭塞
冠状动脉急性闭塞堪称PCI术中最凶险的并发症之一。根据2025年指南定义,当术中冠状动脉血流TIMI分级降至2级及以下时,就应诊断为急性闭塞。这一并发症主要发生在术中,但也可能在术后24小时内出现,个别情况甚至延迟至24小时后。
从病理机制看,急性闭塞的"罪魁祸首"通常是球囊扩张后血管内膜严重夹层、支架远端夹层或壁内血肿向远端移位。这些情况无一例外都需要立即置入支架来恢复血流(Ⅰ,C-EO)。临床工作中我们常见的另一种情况是支架置入时挤压斑块导致分支闭塞,此时必须立即开通分支血管(Ⅰ,C-EO)。
对于冠状动脉大分支闭塞的处理,指南推荐尽快送入导丝、实施球囊扩张,必要时置入支架(Ⅰ,C-EO)。但如果导丝无法进入真腔怎么办?这时可以使用微导管远端穿通技术,即所谓的"前向夹层再入真腔"技术。这项技术的优势在于能立即恢复血流,且几乎不会再次闭塞。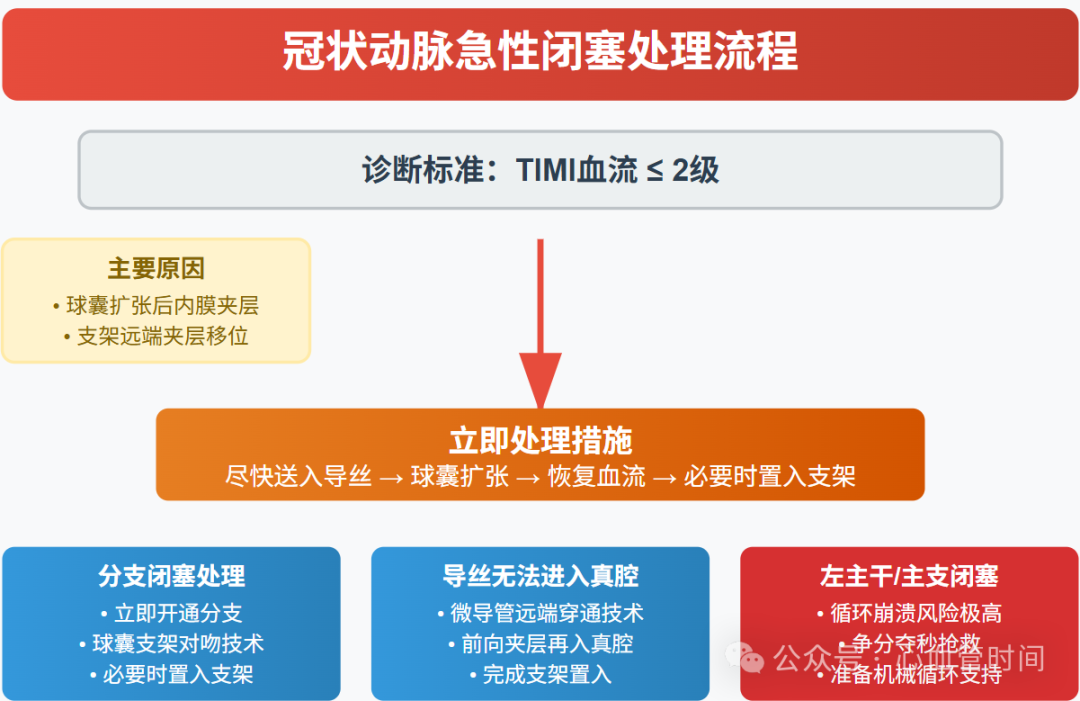
💡 笔者提示
对于有高闭塞风险的分支,建议实施球囊支架对吻技术进行预防性保护,必要时置入支架。维持导丝在冠状动脉主支和分支内是预防急性闭塞的关键技巧。一旦遇到左主干或主支开口闭塞这种"灾难性"情况,患者会立即出现循环崩溃,必须争分夺秒。
当冠状动脉左主干或主支开口发生闭塞时,由于大面积心肌缺血,患者会即刻出现血压下降、心率减慢,甚至心脏停搏,对升压药物完全无反应,形成循环崩溃状态。
冠状动脉栓塞和无复流
冠状动脉栓塞和无复流现象在临床上并不罕见,特别是在处理梗死相关动脉(IRA)、退化静脉桥血管以及斑块负荷较重的弥漫病变时。当支架植入后出现TIMI血流2级(慢血流)或1/0级(无复流)时,在排除血管痉挛、夹层和壁内血肿后即可确诊。
造成这一现象的"元凶"主要是血栓、斑块碎屑,偶尔也有气栓导致的微血管栓塞。一旦发生无复流,我们必须立即采取行动:冠状动脉内注射钙通道阻滞剂、硝酸酯类、硝普钠或替罗非班等药物。同时可以考虑血栓抽吸,并在必要时置入IABP稳定血流动力学(Ⅱa,C-EO)。
经微导管在靶病变远端局部给药往往效果更佳,而将微导管前送至冠状动脉末梢进行负压抽吸微栓子的方法也被证明更为有效(Ⅱa,C-EO)。对于冠状动脉气栓这种特殊情况,处理方法有所不同:需要从引导导管抽取动脉血8-10ml,快速推入冠状动脉内,连续操作10-15次来驱除微血管内的气栓(Ⅰ,C-EO)。
💡 笔者提示
处理气栓时有一个重要的禁忌:绝对不能推注对比剂或生理盐水!这可能导致大面积心肌缺血,后果不堪设想。这个教训来自于早期的临床实践,现在已经写入各大指南。
冠状动脉破裂或穿孔
冠状动脉破裂或穿孔是PCI中少见但极其凶险的并发症。破裂通常与严重偏心钙化、CTO病变、支架偏大或扩张压力过高相关;而穿孔则多由PCI硬导丝损伤或亲水涂层导丝穿出分支末梢所致。

一旦发生这种情况,我们的应对策略是用直径匹配的球囊在穿孔处进行低压扩张封堵,以防止心脏压塞。对于小穿孔,这种方法通常有效;但对于供血面积较大的冠状动脉,封堵需要间断进行,同时尽快置入覆膜支架。
更为复杂的是,在准备外科手术的过程中,为了防止持续封堵引起严重心肌缺血,我们需要采用一种巧妙的"供血"技术:应送入微导管至冠状动脉破口远端,并从引导导管抽出动脉血注入微导管为冠状动脉远端供血(Ⅰ,C-EO)。
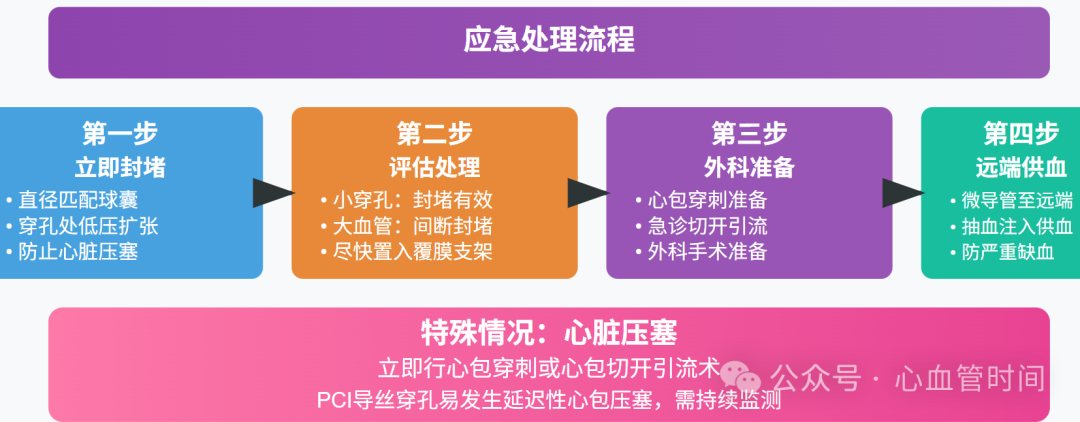
预防策略的核心在于针对病因:对严重偏心钙化和CTO病变应使用IVUS指导支架置入;整个PCI过程中密切注意导丝位置,避免血管穿孔。PCI导丝造成的穿孔特别容易发生延迟性心包压塞,需要格外警惕。
冠状动脉支架内血栓形成
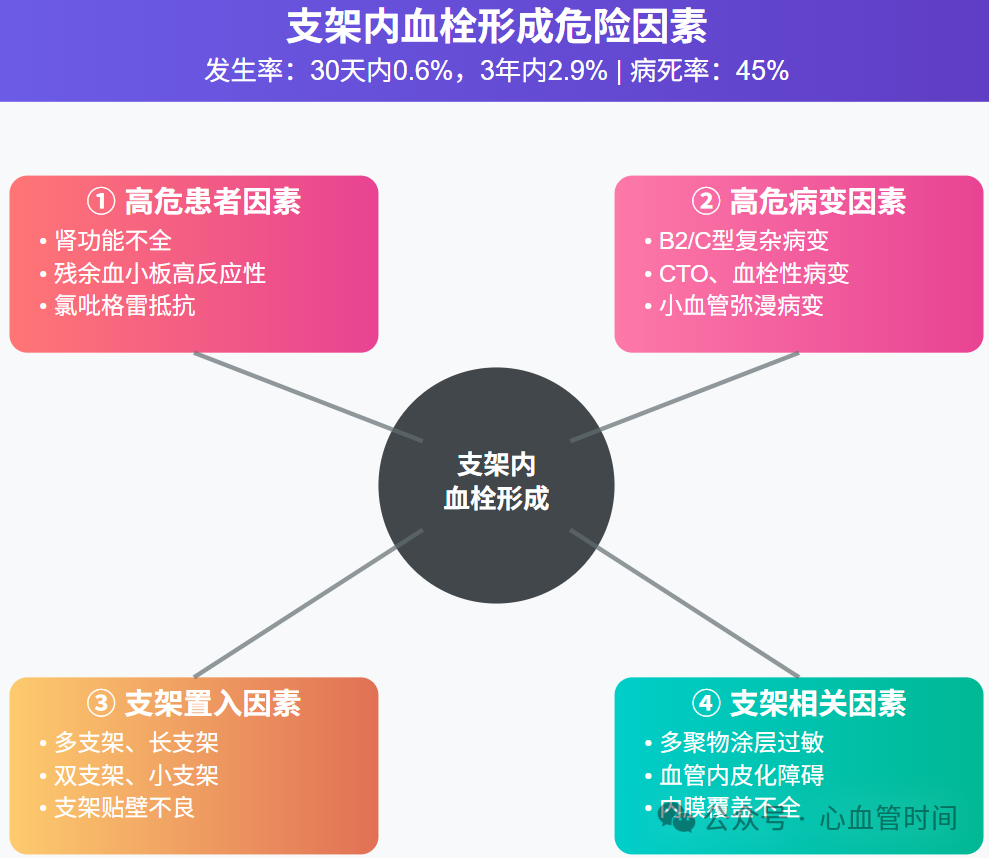
虽然支架血栓形成的发生率相对较低(30天内约0.6%,3年内约2.9%),但其病死率却高达45%,这使得它成为PCI术后最令人担忧的并发症之一。
MUSIC标准为我们提供了预防支架血栓的重要指导。这项经典研究确立了IVUS指导下支架理想置入的三个标准:支架完全贴壁、支架内最小管腔横截面积≥平均远端参考血管横截面积的90%、偏心指数≥0.7。遵循这些标准,能够显著降低支架血栓风险。
支架血栓形成的危险因素可以归纳为四个方面:高危患者(如肾功能不全、残余血小板高反应性)、高危病变(B2或C型复杂病变)、支架置入相关因素(多支架、长支架等)以及支架相关因素(涂层过敏、内皮化障碍等)。
💡 笔者提示
随着新一代DES和替格瑞洛的广泛应用,支架血栓的危险因素主要集中在操作技术层面。我的经验是:确保支架充分紧密贴壁是关键,对复杂病变置入支架后应常规进行IVUS或OCT检查。遇到反复难治性支架血栓时,往往需要在IVUS指导下使用略大号的后扩球囊高压扩张,单纯使用GPI只能暂时有效。
术中发生的支架血栓多与抗凝强度不足有关,需要监测ACT,在充分肝素化基础上采用血栓抽吸、后扩球囊高压扩张等方法处理,直到腔内影像确认支架MLA足够大、完全紧密贴壁为止,多需要给予血小板糖蛋白Ⅱb/Ⅲa抑制剂(GPI)(Ⅱa,C-EO)。对于血栓负荷重的病变,常规使用GPI是必要的(Ⅱa,A),前者也可给予冠状动脉内小剂量的溶栓治疗(Ⅱb,C-EO),以防出血并发症。
冠状动脉支架脱载
支架脱载虽然已经相对少见,但一旦发生仍需谨慎处理。这种情况多因冠状动脉弥漫迂曲、严重钙化等复杂病变预处理不充分,导致支架通过阻力过大。
处理策略包括:如果支架匹配可就地置入;如果支架过细,可充分预处理后再置入另一支架挤压至血管壁;也可尝试小球囊、导丝缠绕、延伸导管辅助或圈套器等方法取出。当支架被引导导管口卡住时,应立即停止回撤,可尝试延长导管套住脱载支架后撤出(Ⅱa,C-EO)。
预防的关键在于充分的病变预处理,特别是对严重钙化病变,应使用旋磨等方法预处理,经非顺应球囊充分扩张后再置入支架。
围术期心肌损伤和心肌梗死:容易被忽视的并发症
PCI术后围术期心肌损伤或心肌梗死较为常见。根据第4版心肌梗死通用定义,术后肌钙蛋白升高超过99%分位值和5倍正常参考值上限,可分别诊断心肌损伤和心肌梗死(Ⅰ,B-NR)。
这类心肌梗死属于4型心肌梗死,包括因冠状动脉及其分支急性闭塞、栓塞或无复流等并发症导致的4a型,以及支架内血栓导致的4b型。研究表明,PCI术后48小时内的心肌梗死能够预测远期心血管不良事件的风险。
抗凝和抽吸策略
在抗凝策略方面,我们需要根据患者的缺血和出血风险,选择抗血小板和抗凝方案。对于高出血风险患者,应首选比伐芦定抗凝,并采用桡动脉入路(Ⅰ,A),原则上非必要不置入支架(Ⅰ,C-EO)。
入选6016例STEMI患者的BRIGHT-4研究显示,比伐芦定延长3小时方案较普通肝素能使30天全因死亡和主要出血的复合终点事件发生率降低31%,且不增加支架内血栓风险。
值得注意的是,在血栓抽吸方面,TOTAL试验等研究得出了阴性结果,不推荐常规进行冠状动脉内血栓抽吸(Ⅲ-NB,A)。但对于血栓负荷较重、支架内血栓以及血栓性静脉桥血管病变,仍应使用血栓抽吸以降低栓塞和无复流风险(Ⅱa,C-EO)。


