论文解读|Qiang Zhou/Jixing Ye/Pei Li教授团队揭示APPswe经Notch双向调控MSCs成骨
时间:2025-08-14 12:13:11 热度:37.1℃ 作者:网络
阿尔茨海默病(AD)是最常见的年龄相关性神经退行性疾病之一,在全球≥65岁人群中患病率约为10%,并常伴发显著的骨量丢失与骨折风险升高。淀粉样前体蛋白(APP)的瑞典突变体(APPswe)是AD的经典致病蛋白,但其在骨稳态中的作用及机制长期未被阐明。
重庆医科大学的Qiang Zhou/Jixing Ye/Pei Li在本刊发表了题为“The bidirectional effects of APPswe on the osteogenic differentiation of MSCs in bone homeostasis by regulating Notch signaling”的研究论文,系统分析了APPswe及其胞内段与胞外段对骨形态发生蛋白2(BMP2)诱导的间充质干细胞(MSCs)成骨分化的影响。
研究团队利用基因表达综合数据库(GEO)发现,APP表达水平与MSCs的成骨分化呈正相关,但与其增殖和迁移呈负相关。值得注意的是,APPswe促进了BMP2诱导的MSCs成骨分化,而缺乏胞内段、仅含胞外段的APPswe-C则表现出相反效果(图1)。这些发现表明,APPswe的胞内段在促进成骨过程中发挥关键作用。
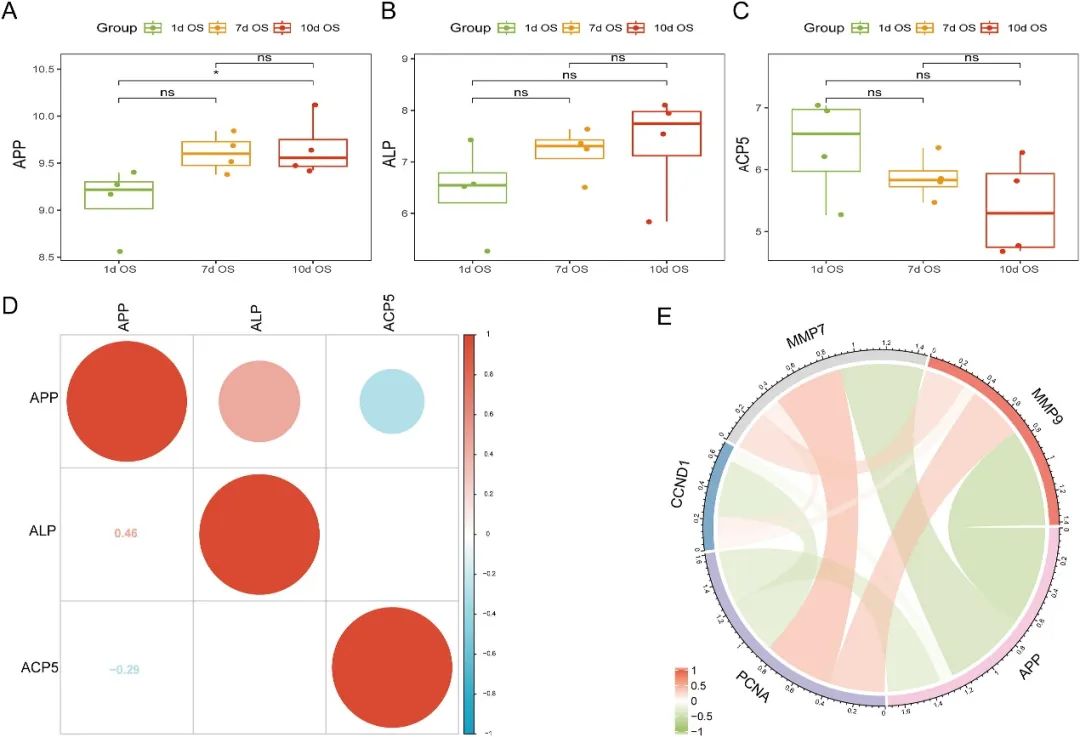
图1 生物信息学初步探究了APPswe在成骨转化中的分子机制(原文中Figure 1)
体外实验显示,APPswe的胞内段通过自身产生的AICD(APP胞内域)调控NICD(Notch胞内域)的表达与核转位,从而抑制Notch信号通路,促进MSCs成骨分化。相反,NICD的过表达则逆转了APPswe对MSCs成骨分化的促进作用(图2)。此外,在大鼠原代骨髓MSCs中,使用载BMP2的明胶甲基丙烯酰(GelMA)水凝胶进行体内实验,结果显示APPswe处理组骨修复效果最佳,而APPswe-C处理组骨修复效果最差。
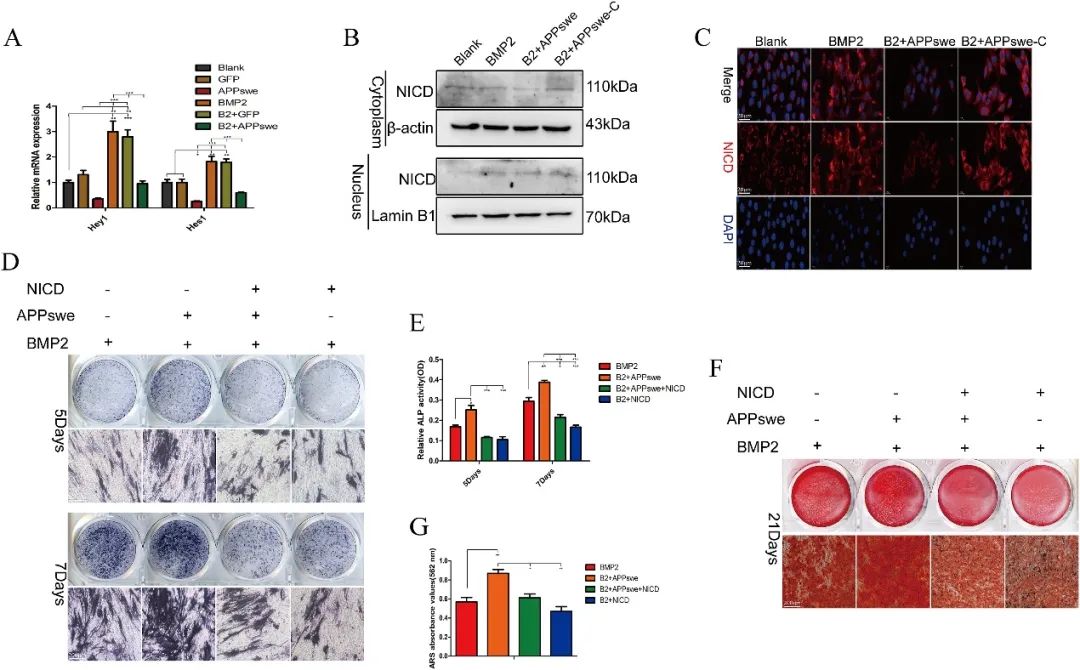
图2 APPswe通过调控Notch信号通路影响间充质干细胞的成骨分化与增殖(原文中Figure 6)
综上所述,本研究表明APPswe通过调控Notch信号通路促进MSCs成骨分化。然而,其胞外段却阻碍了MSCs的自我更新、增殖与迁移,导致干细胞储备逐渐耗竭,从而影响长期骨形成。该研究为阿尔茨海默病患者骨量丢失的早期诊断与治疗,以及改善骨折修复效果提供了理论依据。
免费全文下载链:
https://www.sciencedirect.com/science/article/pii/S2352304224001144
引用这篇文章:
Wang N, Shen X, Huang H, et al. The bidirectional effects of APPswe on the osteogenic differentiation of MSCs in bone homeostasis by regulating Notch signaling. Genes Dis. 2025;12(4):101317.


