心源性休克:定义、分级、发病机制、诊断方法
时间:2025-08-15 12:11:23 热度:37.1℃ 作者:网络
随着人口老龄化和医疗技术的发展,心源性休克的发病模式和治疗策略都在发生着深刻变化。从传统的药物治疗到现代的机械循环支持,从单科室救治到多学科团队协作,这个领域的每一次进步都关系着无数患者的生命。
在本系列文章,我们将根据SCAI的指南,系统梳理心源性休克的核心知识点,希望对大家有所帮助!
重新认识心源性休克的定义
心源性休克本质上是一种低心排血量衰竭状态,其核心特征是导致终末器官低灌注和缺氧。当心脏泵功能衰竭后,会引发一系列神经体液和炎症反应的级联反应,常常发展为全身炎症反应综合征(SIRS)。如果心源性休克进展为代谢性休克,即使给予积极治疗也往往难以逆转,这就解释了为什么早期识别和及时干预如此重要。
心源性休克的病因相当复杂多样。失代偿性心力衰竭和急性心肌梗死是最常见的两大原因,其中急性心梗约占所有病例的50-70%。瓣膜疾病引起的急性血流动力学恶化、病毒性心肌炎的暴发性病程、大面积肺栓塞导致的急性右心衰竭、心包填塞或缩窄性心包炎的急性发作、严重的缓慢性或快速性心律失常,以及各种原发性或继发性心肌病的急性失代偿,都可能在短时间内导致心源性休克。
特别值得注意的是医源性因素在现代医疗环境中的作用。某些抗心律失常药物的负性肌力作用、β受体阻滞剂或钙通道阻滞剂的过量使用、介入操作相关的并发症,甚至是麻醉药物的心脏抑制作用,都可能成为心源性休克的诱发因素。
从表型特征来看,心源性休克可以分为急性与慢性、单心室与双心室衰竭、充血性与非充血性等不同类型。这种分类对于制定个体化治疗方案具有重要意义。急性左心衰导致的休克往往起病急骤、进展迅速,而慢性心衰急性失代偿的患者往往有更长的代偿期和相对更好的预后。

SCAI休克分级:现代心源性休克评估的金标准
近年来,SCAI休克分级系统的提出为我们提供了更为精确和实用的分类工具,这已经成为临床和学术研究中广泛采用的标准。该系统将心源性休克分为A至E五个阶段:
A期(At Risk):患者血流动力学稳定,没有心源性休克的症状和体征,但存在发生休克的风险,如大面积心肌梗死或失代偿性心力衰竭的早期阶段。
B期(Beginning):出现血流动力学不稳定的临床证据,包括低血压、心动过速或异常的全身血流动力学,但尚无低灌注表现。
C期(Classic):出现明显的低灌注临床证据,初始需要药物或机械支持,通常伴有低血压。
D期(Deteriorating):有休克的临床证据,尽管治疗升级但病情恶化或无改善。
E期(Extremis):难治性休克或实际的/即将发生的循环衰竭。
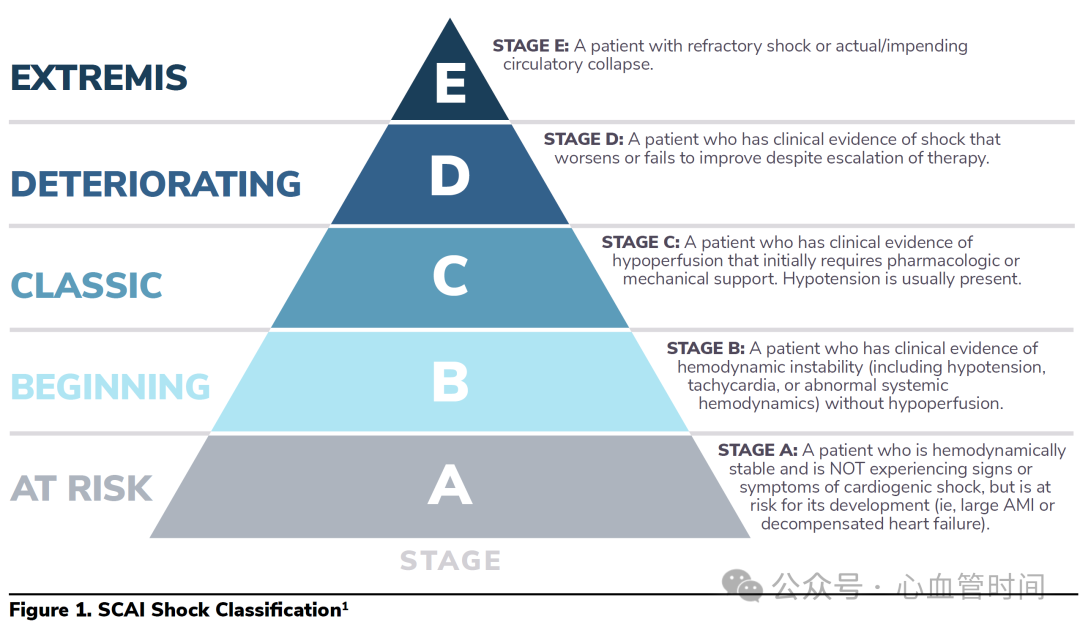
多项研究验证了SCAI休克分级与死亡率的密切关系,分级越高死亡率呈指数性增长。这种分级系统不仅有助于预后判断,更重要的是能够指导治疗决策的时机把握和强度选择。
临床诊断:从床旁到实验室的系统评估
心源性休克的诊断需要结合体格检查、实验室检查和血流动力学监测三个维度的信息。这种多维度的评估方法能够帮助我们更准确地判断病情严重程度和指导治疗方向。
体格检查
意识状态改变往往是心源性休克最早出现的症状之一,从轻度的反应迟钝到昏迷都可能出现。少尿或无尿(尿量<0.5ml/kg/h)反映了肾脏灌注不足。呼吸系统的表现包括呼吸音减弱、湿啰音、端坐呼吸等,这些往往提示肺水肿的存在。
循环系统的体征更为复杂:毛细血管充盈时间延长(>2秒)、四肢末端发凉提示外周灌注不足;颈静脉怒张反映右心充盈压升高;心脏杂音可能提示瓣膜病变或乳头肌功能不全;下肢水肿等充血表现提示右心功能不全。
实验室检查
血乳酸水平是评估组织灌注最重要的指标,持续升高的乳酸(>2mmol/L)往往提示预后不良。心肌标志物包括肌钙蛋白、CK-MB等,不仅有助于病因诊断,其动态变化也能反映心肌损伤的程度。
肾功能指标(肌酐、尿素氮)、电解质(特别是钠、钾)和肝功能的变化反映了多器官功能状态。全血细胞计数有助于评估是否存在感染或血液系统疾病,凝血功能的监测对于后续抗凝治疗和有创操作至关重要。
值得特别关注的是LDH、触珠蛋白和纤维蛋白原等指标,这些在评估溶血、炎症反应和凝血状态方面具有重要价值,特别是在使用机械循环支持设备时。
血流动力学监测的精准化
现代心源性休克的管理越来越依赖于精确的血流动力学监测。心率异常(心动过缓<60次/分或心动过速>100次/分)、血压变化(低血压<90mmHg或严重高血压>180mmHg)是最基本的参数。
更重要的是一些高级参数:心脏功率输出/指数被认为是评估心脏泵功能最可靠的指标;心排血量/指数直接反映心脏的泵血能力;充盈压的测定有助于区分血容量不足和心功能不全;右心房与肺毛细血管楔压比值对于评估右心功能具有重要意义;肺动脉搏动指数和右室做功指数则是评估右心储备功能的重要参数。

💡 笔者提示
在临床实践中,我们发现很多医生对血流动力学参数的解读还不够熟练。建议重点关注几个核心指标:心指数<2.2L/min/m²、肺毛细血管楔压>18mmHg、混合静脉血氧饱和度<60%,这些往往提示需要升级治疗。同时,动态观察比单次测量更有意义,特别是对治疗反应的评估。
病理生理机制:恶性循环的分子基础
心源性休克的病理生理过程本质上是一个复杂的恶性循环。左心室功能衰竭的核心机制包括左室顺应性下降、左室舒张末期压力升高、左室扩张以及收缩功能减退。当左室收缩功能受损时,机体会启动代偿性心动过速来维持心排血量,同时肾素-血管紧张素-醛固酮系统(RAAS)激活和儿茶酚胺释放增加,导致钠潴留和外周血管收缩。

这些代偿机制在短期内能够改善心排血量,但长期来看却会导致冠脉和外周组织灌注进一步恶化,形成恶性循环。冠脉灌注压下降会加重心肌缺血,进一步损害心功能;外周血管收缩增加后负荷,加重心脏工作负担。
右心室功能衰竭的机制同样复杂但常被忽视。右室顺应性下降导致右室扩张和外周淤血,右室扩张还会引起室间隔向左偏移,进一步降低左室顺应性和功能。这种现象被称为"室间相互依赖性",在临床处理中经常被低估。右心衰竭还会导致左室前负荷不足,最终影响心排血量。
当心脏泵功能持续衰竭时,会激活强烈的神经体液级联反应,包括交感神经系统过度激活、RAAS系统持续激活、抗利尿激素分泌增加等。这些反应进一步激发全身炎症反应,产生大量炎症介质,导致血管通透性增加、病理性血管扩张和心肌抑制因子释放,最终发展为全身炎症反应综合征(SIRS)。
流行病学:变化中的疾病谱
心源性休克的流行病学特征在过去几十年中发生了显著变化。急性心肌梗死并发心源性休克的发生率约为5-10%,这一比例在STEMI患者、女性患者以及75岁以上老年患者中更高。SHOCK研究作为该领域的里程碑性研究,证实了早期血运重建策略能够显著改善AMI并发心源性休克患者的预后,该研究改变了整个学科的治疗理念。
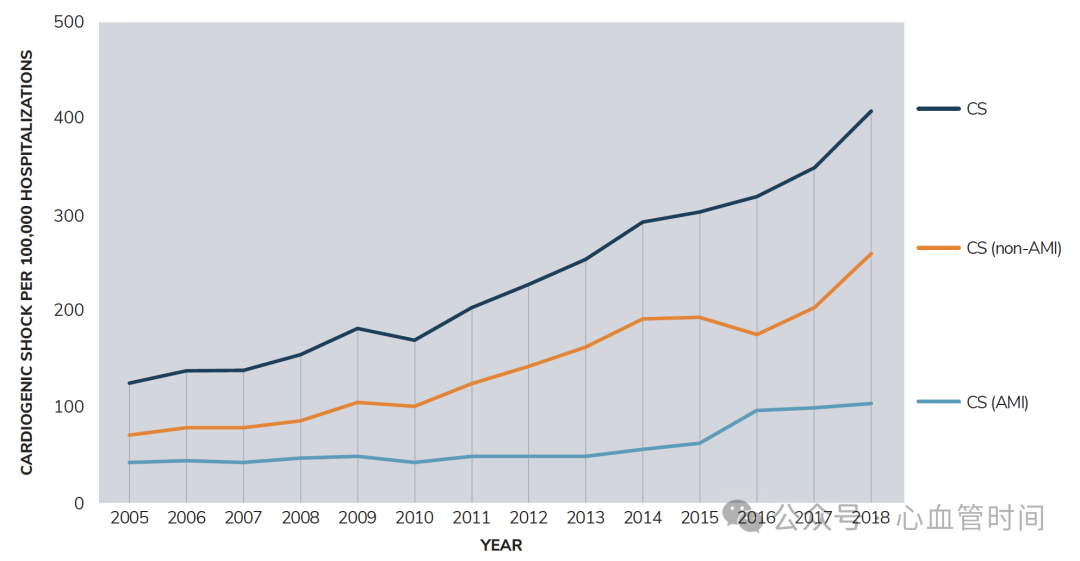
单纯右室梗死导致的心源性休克相对少见,约占心源性休克患者的3-5%,但双室休克却占到所有心源性休克患者的30-50%,这种情况往往预后更差,需要更加积极的治疗策略。
现在的心源性休克患者往往合并症更多、病情复杂程度更高,住院时间更长,医疗资源消耗更大,再住院率也显著增高。这些变化直接导致了非心梗性心源性休克发病率的显著增长,失代偿性心力衰竭、心肌炎、瓣膜病变等原因导致的心源性休克在临床上越来越常见。
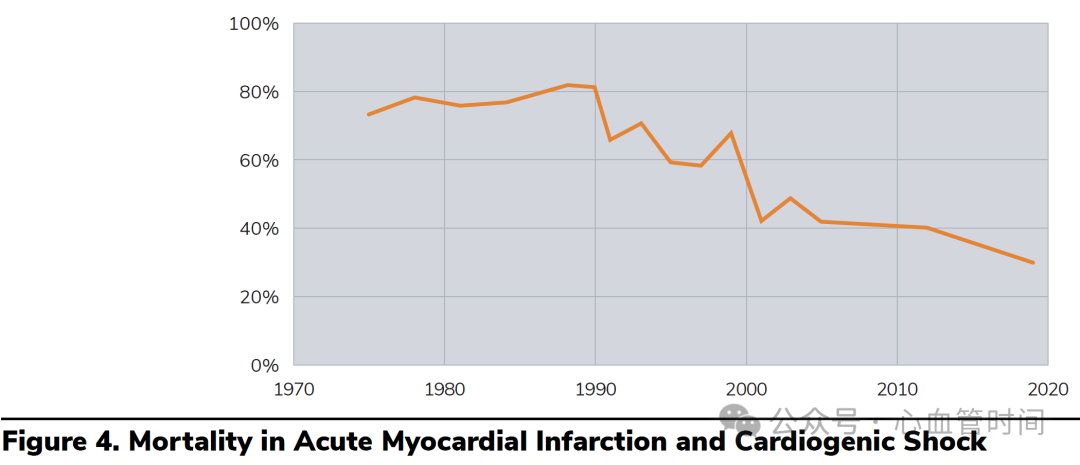
预后评估与死亡率的历史变迁
心源性休克仍然是心血管急症中死亡率最高的疾病之一。在经皮冠状动脉介入治疗(PCI)广泛应用之前,AMI并发心源性休克的死亡率高达70-80%。随着STEMI救治体系的建立和完善,这一数字已经降至40-50%,但仍然居高不下。
相比之下,慢性心衰急性失代偿导致的心源性休克预后稍好,死亡率约为20%。这种差异主要与基础心功能状态、代偿机制的完善程度以及可逆性因素的存在有关。
治疗策略演进
心源性休克的治疗理念在过去十年中发生了革命性变化。传统上主要依靠药物治疗(血管活性药物、利尿剂等)和主动脉内球囊反搏,现在已经发展为包括经皮心室辅助装置(pVAD)和体外膜肺氧合(ECMO)在内的多种机械循环支持手段。
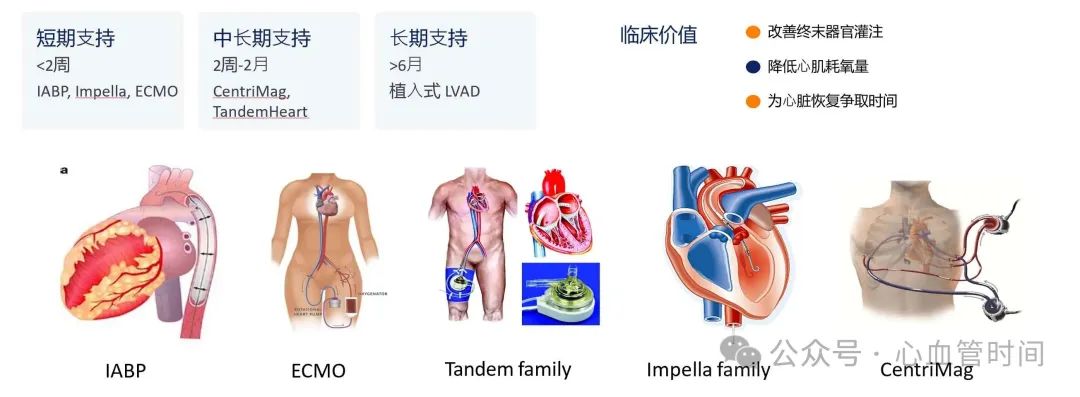
统计数据显示,机械循环支持设备的应用率在2007年到2018年间呈现显著上升趋势。pVAD在缺血性心肌病患者中的使用率从不到2%增长到超过12%,在非缺血性心肌病患者中也有类似趋势。ECMO的应用同样快速增长,特别是在那些需要呼吸和循环双重支持的患者中。
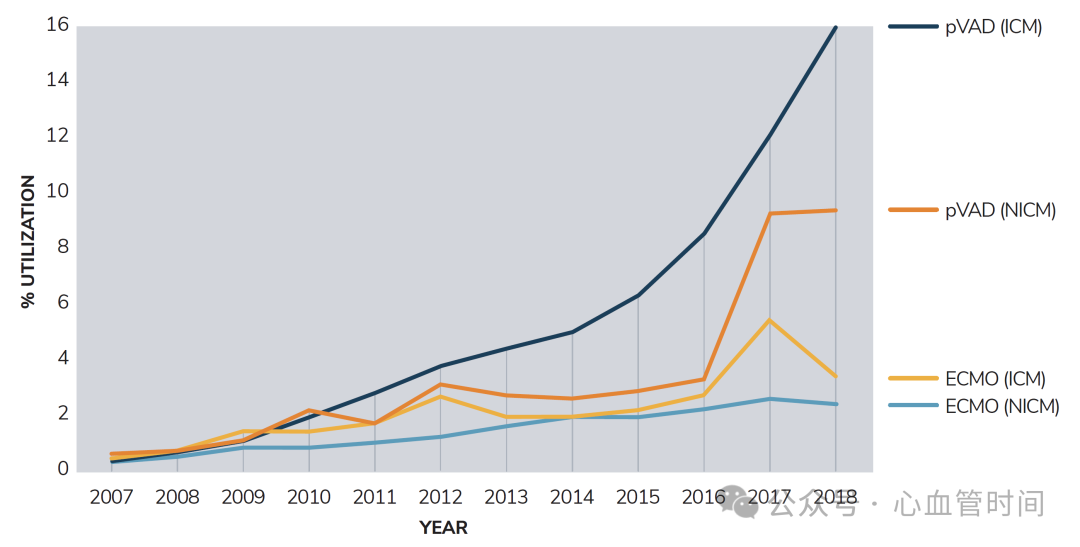
更小型化、移动性更好的经皮心室辅助装置使得心源性休克的救治不再局限于大型学术中心,越来越多的社区医院也具备了初步救治能力。这种治疗能力的下沉对于改善整体救治效果具有重要意义。
总结
心源性休克作为心血管急症中的"重症之王",其复杂的病理生理机制、多样的临床表现以及居高不下的死亡率,始终考验着我们的临床智慧。
SCAI分级系统为我们提供了标准化的评估工具,机械循环支持技术的发展给了我们更多的治疗选择,多学科团队的建立提高了救治效率。但是,早期识别、及时干预、个体化治疗仍然是改善预后的根本。


