AFM:同济大学徐余波等团队研究发现原位工程化间充质干细胞以促进成骨分化逆转炎症性衰老并恢复牙周骨稳态
时间:2025-08-18 12:17:23 热度:37.1℃ 作者:网络
牙周炎等慢性炎症性疾病给再生疗法,特别是基于干细胞的方法带来了重大挑战。传统的离体工程策略,即在移植前将纳米颗粒或生物活性分子预加载到间充质干细胞(MSC)上,通常会破坏细胞表型,限制治疗效果,并导致在靶位点的保留和植入不良。
2025年8月8日,同济大学徐余波、杜建忠、Xia Runpeng共同通讯在Advanced Functional Materials上在线发表题为“In Situ Engineering Mesenchymal Stem Cells for Osteogenic Differentiation to Reverse Inflammaging and Restore Periodontal Bone Homeostasis”的研究论文。在这项研究中,引入了一种创新的原位工程策略,涉及间充质干细胞与铈-单宁酸@牛血清白蛋白纳米颗粒(CTBNP)的共同递送,该策略能够在炎症微环境中实现实时成骨分化。
与传统方法不同,这种原位方法利用了间充质干细胞在病理生态位内的内在归巢和适应性反应,在炎症应激下实现实时功能增强和精确的生物界面调节。该策略可将MSC活力提高15%,增强成骨分化70%,并将细胞衰老降低73.2%,p21表达降低就证明了这一点。在大鼠牙周炎模型中,CTB@MSCs显着减轻炎症,减少56.25%的骨吸收,并恢复75%的牙槽骨高度,显示出在慢性炎症中具有强大的治疗潜力。总的来说,这个原位间充质干细胞工程平台为基于干细胞的牙周炎和其他炎症性疾病的治疗提供了。

牙周炎以慢性炎症和牙槽骨破坏为特征,影响着全球约一半的成年人,对口腔和全身健康都构成了重大威胁。其发病机制主要由持续性炎症和氧化应激所驱动,导致被称为炎症的加速细胞老化状态。该病理过程的特征是过量的活性氧(ROS)积累,衰老相关分泌表型(SASP)因子分泌升高、骨内稳态受损和组织再生能力受损。目前的临床治疗仅仅缓解症状,而没有有效地解决潜在的炎症和再生缺陷。
间充质干细胞(MSCs)因其固有的免疫调节和成骨分化能力,已成为牙周再生的潜在候选细胞。然而,基于MSC的治疗通常无法在牙周炎中获得稳定的疗效。近年来,基于纳米颗粒的间充质干细胞工程通过将纳米颗粒预先加载到细胞上,以增强其抗氧化和抗炎能力,在关节炎、肝损伤等炎症性疾病中显示出更好的治疗效果。尽管有这些益处,传统的体外纳米颗粒工程仍存在严重缺陷,包括间充质干细胞分化潜能降低、自我更新能力受损以及体内存活率下降。
为了克服这些局限性,本文提出了一种新的原位工程化策略。研究对这一概念的定义并非单纯的共递送,而是在病理微环境中对细胞表型进行直接调控和功能重塑。具体而言,是通过将间充质干细胞与多功能铈-单宁酸@牛血清白蛋白纳米颗粒(CTB NPs)共同递送到牙周缺损部位来实现的。研究设计理念整合了以下几点:1)铈离子(Ce³⁺/Ce⁴⁺)通过Wnt/β- 连环蛋白信号通路发挥的ROS清除和成骨分化促进能力;2)单宁酸(TA)通过 TGF-β/Smad 信号通路产生的抗炎和间充质干细胞趋化增强作用;3)牛血清白蛋白(BSA)涂层带来的纳米颗粒稳定性和生物相容性的提升。该策略利用间充质干细胞固有的归巢能力,实现纳米颗粒的精准递送和对炎症性牙周微环境的原位调控,同时不损害间充质干细胞的活力或分化潜能。实验证明,CTB基因工程MSCs(CTB@MSCs)表现出显著增强的抗氧化防御能力,降低氧化应激诱导的衰老,通过激活WNT/BMP途径改善成骨分化,并抑制中性粒细胞趋化性。在大鼠牙周炎模型中,CTB@MSCs显著减轻局部炎症,减轻骨吸收,并有效恢复了牙槽骨的完整性,优于未经修饰的MSC和单独的纳米颗粒治疗。总之,这种创新的原位MSC工程方法代表了牙周再生医学的重大进步。通过有效减轻炎症和恢复骨内环境稳定,研究不仅为临床牙周治疗提供了可能,同时也为炎症相关性退行性疾病的更广泛治疗提供了新的见解。
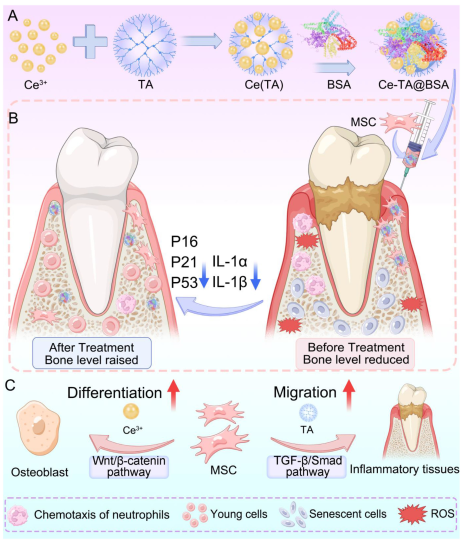
图1用于逆转炎症和恢复牙周骨稳态的原位干细胞工程的示意图(摘自Advanced Functional Materials)
参考消息:
https://doi.org/10.1002/adfm.202514199


