Nat Commun:ROSIE模型可从H&E染色图像中直接预测50种蛋白质表达,精准解析肿瘤免疫微环境
时间:2025-08-22 12:13:23 热度:37.1℃ 作者:网络
苏木精-伊红(H&E)染色是临床病理诊断中应用最广泛的检测方法,其成本低廉、操作简便、易获取以及能清晰呈现组织形态特征,目前已成为病理评估的“金标准” 之一。但H&E染色无法提供与现代精准医学相关的复杂分子信息,通过标注计算方法也仅能区分内皮细胞、上皮细胞等少数广谱细胞类别,但难以揭示更深层次的细胞微环境细节。
与之相对,多重免疫荧光(mIF)成像技术(如索引共检测技术CODEX和免疫组织化学技术 IHC)能够在原位同时检测数十种蛋白质,提供更丰富的组织微环境信息。但这类技术的应用受成本较高、实验流程耗时等限制,难以作为常规检测技术使用。因此,如何从广泛可及的H&E图像中推算蛋白质表达,成为数字病理领域一项具有重要价值的研究方向。
近日,美国斯坦福大学研究团队开发了一种名为ROSIE的深度学习框架,可通过计算推断出数十种蛋白质的表达与空间分布。该框架在超1300配对H&E-mIF样本上进行训练(涉及1600多万个细胞),覆盖10余个组织、13种疾病类型,具有良好的泛化能力。验证结果显示,ROSIE预测的生物标志物能有效识别细胞表型,可准确区分H&E难以分辨的B细胞、T细胞等淋巴细胞;还能可靠识别基质和上皮微环境,以及肿瘤浸润淋巴细胞(TILs)等免疫细胞亚型,可为相关治疗策略提供指导。总之,ROSIE为临床病理诊断和癌症研究提供了高效、经济的新工具。

为训练与验证ROSIE,研究团队首先构建了目前规模最大的H&E与mIF共染色数据集,涉及20项临床研究、16种疾病类型,覆盖胰腺、结直肠、胃食管结合部等10个解剖部位。其中,训练集包含18项研究、1342个样本、超1600万个细胞及13种疾病类型;评估集包含4项研究、485个样本、近500万个细胞及4种疾病类型。
该研究中所有组织样本均同时进行了H&E与CODEX共染色,实现了H&E与mIF图像的像素级对齐。除UChicago-DLBCL研究采用全切片样本外,其余数据集均由组织微阵列(TMA)芯片组成,提升了模型对不同样本类型的适配性。
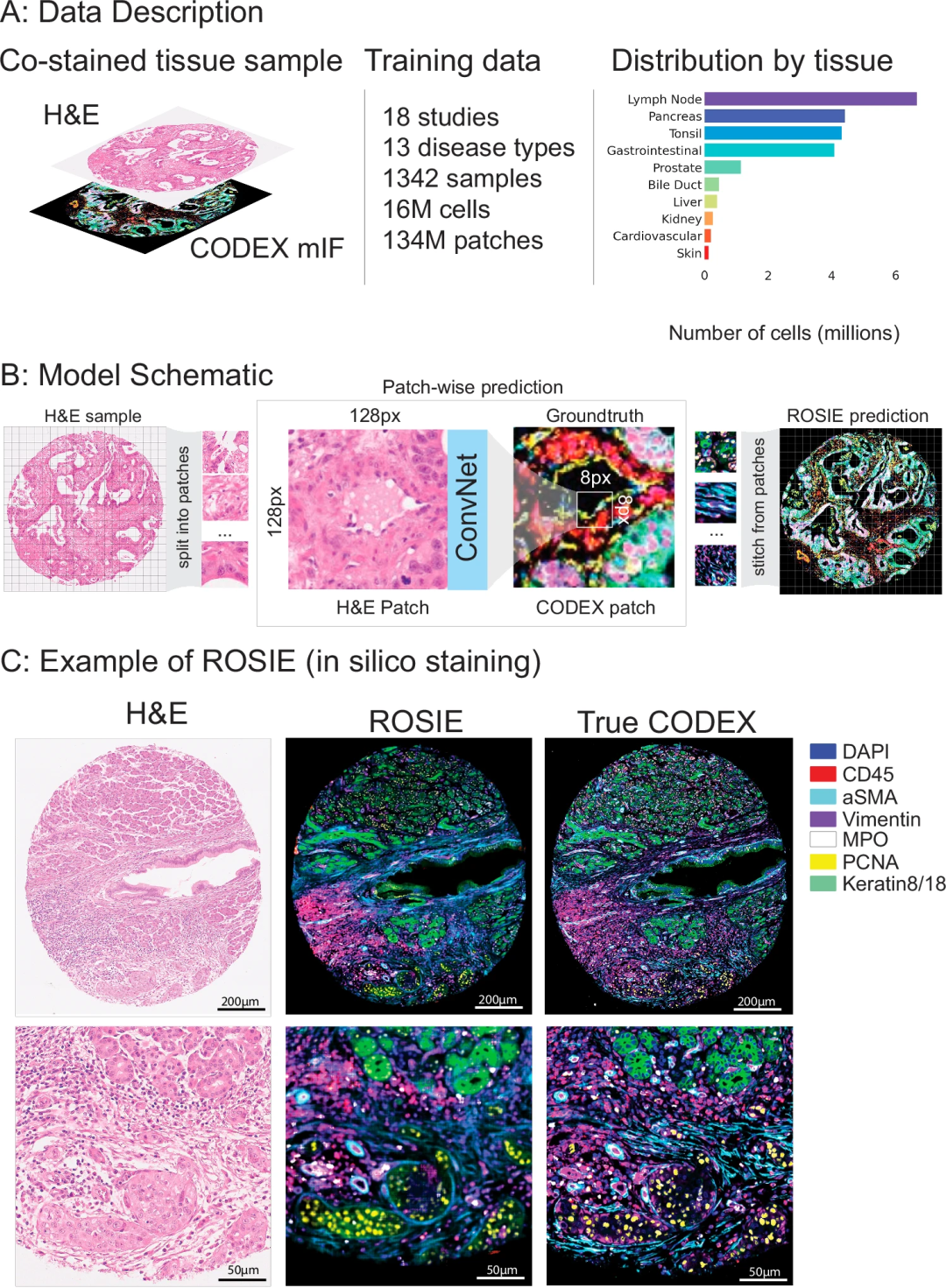
图1.ROSIE概述
ROSIE采用ConvNext27卷积神经网络架构,遵循 “patch级(图像块)预测-全图拼接” 的核心逻辑:首先将H&E图像分割为128×128像素的局部patch,并将其作为输入;然后针对每个patch预测对应CODEX图像“中心8×8像素”区域内生物标志物的平均表达水平;再通过8像素滑动窗口迭代预测并拼接结果,最终拼接为完整的虚拟mIF图像。
训练过程中,模型采用单一均方误差(MSE)损失函数,相较传统生成对抗网络(如pix2pix),其避免了训练不稳定、边界伪影等问题,且训练效率更高。该研究共涵盖148种生物标志物,研究团队筛选了流行度前50的生物标志物作为ROSIE的预测目标,包括DAPI、CD45、CD68、CD14、PD1、FoxP3、CD8、HLA-DR等。
接下来,研究团队在四个独立评估数据集上对ROSIE进行测试。结果显示,该模型预测的50种蛋白质标志物表达水平与真实值相比,皮尔逊相关系数(Pearson R)为0.285、斯皮尔曼相关系数(Spearman R)为0.352、样本水平一致性指数(C-index)为0.706,显著优于仅基于H&E染色强度或细胞形态的基线模型。此外,通过梯度加权类激活映射(Grad-CAM)对ROSIE生成的预测进行可视化发现:对于核蛋白(如DAPI、Ki67、PCNA),模型注意力集中在patch中心区域;对于环境依赖型蛋白(如CD68、PanCK、ECad),注意力则分布在细胞周围区域。
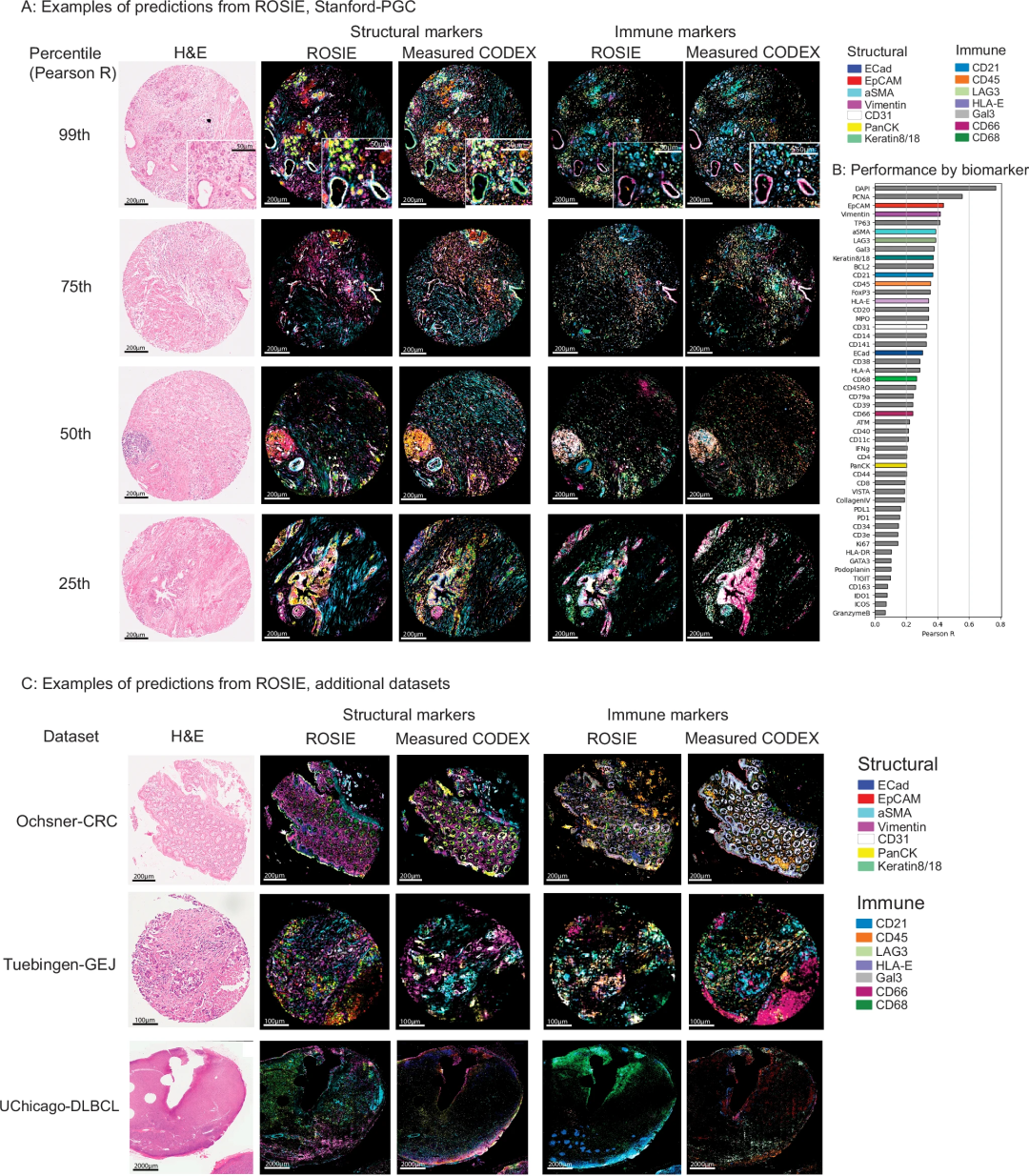
图2 . ROSIE预测的可视化
研究团队验证了ROSIE预测出的蛋白质表达数据在下游生物学和临床任务中的高度实用性。利用ROSIE预测的蛋白质表达信息,研究团队通过最近邻算法精准识别了B细胞、内皮细胞、上皮细胞、成纤维细胞等7种细胞类型,准确性显著高于基于形态学或批量表型的分类方法。进一步分析显示,ROSIE能有效区分H&E难以分辨的B细胞与T细胞。
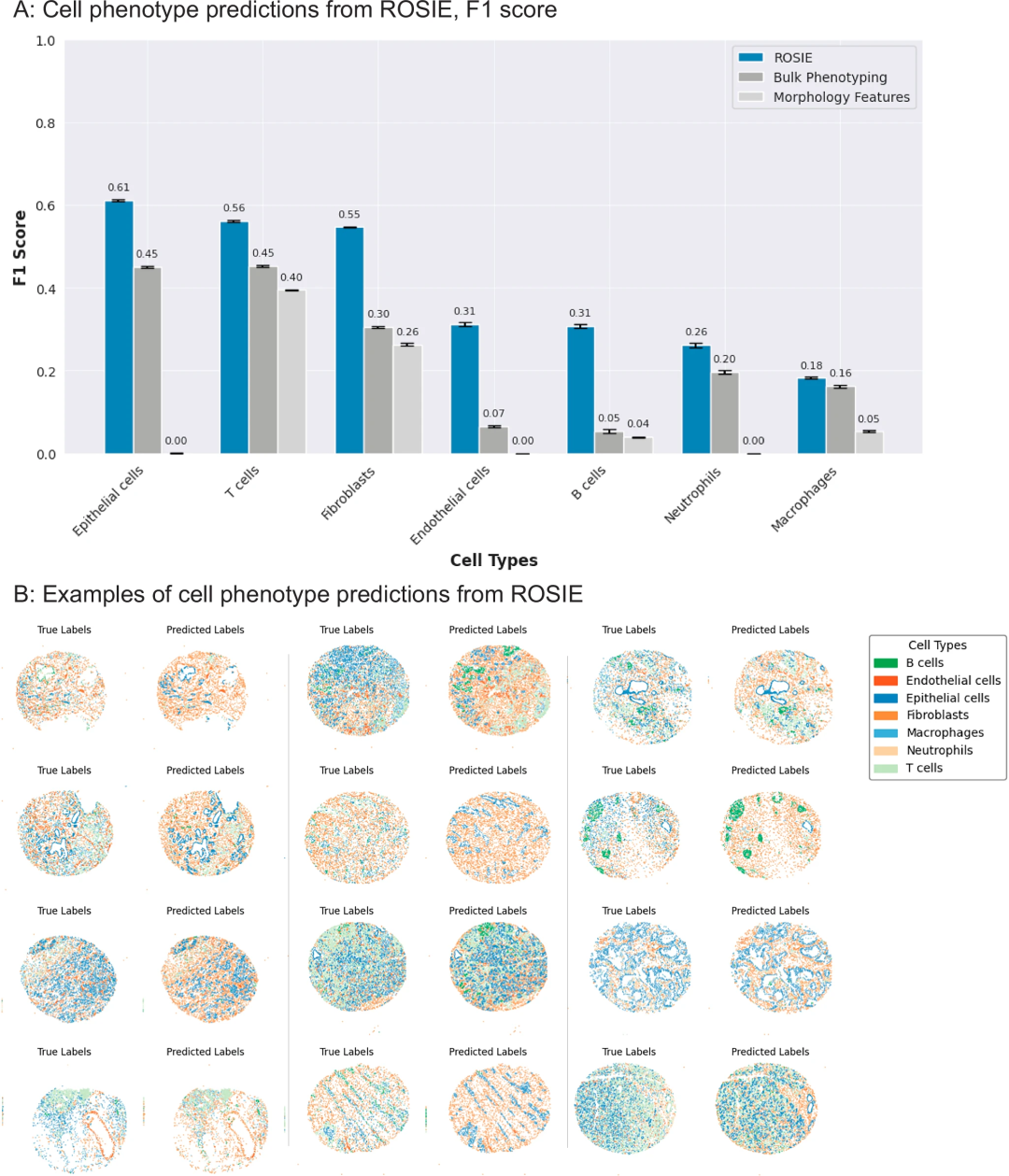
图3. 使用ROSIE进行细胞类型预测
结合组织结构识别算法SCGP对预测出的表达进行无监督聚类,ROSIE能有效识别样本中的复杂组织结构,如基质、肿瘤样上皮、血管样内皮和肿瘤巢等,调整兰德指数(ARI)达 0.475、F1分数达0.624,性能远超传统基线模型。
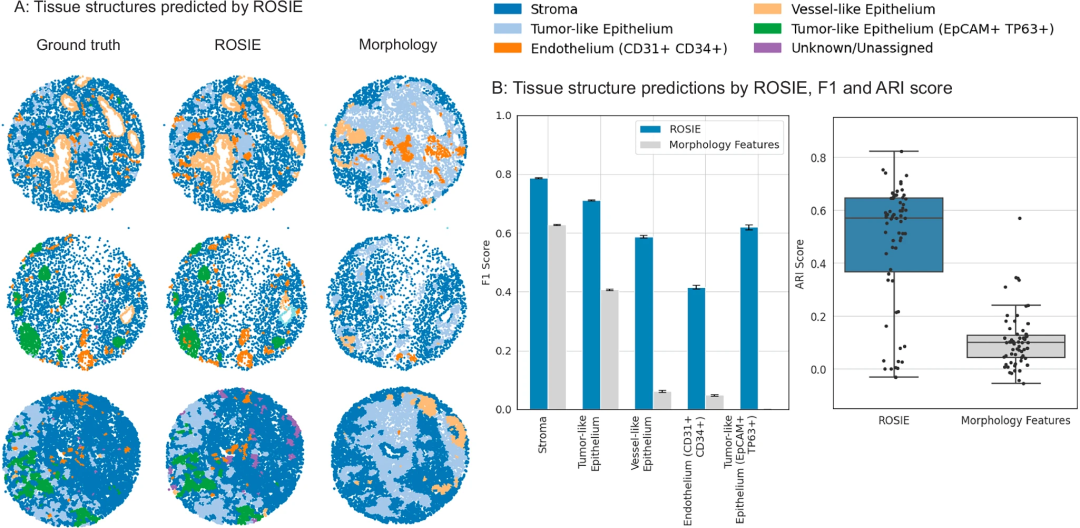
图4. ROSIE预测组织结构
此外,ROSIE还可识别具有临床意义的细胞邻域表型:肿瘤浸润淋巴细胞(TILs)与淋巴细胞相邻上皮细胞(LNEs),其与肿瘤-免疫相互作用密切相关。在Stanford-PGC数据集中,ROSIE预测的TILs数量、LNEs比例与真实值的皮尔逊相关系数分别达0.805和0.598,且能准确反映“免疫冷”(胰腺癌,预测T细胞比例20.0%)与 “免疫热”(结直肠癌,预测T细胞比例 40.1%)肿瘤的免疫特征差异,这与临床认知完全一直,证明了其预测的生物学真实性。
值得注意的是,对未纳入训练的结直肠癌(Ochsner-CRC)、胃食管结合部癌(Tuebingen-GEJ)数据集,ROSIE的平均Pearson R仍达0.241;在Orion mIF平台(不同于训练用的CODEX平台)的CRC数据上,对CD45等核心生物标志物的预测仍保持稳健,显示出强大的泛化能力。
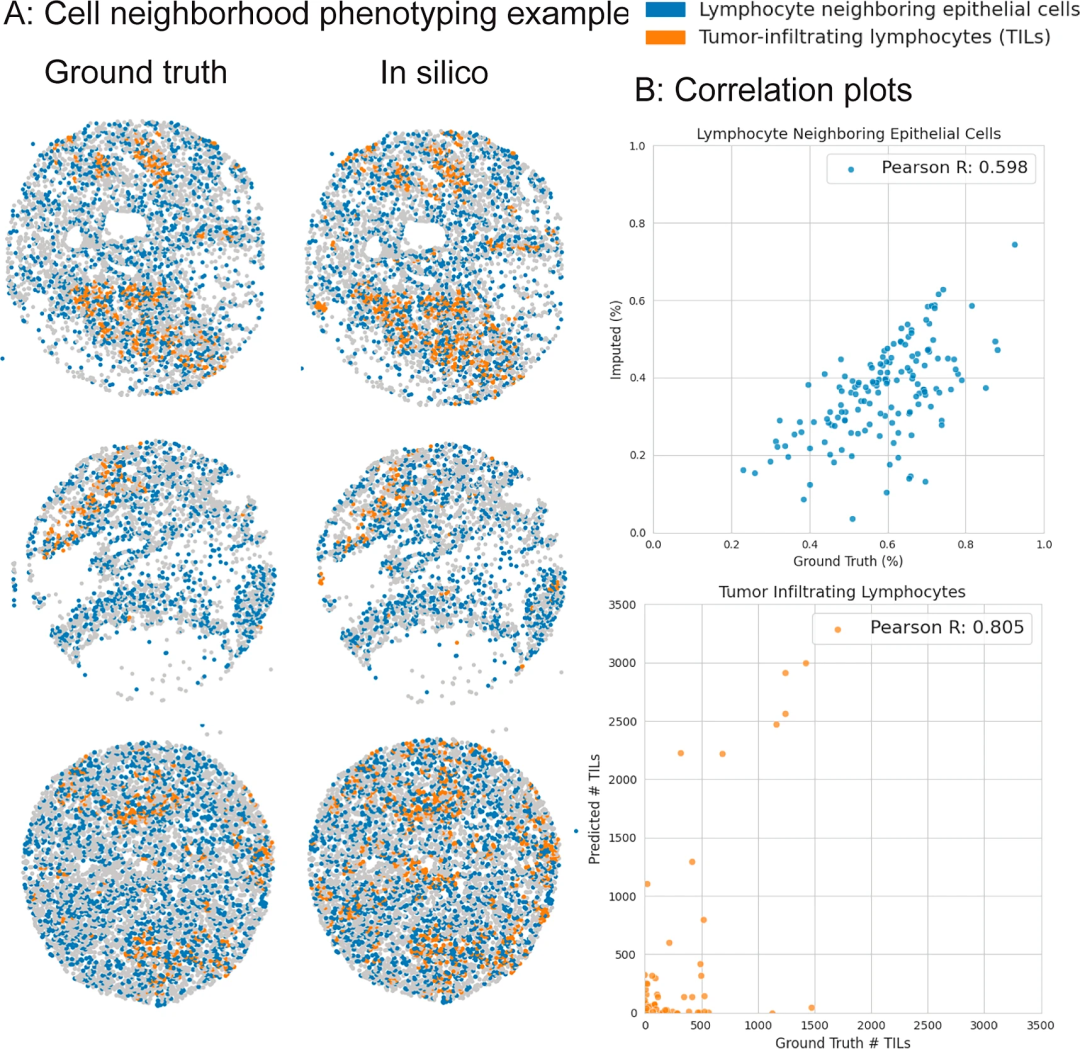
图5. ROSIE的细胞邻域表型分析
综上所述,ROSIE为临床组织病理学提供了一种低成本、高效率的蛋白质表达推断工具,显著扩展了H&E染色的信息维度。该框架不仅有助于挖掘现有大量H&E存档样本的分子潜力,还在肿瘤免疫微环境解析、患者分层及治疗策略制定方面展现出重要价值。
参考文献:
Wu, E., Bieniosek, M., Wu, Z. et al. ROSIE: AI generation of multiplex immunofluorescence staining from histopathology images. Nat Commun 16, 7633 (2025). https://doi.org/10.1038/s41467-025-62346-0


