Acta Pharm Sin B暨南大学附属第一医院徐安定/逯丹教授团队揭示缺血半暗带损伤的新机制
时间:2025-08-25 12:16:36 热度:37.1℃ 作者:网络
缺血性卒中是全球致死和致残的主要原因,在急性期后减少神经元损伤的治疗选择有限。缺血半暗带是梗死核心周围功能受损但尚可挽救的组织区域,是治疗的关键,但目前针对半暗带的有效脑细胞保护策略仍匮乏。环状RNA (circRNA)是一类共价闭合的非编码RNA,在脑组织中广泛表达并参与神经稳态和疾病调控。暨南大学附属第一医院徐安定/逯丹教授团队前期报道了缺氧特异性CircOGDH主要表达在缺血半暗带神经元中,并介导神经元凋亡,其表达水平与缺血半暗带体积显著相关,是缺血半暗带预测和AIS治疗潜在的生物标志物,但其在缺血神经元中高表达的机制尚不明确。
N6-甲基腺苷(m6A) RNA修饰是RNA稳定性、转运和翻译的关键调节因子。在急性缺血性卒中期间,外周免疫细胞和缺氧神经元中的m6A甲基化水平升高,它们可能有助于暂时抑制翻译以保持细胞存活。与YTH结构域蛋白家族介导m6A依赖性RNA降解不同,胰岛素样生长因子2 mRNA结合蛋白(IGF2BPs)通过识别m6A位点以增强RNA稳定性。IGF2BP1有助于稳定应激响应的RNA并形成应激颗粒(SG),在细胞应激和缺血期间隔离关键mRNA。IGF2BP1还通过Ran-GTP和exportin-2依赖性机制参与circRNA的核输出。
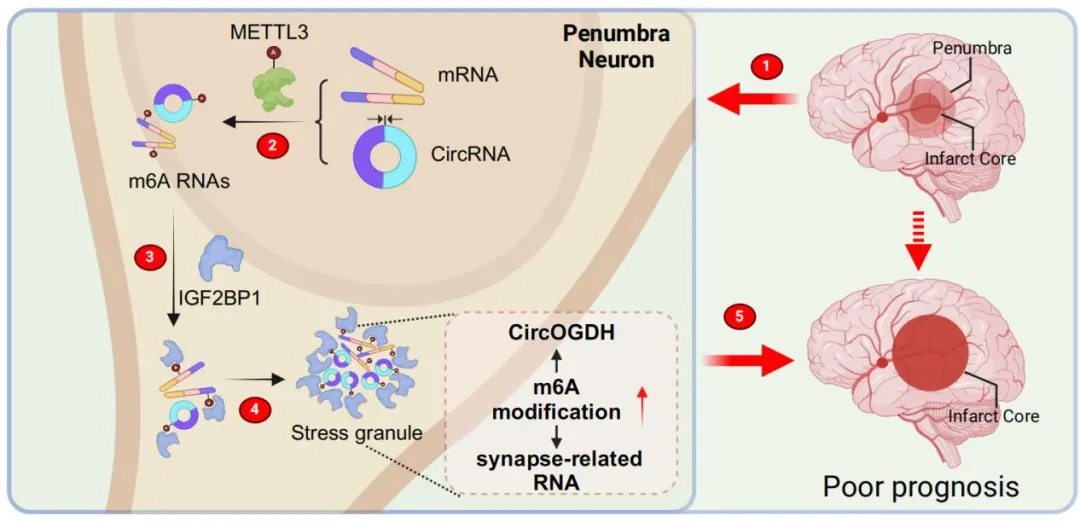
基于此,2025年8月21日,该团队联合中山大学麦鸿成教授团队(合作单位:中山大学孙逸仙纪念医院)在Acta Pharm Sin B杂志上在线发表了题为“IGF2BP1 positively regulates CircOGDH accumulation in hypoxia induced stress granules”的研究论文,动态揭示了缺氧条件下m6A修饰介导IGF2BP1调控CircOGDH的表达机制,解析了IGF2BP1通过在应激颗粒中结合m6A修饰的CircOGDH,正向调节CircOGDH表达,从而导致半暗带神经元损伤机制。敲低IGF2BP1可降低CircOGDH表达,减少神经元凋亡,同时可显著改善突触完整性,双向保护神经元,改善梗死体积,提示其作为治疗靶点的优越性。

1. 缺血半暗带神经元中m6A修饰的动态变化
首先,该研究发现在小鼠急性卒中模型和神经细胞缺氧模型中,m6A修饰水平明显增加。RT-qPCR分析显示,甲基转移酶基因METTL3、METTL14、METTL16和WTAP以及去甲基化酶基因FTO和ALKBH5在缺氧条件下表达上调,说明高m6A修饰与半暗带病理有关。CircOGDH是改善半暗带神经元存活的潜在治疗靶点。同样,缺氧也上调了SH-SY5Y神经元细胞中CircOGDH的表达。使用SRAMP软件预测CircOGDH有高置信度或中等置信度的2个m6A修饰预测位点。通过MeRIP证实,CircOGDH在缺氧时存在明显的m6A修饰,提示半暗带神经元的病理过程与CircOGDH的m6A甲基化增加有关。
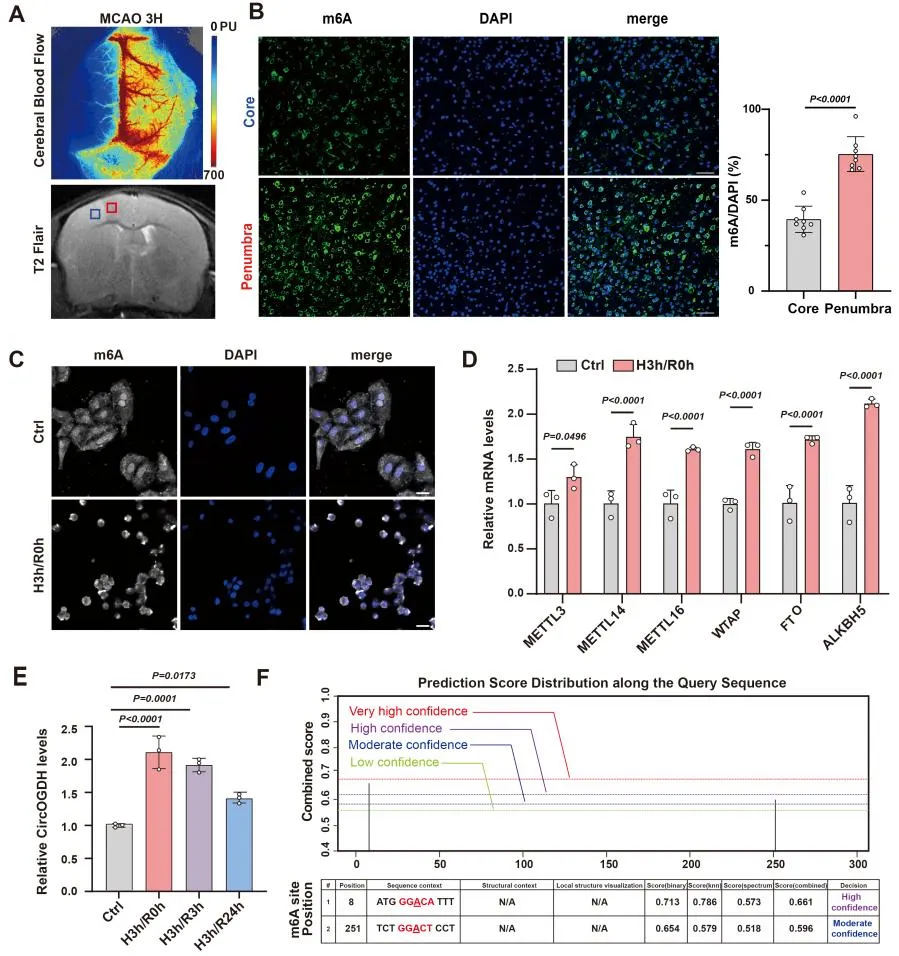
2. CircOGDH可以在神经元细胞中与m6A读取器IGF2BP1相互作用
为了确定参与CircOGDH m6A修饰的参与者,作者进行了RNA下拉试验和蛋白质组学分析,并结合数据库联合分析,发现了可以与CircOGDH结合并且高表达的m6A读取器IGF2BP1。通过荧光原位杂交实验(FISH)联合免疫荧光染色发现,CircOGDH与IGF2BP1在缺氧神经元细胞质中共定位。进一步通过Pearson相关分析显示,缺氧和再灌注不同时间间隔下CircOGDH和IGF2BP1的相对表达量呈正相关(R=0.676, P=0.016),均在缺氧急性期3小时表达水平最高。在小鼠急性卒中模型中,IGF2BP1表达主要定位在缺血半暗带神经元中。这些数据表明,CircOGDH在缺氧神经元和半暗带神经元中与IGF2BP1结合。
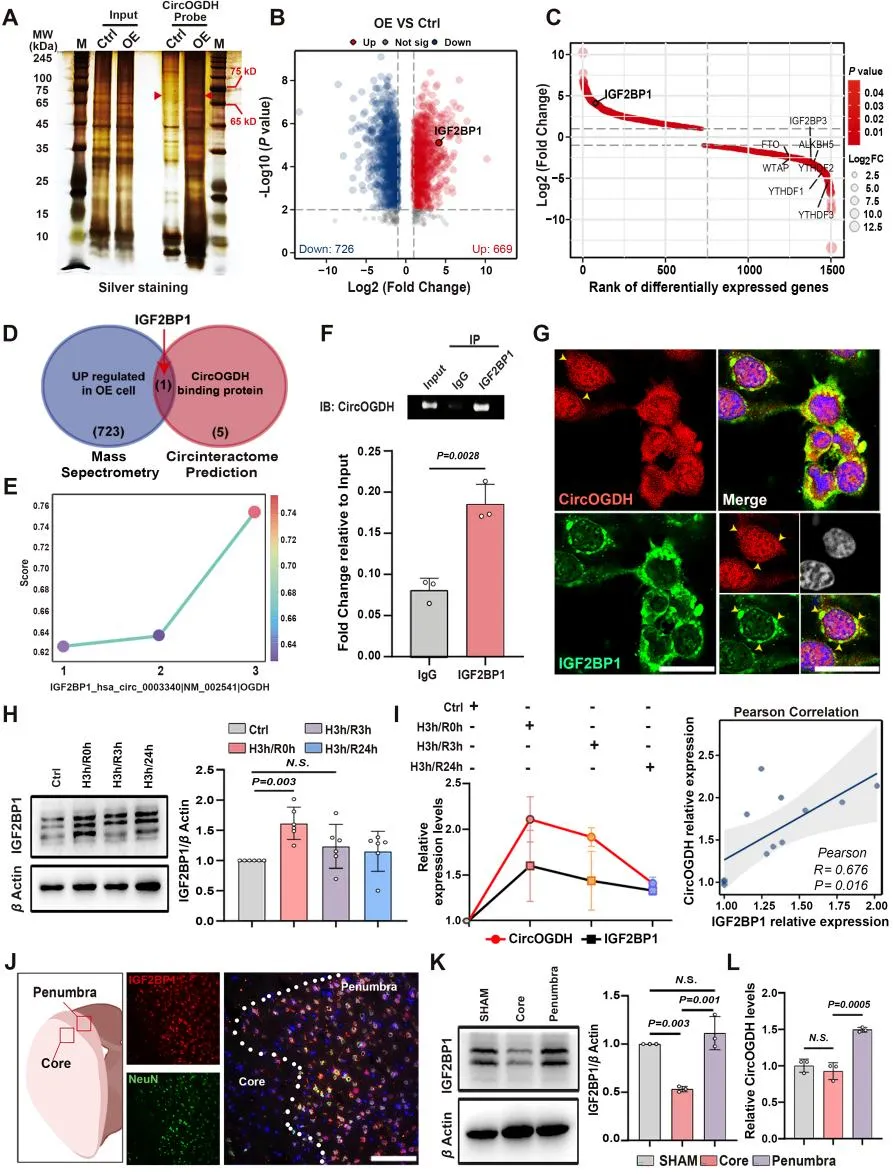
3. IGF2BP1以m6A依赖的方式与CircOGDH结合,并在缺氧条件下稳定CircOGDH的表达
为了确定IGF2BP1特异性识别并结合缺血半暗带标志物CircOGDH的分子策略,作者首先敲低m6A甲基转移酶METTL3(参与催化靶mRNA m6A修饰),发现METTL3敲低显著降低了m6A对CircOGDH的修饰,然后结合RIP实验进一步确定敲低METTL3显著减少IGF2BP1与CircOGDH的结合。然后作者通过RNAfold、3dRNA以及ZDOCK等工具预测和构建包含有不同功能区域的IGF2BP1截断肽段,验证得出KH3-4结构域是IGF2BP1特异性识别CircOGDH接头序列的关键结构域。接着通过突变CircOGDH的2个m6A修饰位点,进行荧光素酶报告基因实验确定,与IGF2BP1结合的m6A修饰位点是位于接头位点的8号修饰位点。这些结果显示,m6A修饰的CircOGDH可以直接结合IGF2BP1的KH3-KH4结构域。m6A在circRNAs的代谢和功能中起着不可或缺的作用。相反,circRNA的异常表达会影响m6A修饰。作者首先过表达和敲低CircOGDH发现,CircOGDH的表达改变并不影响缺氧神经细胞中IGF2BP1的表达,以及其在细胞质的空间定位。而敲低IGF2BP1后,CircOGDH的表达明显降低,利用RNA稳定性实验进一步确认,敲低IGF2BP1后,缺氧时神经细胞中CircOGDH的半衰期明显缩短。这些数据表明,m6A修饰有助于IGF2BP1在缺氧条件下稳定CircOGDH。
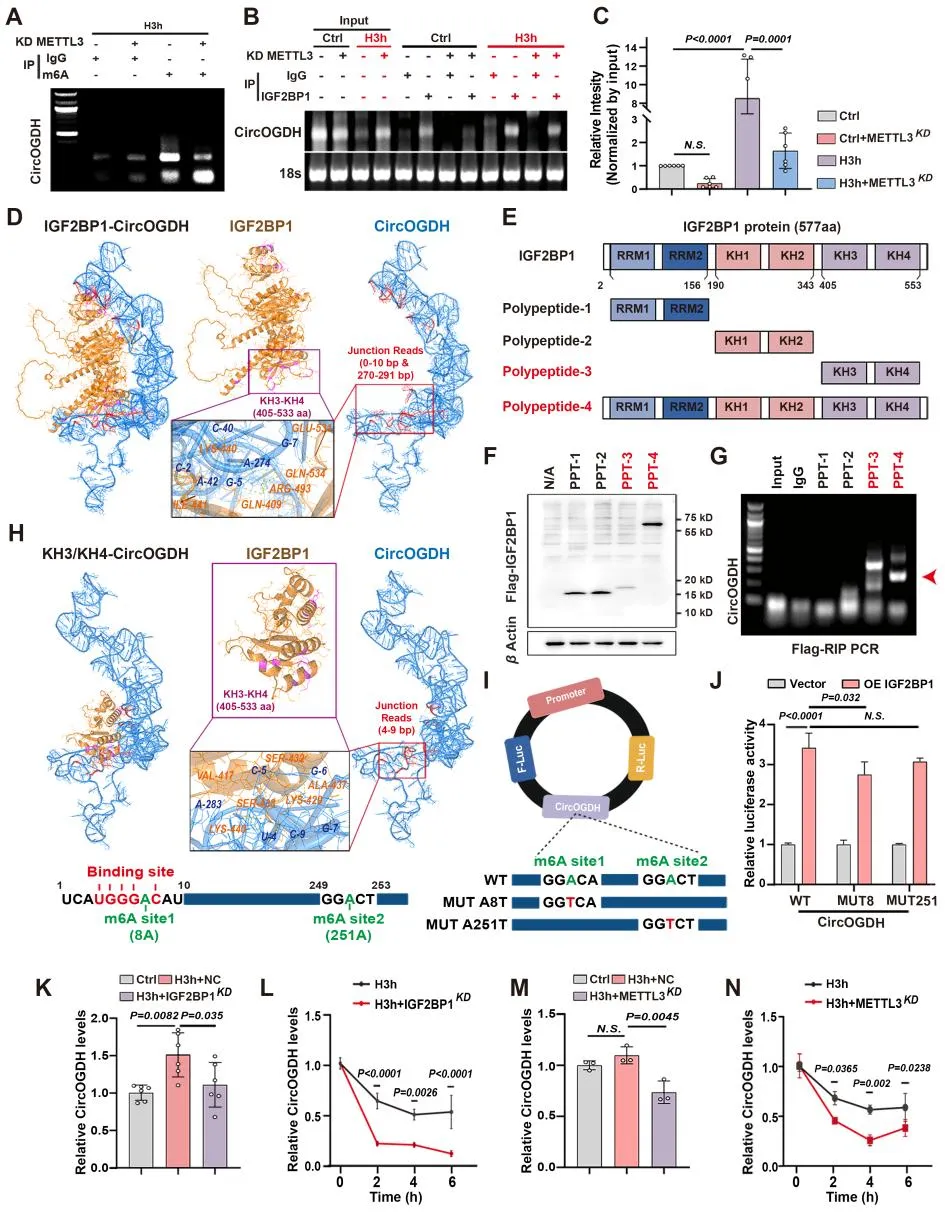
4. IGF2BP1通过向应激颗粒(SGs)募集CircOGDH,在缺氧神经元细胞中维持高水平的CircOGDH
在AIS早期,SGs可瞬时抑制mRNA翻译,保护mRNAs和蛋白免受损伤。IGF2BP1与成熟SGs中致密颗粒的外围和内部形成相关。作者在缺氧神经细胞和人脑组织样本中发现,IGF2BP1、CircOGDH与SGs的核心组分G3BP1存在明显空间共定位,CO-IP实验证明IGF2BP1可以与G3BP1结合。抑制SG的形成可以明显减少CircOGDH的丰度,并且在缺氧神经细胞中敲低IGF2BP1的表达,明显减少了SG组分中CircOGDH的丰度,并减少IGF2BP1、CircOGDH与G3BP1空间共定位。这些发现表明,在缺氧条件下神经元细胞中上调的IGF2BP1在细胞质中积累,通过识别其m6A修饰位点与CircOGDH结合。这种结合稳定了CircOGDH,延长了其半衰期,并通过进入SGs减少了其降解。
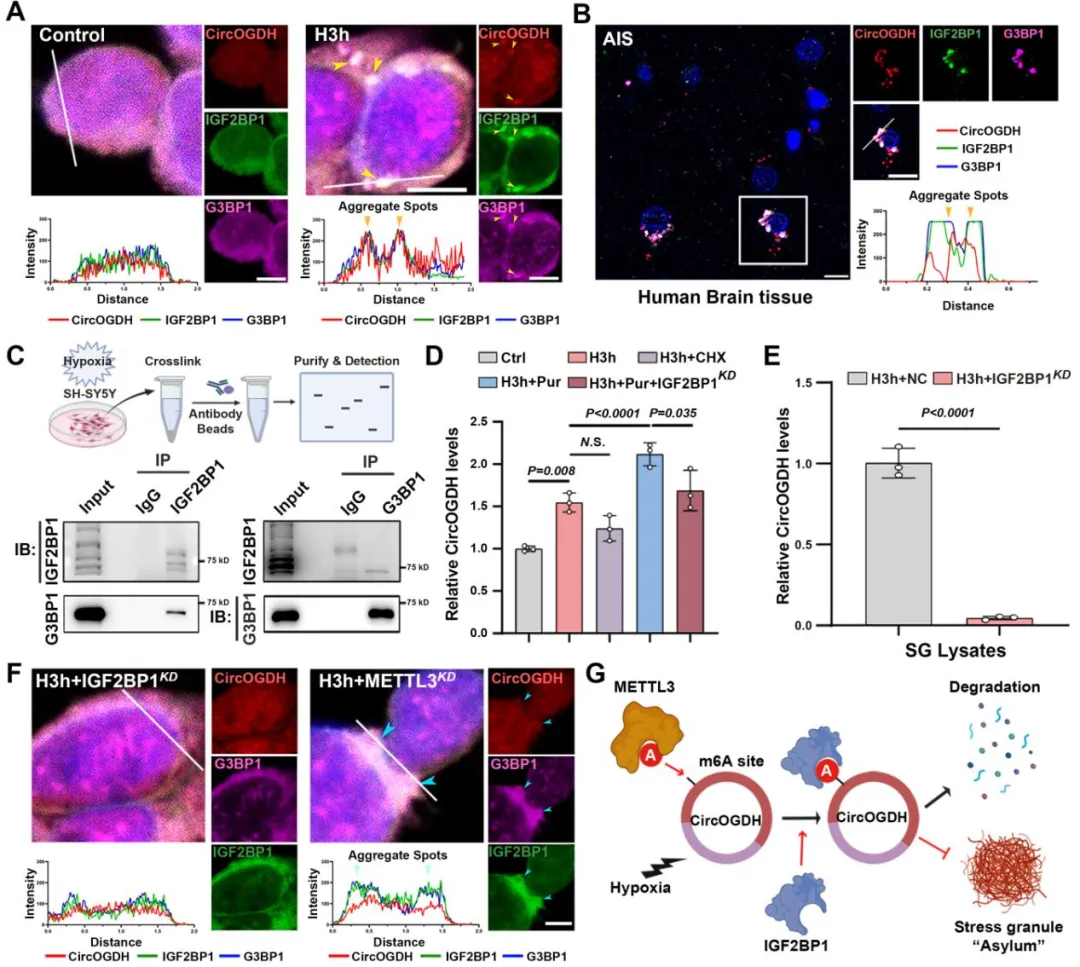
5. Igf2bp1敲低可改善神经元凋亡
该团队之前的研究结果表明,靶向敲低CircOGDH可减少缺血半暗带区的神经元凋亡(Circulation Research)。接下来作者在缺血半暗带区域感染敲低Igf2bp1的病毒,发现其可减少缺血半暗带区CircOGDH的表达,改善神经元凋亡,减少梗死体积。为了进一步探讨Igf2bp1敲低对神经元的保护作用是通过m6A修饰的CircOGDH的减少来介导的,作者重点研究了CircOGDH (非特异性m6A修饰的CircOGDH)和Igf2bp1 (特异性m6A修饰的CircOGDH)的敲低,以验证它们在缺血条件下对半暗区神经元的作用。与单纯抑制CircOGDH相比,Igf2bp1敲低能更有效保护神经元,改善梗死体积。这些结果表明,IGF2BP1修饰的m6A-CircOGDH在神经细胞凋亡中起主要作用,其功能比简单的CircOGDH敲低更大。
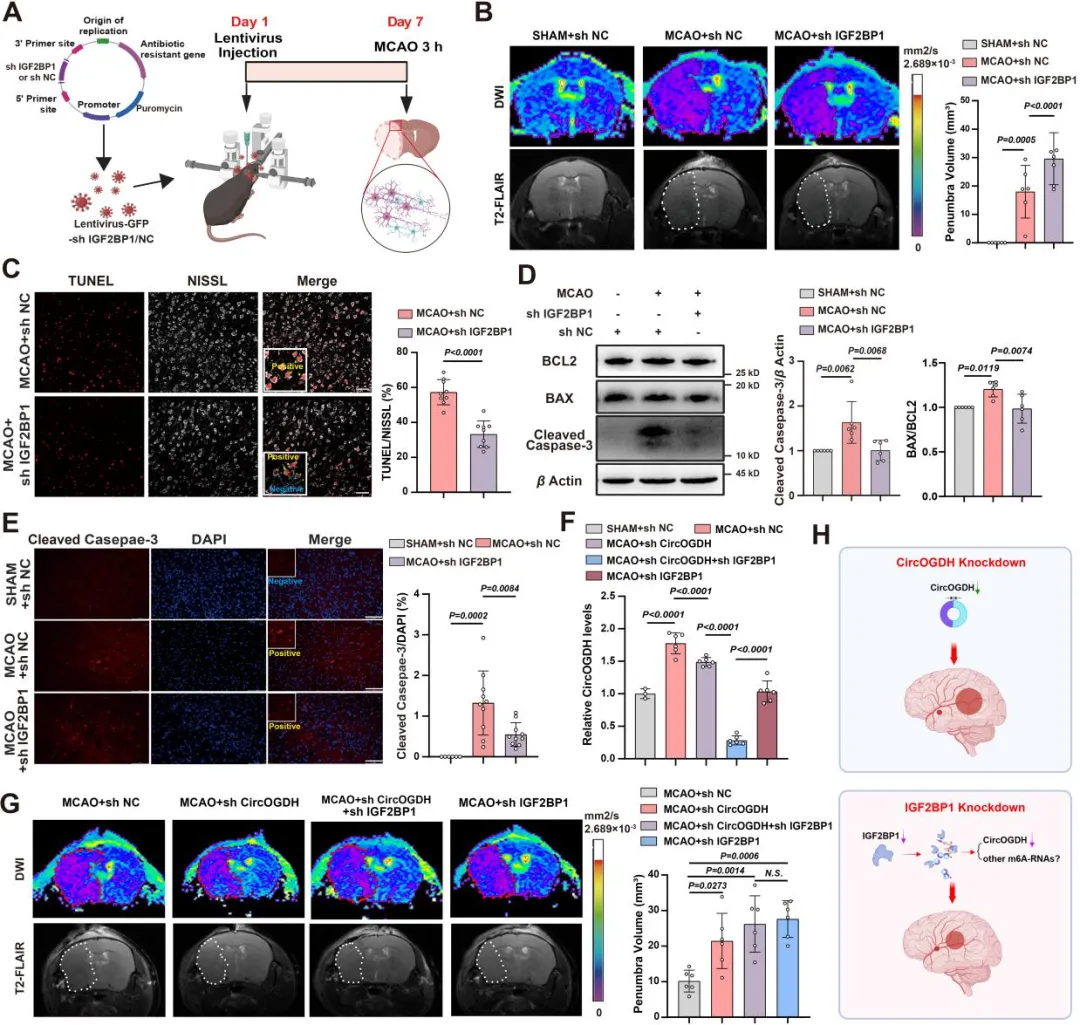
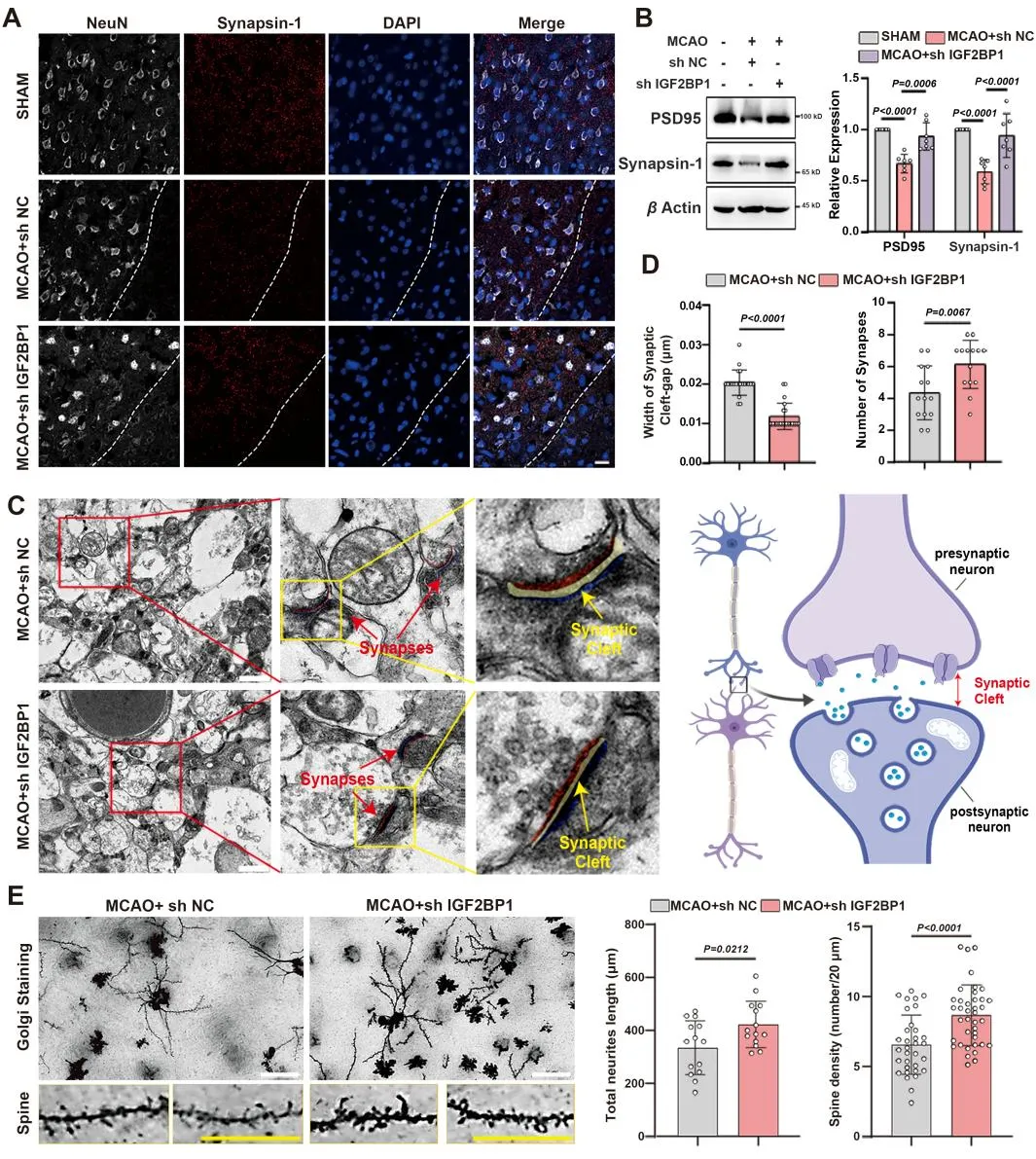
6. Igf2bp1敲低可减少MCAO小鼠的突触损伤
IGF2BP1在缺血性卒中(IS)患者的临床样本中升高,但其潜在的功能意义尚不清楚。IGF2BP1是AIS的关键治疗靶点,它促进半暗区神经元损伤和CircOGDH表达,可能是神经元中多种破坏性下游信号通路的中心枢纽。在脑损伤急性期维持突触功能可促进神经元恢复。因此,作者进一步检测了MCAO小鼠的突触水平,通过电镜和高尔基染色实验发现,敲低Igf2bp1后,突触蛋白PSD95、SYN的表达增加,突触完整性更好,树突棘的长度和密度更大。进一步通过m6A-RNA测序分析显示,高甲基化基因在轴突发育和轴突发生富集,并主要定位树突和轴突。因此,作者推测IGF2BP1也可能调节一类在缺氧时影响轴突发育的高甲基化mRNA。这些结果表明,IGF2BP1敲低在缺血条件下具有神经保护作用。
综上,这项研究首次将m6A修饰、CircRNA动态改变与应激颗粒功能关联,解析半暗带神经元存活的分子机制,为开发新型脑细胞保护策略提供了理论依据,为缺血性卒中提供了新的调控治疗靶点,未来或可通过靶向IGF2BP1,延缓半暗带向梗死灶转化,改善卒中预后。
原文链接:
https://www.sciencedirect.com/science/article/pii/S2211383525005623


