【病例报告】颈内动脉床突上段开窗畸形合并动脉瘤行支架辅助弹簧圈栓塞治疗一例并文献复习
时间:2025-09-07 12:09:38 热度:37.1℃ 作者:网络
摘要:颈内动脉(ICA)床突上段开窗畸形是一种较少罕见的血管发育变异现象,并且该变异可能与动脉瘤的形成有关。ICA床突上段的开窗畸形属于ICA胚胎起源还是后交通动脉胚胎起源尚存争议。该文回顾性分析了1例ICA床突上段开窗畸形合并动脉瘤患者的影像学资料及诊治过程,并结合文献对ICA床突上段开窗畸形的成因及其与动脉瘤形成的相关性进行了分析,以期提高临床医师对该血管变异现象的理解,并作出合理的诊疗。
颅内动脉开窗畸形最常见于前交通动脉(ACoA),在尸检中约占60%,其次为椎-基底动脉(vertebrobasil arartery,VBA),占比为1%~5%;大脑前动脉(ACA)和大脑中动脉(MCA)开窗畸形则更罕见,分别为0.10%~7.20%、0.28%~1.00%[1-2]。部分开窗畸形同时合并有动脉瘤[3-4]。关于颈内动脉(ICA)床突上段与后交通动脉(PCoA)的开窗畸形仅有少数文献报道[3],如何界定上述部位的开窗畸形尚无定论,其胚胎学成因亦不明确[1,3]。笔者报道1例ICA床突上段开窗畸形合并动脉瘤患者,并结合文献分析其胚胎发育原理及该血管变异现象与动脉瘤形成的可能关系,以期提高临床医师对颅内血管胚胎发育原理的理解以及对该类型血管变异的认识。
患者
女,74岁,因“发现左侧ICA PCoA动脉瘤1个月”于2025年3月11日入住西北大学附属医院(西安市第三医院)神经外科。患者入院前约1个月(2025年2月14日)因“头晕”于西北大学附属医院(西安市第三医院)神经内科就诊,2025年2月17日MR血管成像(MRA)示左侧ICA床突上段开窗畸形,开窗近端合并动脉瘤(图1a),患者头晕症状经药物对症治疗后改善并出院。为进一步治疗颅内动脉瘤,2025年3月11日于门诊以“颅内动脉瘤”收入西北大学附属医院(西安市第三医院)神经外科,拟行支架辅助颅内动脉瘤栓塞术。既往高血压病史30余年,近1年规律口服硝苯地平控释片,血压控制平稳。否认糖尿病、冠心病等其他病史。入院后体格检查:体温36.4℃,脉搏57次/min,呼吸19次/min,血压141/79mmHg。神经系统体格检查:意识清楚,精神良好,双侧瞳孔等大等圆,直径3.0mm,双侧对光反射灵敏;双侧额纹及鼻唇沟对称,无口角歪斜,伸舌居中;颈软,无抵抗感;四肢肌张力正常,肌力Ⅴ级,双侧Babinski征阴性。双肺呼吸音清,未闻及干、湿啰音。心脏听诊未闻及病理学杂音。腹部平软,无压痛及反跳痛。2025年3月12日完善血常规、生化、凝血功能、心电图、胸部X线、心脏超声等术前检查,无手术禁忌。于2025年3月12日起口服拜阿司匹林肠溶片100mg/次,1次/d,替格瑞洛片60mg/次,2次/d,2025年3月16日血栓弹力图检查示腺苷二磷酸通道抑制率27.1%,腺苷二磷酸最大振幅61.5mm,花生四烯酸通道抑制率93.6%,花生四烯酸最大振幅28.3mm。拟于2025年3月17日在全身麻醉下行脑血管造影检查及支架辅助弹簧圈栓塞治疗。
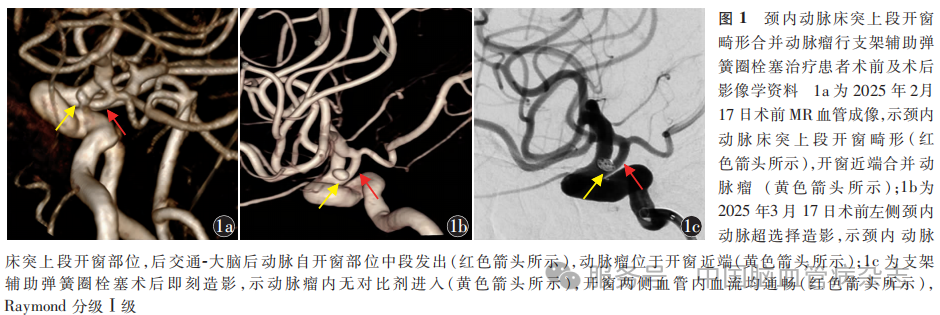
手术过程:麻醉方式采用经口气管插管,静脉+吸入复合麻醉。使用Seldinger技术置入6F股动脉鞘管(Terumo,日本),经静脉注射肝素5000U(体质量为60kg),拟1h后静脉追加肝素2500U。使用5F单弯造影导管(Cordis,美国)行双侧颈总动脉、左侧椎动脉造影,其中左侧ICA超选择三维造影示左侧ICA床突上段开窗畸形,开窗近端可见动脉瘤样结构(图1b),尺寸为2.3mm×3.0mm,开窗远端血管直径约3.5mm,近端血管直径约3.7mm。由于通路建立困难,治疗时更换8F股动脉鞘管(Terumo,日本),使用8F导引导管(Cordis,美国)置入左侧ICA颈段近端,8F导引导管内衬6F(115cm)中间导管(Medtronic,美国),将中间导管置入海绵窦段。将XT17微导管(Stryker,美国)经Synchro 2微导丝(Stryker,美国)导引置入左侧M1段,推送塑形的headway duo微导管(MicroVention,美国)自行进入动脉瘤腔;将尺寸为3.5mm×18.0mm的Atlas支架(Stryker,美国)于ICA床突上段释放并覆盖动脉瘤颈,填充弹簧圈(Medtronic,美国)选择2mm×6mm(1枚)成篮,继续依次填充弹簧圈1.5mm × 3.0mm(1枚)、1.5mm × 2.0mm(1枚)、1.5mm × 2.0mm(1枚)。术后即刻造影显示动脉瘤已无对比剂进入,开窗两侧血管内血流均通畅,Raymond分级Ⅰ级(图1c),撤去介入套件,拔除股动脉鞘管,局部压迫30min后予以穿刺部位局部加压包扎,结束手术,待麻醉复苏后返回病房。术后即刻患者意识清楚,四肢活动正常。
患者于2025年3月27日出院,出院时意识清楚,四肢活动正常,改良Rankin量表评分0分。 出院后规律口服拜阿司匹林肠溶片100mg/次, 1次/d, 替格瑞洛片60mg/次,2次/d。出院后2个月电话随访,患者无未诉不适。
讨论
颅内动脉开窗畸形为先天性解剖变异,即颅内动脉发生了局限性重复———颅内动脉在走行过程中出现了两条并行的分支,继续走行一段距离后再次汇合成为一条动脉,该现象可能由胚胎时期的血管网融合不良或者动脉血管分裂导致[3,5-7]。颅内动脉开窗畸形常见于ACoA,其次为基底动脉和椎动脉[2,8-9]。
本研究以“fenestration”“supracl inoidinternal carotid artery”为英文关键词检索PubMed、WebofScience数据库, 检索日期为1990年1月1日至2025年5月1日,共检索到24篇[1-6,8,10-26]文献报道的26例ICA床突上段开窗畸形患者,其中单纯开窗畸形患者3例[4,20-21],合并与开窗畸形有关的动脉瘤患者22例[1-3,5-6,8,10-19,22-26],合并脑血管畸形患者1例[25]。
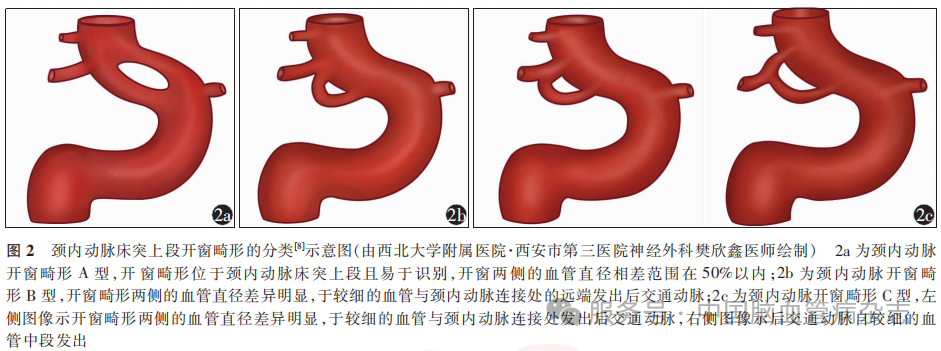
位于ICA床突上段的开窗畸形发生率低,并且开窗畸形合并的动脉瘤形成与该变异可能相关,好发于开窗畸形的近端[1,10]。Haryu等[10]回顾性纳入了25例ICA床突上段开窗畸形的患者,其中9例因影像学资料成像质量低或存在缺陷被排除,将余16例ICA开窗畸形分为以下3种(图2)。A型:ICA开窗畸形,开窗两侧血管直径相当或者相差<50%;B型:ICA开窗部位发育不良,PCoA发出点与ICA开窗部位边界处融合;C型:ICA开窗部位发育不良,PCoA发出点位于ICA开窗血管表面。上述16例ICA开窗畸形患者的影像学资料的主要特点:(1)开窗位于ICA床突上段(16例);(2)开窗近端多存在动脉瘤,占比为13/16;(3)16例ICA开窗畸形患者动脉瘤的发生比例从高至低依次为A型(2/2)、B型(6/6)、C型(5/8),发生破裂的比例从高至低依次为A型(1/2)、B型(1/6)、C型(0/5)。
目前关于ICA床突上段开窗畸形的文献报道较少[6,21]。研究显示,ICA开窗畸形均位于眼动脉的远端,但是如何根据胚胎发育原理定义开窗畸形位于ICA还是PCoA,目前尚存争议[3]。Trandafilovic'等[27]对200个人类胎儿以及377具不同性别、不同年龄段(从新生儿至95岁)人类尸体的脑血管进行解剖,结果显示,0.35%(2/577)的标本存在ICA与PCoA结合部开窗畸形,3.12%(18/577)的标本存在PCoA重复。Uchino等[24,28]筛查健康人群颅内动脉瘤患病率时发现1例ICA床突上段开窗畸形(MRA检查)患者,该团队参照MCA双干变异的成因分析,将ICA床突上段开窗现象解释为PCoA的“双干起源”,即ICA同时发出了两支独立的PCoA,二者在远端发生了融合;与PCoA开窗畸形不同,后者为单一PCoA在远端形成分叉,分叉之后再次融合[29]。
胚胎发育至第21d左右开始出现原始心血管系统,主要的动脉血管包括由原始心管发出的腹侧主动脉、位于腹侧主动脉后方的背侧主动脉,连接二者的血管为鳃弓动脉;鳃弓动脉一共有6对,第3对鳃弓动脉未来发育为部分颈总动脉与ICA,即ICA由胚胎阶段的第3对鳃弓动脉及部分腹侧主动脉演化而成[30]。
由于胚胎早期脑干、小脑的发育尚不成熟,后循环动脉系统尚未建立,因此,早期的后循环动脉形态为网状,称为纵向神经动脉[30]。伴随着胚胎的生长发育,这些网状动脉血管发生融合,形成VBA系统。在后循环动脉形态仍为血管网时,其血流来源于ICA,即原始前-后循环的吻合动脉;第1支出现的原始前-后循环吻合动脉为原始三叉动脉;胚胎在发育至Pedget第1期时,ICA的远端分化为头侧支与尾侧支,其中尾侧支向后方继续延伸并与后循环动脉系统吻合,形成PCoA;在此阶段,大脑后动脉P1段与PCoA是连续、移行的,随着胚胎期枕叶的生长,枕叶脑组织对血供的需求量增加,PCoA的中脑支通过“出芽”的方式生成侧支血管,该侧支血管最终形成大脑后动脉P2段以及远端的大脑后动脉[30]。
胚胎时期的原始动脉发生退化或者相互融合形成独立的血管,而PCoA在胚胎时期形成的血管网未完全融合时则可能形成开窗畸形[31],当开窗畸形发生在ICA与PCoA结合部时,则对应Haryu等[10]研究中的C型。前循环与后循环发生开窗畸形的原因可能不同:前循环开窗畸形是由于某些动脉在生成过程中由两条动脉融合而成,未完全融合的部位形成了开窗;而后循环胚胎发育早期为网状结构,这些网状血管逐渐融合,融合失败或未发生融合部位则形成了开窗[7,10,32-33]。
Black和Ansbacher等[7]对1例不明原因死亡的24岁男性进行尸检发现基底动脉开窗畸形合并开窗近端动脉瘤,伴有广泛蛛网膜下腔出血,并且病理标本显示开窗部位的血管内膜中层及肌层较邻近正常血管薄弱,且存在部分肌层缺失[1,32]。Dong等[34]对VBA开窗畸形患者(12例)与正常VBA人群(12名)的三维旋转造影进行血流动力学模拟分析,结果显示,与正常组对比,开窗畸形组VBA血流汇合处最大振荡剪切指数[0.30(0.22,0.34)比0.09(0.03,0.24),P=0.028]、时间平均壁面剪应力[time averaged wall shear stress, TAWSS; 983.42(761.74, 1851.10)dynes/cm3比565.39(474.87, 823.10)dynes/cm3, P=0.038]均更高,开窗畸形组VBA分叉处的比表面积-平均壁面剪应力[surface area ratio-TAWSS, SAR-TAWSS: TAWSS≥ 500dynes/cm3的表面积/分叉处表面积×100%;70.22(54.16, 76.56)比27.65(15.79, 44.53), P=0.002]更高,可能导致该部位的血管壁易发生损伤而形成血栓、斑块或者动脉瘤,开窗畸形近端动脉瘤的形成原因可能与上述血管结构及血流动力学特点相关[4]。本例患者动脉瘤即位于开窗畸形的近端。
本例患者存在两条直径近似的动脉血管从ICA床突上段背侧发出,平滑地融合成PCoA主干,这种变异可能是胚胎早期的双干PCoA融合所致,但是目前仍缺少明确的胚胎发育证据支持。由于本例患者为宽颈动脉瘤,为保障ICA血流通畅,选择支架辅助弹簧圈栓塞治疗,术后即刻造影显示除ICA主干之外,开窗畸形的远端与近端以及汇入大脑后动脉的血管均无对比剂瘀滞。
对于ICA床突上段开窗畸形合并动脉瘤的患者,在行外科手术夹闭治疗时,需要注意血流的阻断方式以及钳夹方式,原则上需保留至少1支PCoA主干及其穿支动脉,尤其是对于起源于PCoA主干的丘脑前穿支动脉。术前三维DSA可用于精确显示变异血管的解剖结构,从而有利于确定手术策略;此外,术中应用多普勒超声、术中荧光造影、复合手术等方式确认PCoA及其穿支动脉的通畅性是必要的[3]。在介入栓塞治疗方面,应注意以下关键点:(1)基于开窗血管的构型,包括血管的夹角、开窗两侧血管的直径比、瘤颈的位置,选择支架的覆盖策略;(2)由于开窗畸形的存在,在进行栓塞治疗时,近端的PCoA若发生闭塞,血流可以经远端的PCoA继续供血大脑后动脉,因此致密栓塞可能是安全的;(3)支架的类型及规格,开环支架贴壁性良好,适用于迂曲血管,在支架尺寸匹配方面,需匹配分支较粗的血管路径,并覆盖瘤颈两侧的正常血管。
综上所述,ICA床突上段开窗畸形合并动脉瘤临床极为罕见,且动脉瘤的形成可能与开窗畸形有关,开窗畸形的分型与动脉瘤的破裂风险可能存在相关性[10]。而关于ICA床突上段开窗畸形的胚胎变异原理目前尚未明确,需要进一步积累临床数据后进行探索。


