皮肤老化的最新研究进展
时间:2025-06-07 12:12:36 热度:37.1℃ 作者:网络
机体衰老伴随着机体各脏腑组织器官功能的下降,是生物随着年龄增长而自发的必然过程,而皮肤老化的程度直接反映了机体的衰老水平。皮肤外在老化是由环境因素引起的,作为人体暴露在外部环境最大的器官,使得皮肤最易受到空气污染、吸烟和阳光照射等外部环境因素的影响。皮肤内在老化是生物必然的生理过程,主要由时间、基因等因素决定的。
目前,皮肤老化机制研究主要集中在皮肤细胞衰老,研究人员发现随着年龄的增长,衰老细胞在皮肤中积累,这些衰老细胞会诱导其附近正常细胞发生与年龄相关的功能障碍。尽管当前针对皮肤老化的研究已取得初步成果,但是实验仍局限在小鼠体外模型和体内模型中。目前细胞衰老对皮肤老化的影响以及相关治疗策略研究正处于蓬勃发展阶段,本文旨在总结皮肤老化过程中细胞的生物活动及在微环境中的互作机制,为治疗皮肤老化提供治疗策略。
皮肤的组织结构
皮肤主要由表皮层、真皮层和皮下脂肪层组成。表皮是皮肤的最外层,包含角质层、透明层、颗粒层、棘层和基底层,主要由角质形成细胞、黑色素细胞和朗格汉斯细胞构成。基底层的角质形成细胞自我更新,向表皮最外层移动形成角质层。此外,表皮基底层还含有黑色素细胞,能够产生黑色素并转移至角质细胞中,以防御紫外线。成纤维细胞(dermalfibroblasts,DFs)是真皮的主要细胞类型,通过产生细胞外基质(extracellular matrix,ECM)成分,如胶原蛋白和弹性蛋白等,从而维持皮肤结构完整性和弹性。真皮内不仅有DFs,还包括其他免疫细胞,它们对皮肤老化起着关键作用,年轻皮肤与老年皮肤结构对比见图1。
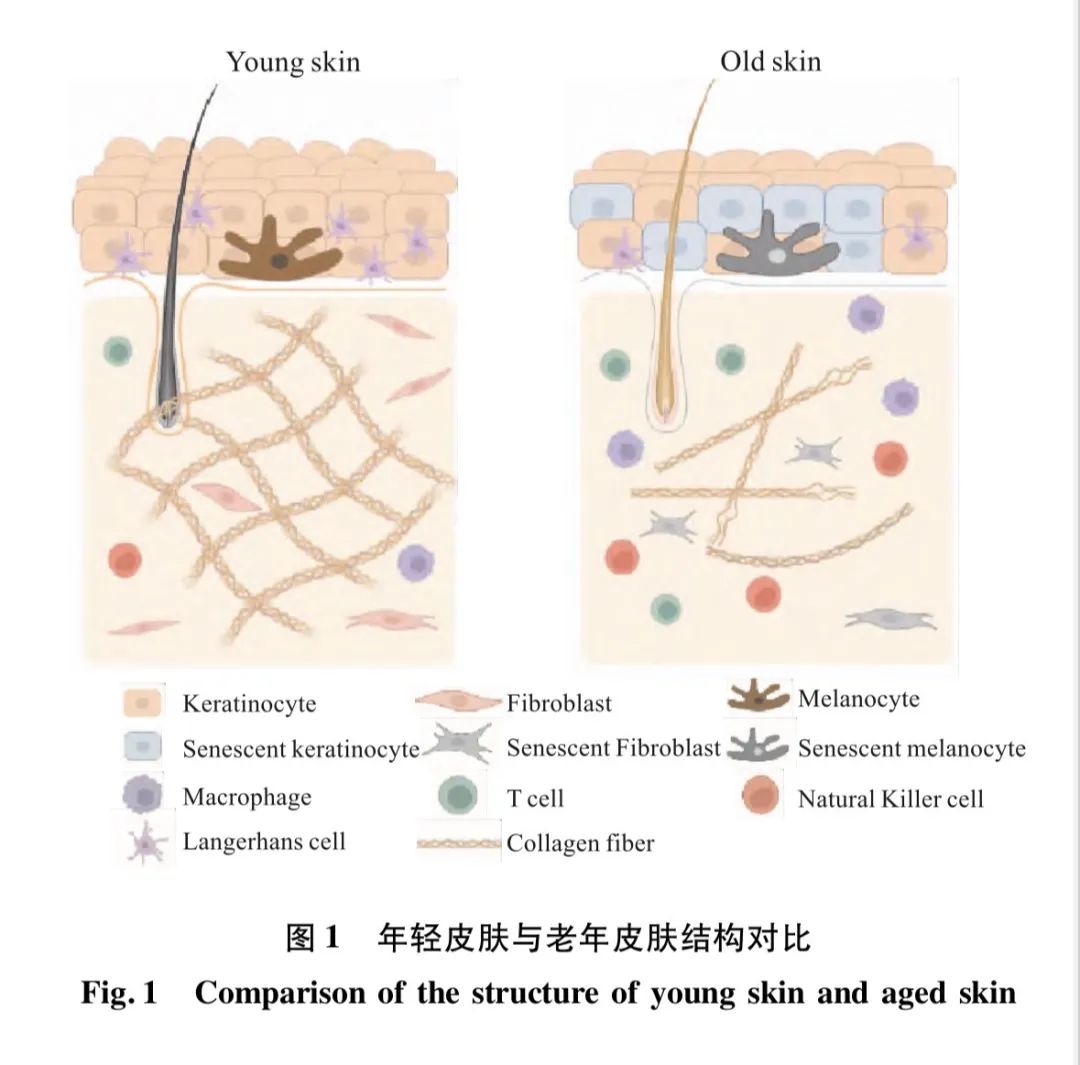
皮肤老化与机体衰老的关系
皮肤老化是机体衰老最明显的表现,面部皱纹的严重程度与机体的健康状况、寿命和心血管疾病风险增加等存在显著相关性。皮肤能感知紫外线辐射、污染物和微生物等环境压力,并通过分泌激素、神经肽等物质协调机体反应,发挥类似下丘脑垂体-肾上腺(HPA)轴的功能。下丘脑-垂体肾上腺轴的激活增加了下丘脑中促肾上腺皮质激素释放激素(CRH)的产生和释放。而下丘脑通过生长激素释放激素、生长激素和胰岛素样生长因子-1(insulin-like growth factor1,IGF-1)在调控机体的衰老进程中起着关键作用,随着年龄的增长,一些哺乳动物的生长激素释放激素水平下降,会导致生长激素水平降低,影响寿命。
此外,皮肤的神经内分泌功能维持着皮肤和大脑之间的通信,有专家研究显示,紫外线照射后,小鼠的脑和血浆中促肾上腺皮质激素释放激素、血浆促肾上腺皮质激素、β-内啡肽和皮质酮水平升高,从而导致免疫抑制。
皮肤老化的表现
皮肤老化是一个复杂过程,受内外因素影响,导致皮肤结构、功能和外观变化。内在因素表现为细纹、皮肤变薄干燥和弹性下降,最显著的变化是表皮基底层细胞增殖减少和表皮变薄。外在因素主 要由紫外线引起,表现为皮肤松弛、皱纹粗而深、粗糙、弹性丧失和色素沉着。与内在老化导致的表皮变薄不同,光老化会使皮肤表皮角质层增厚,这是由于在光照下,角质细胞桥粒无法正常降解造成的。紫外线照射会促进黑色素细胞增殖以保护皮肤免受光损伤,但同时也可能导致色素沉着。
皮肤衰老中的细胞衰老机制
DFs
DFs是重要的基质形成细胞,通过合成ECM的成分维持着皮肤的组织结构。在年轻皮肤中,DFs黏附在其周围的ECM上,这种黏附性使DFs对周围的ECM施加机械力,维持着ECM的组成和结构。在老化的皮肤中,DFs数量减少导致胶原蛋白和弹性蛋白合成减少,从而破坏了DFs和ECM之间的相互作用,最终其他ECM成分,包括弹性纤维、糖胺聚糖和蛋白聚糖的数量也会减少。这进一步推动了胶原纤维的断裂,使DFs黏附性受损无法向周围ECM施加机械力,ECM发生改变和降解,最终表现为真皮变薄、皱纹增加和弹性丧失。衰老的DFs还可能通过衰老相关分泌表型(SASP)对其周围的其他细胞和组织微环境产生有害影响。随着年龄的增加,衰老DFs会在皮肤中积累,产生白细胞介素(interleukin,IL)-6、基质金属蛋白酶(matrix metalloproteinases,MMP)和多种其他趋化因子。
综上所述,DFs的衰老会引起其细胞数量减少以及产生MMP等物质,是导致皮肤老化的主要原因之一。有研究表明维甲酸可以通过激活DFs促进胶原蛋白的合成,同时抑制MMPs的表达,从而改善皮肤老化。另外,维甲酸还可诱导ECM中重要的结构性蛋白微纤维成分从头合成,重构真皮弹性纤维网络,使其成为对抗皮肤老化的关键治疗策略。
朗格汉斯细胞
朗格汉斯细胞(Langerhans cells,LCs)是表皮中一种特殊的抗原呈递细胞,参与形成了皮肤免疫的第一道防线。研究结果显示,与年轻皮肤相比,老化的表皮中LCs的数量减少,这与老年皮肤中IL-1β的表达水平降低有关。在老化的皮肤中,LCs中抗菌肽人β-防御素-3(humanβ-defensin-3,hβD3)表达降低,所以LCs数量的减少可能导致皮肤抗菌能力减弱。综上,LCs对于皮肤老化至关重要,LCs在皮肤衰老过程中数量减少以及细胞中IL-1β等炎症因子、hβD3物质表达降低,导致皮肤免疫功能减弱和修复能力的下降。因此,深入理解LCs在皮肤老化中的作用机制,对于开发新的抗衰老策略具有重要意义。
T细胞
衰老过程中,在反复的抗原刺激后,人类抗原特异性T细胞会产生诱导耗竭和衰老等改变,其特征是高表达程序性细胞死亡蛋白1(programmed death-1,PD-1)和T细胞的活性下降。与年轻皮肤相比,老年人皮肤中辅助性T细胞4(CD4+T)和辅助性T细胞8(CD8+T)上的PD-1表达均增加,这表明老年T细胞更容易通过PD-1信号传导受到抑制。另外,皮肤受到紫外照射后,芳香烃受体(AhR)的配体FICZ刺激角质形成细胞中环氧化酶-2(cyclooxygenase-2,COX-2)的表达,COX-2/前列腺素E2(PGE2)信号诱发了前列腺素受体4(EP4)的激活,从而诱导了调节性T细胞(Treg)的产生并发生免疫抑制,促进了光老化的进程。针对芳香烃受体和COX-2信号通路的抑制剂目前在开发中,旨在阻断光老化相关的免疫抑制途径,从而延缓皮肤衰老。
巨噬细胞
皮肤中,巨噬细胞主要存在于真皮层,由组织常驻巨噬细胞和骨髓来源的单核细胞组成。在皮肤衰老过程中,巨噬细胞功能和表型会受到一些因素的干扰,比如当巨噬细胞营养感应失调时可以促进巨噬细胞糖酵解并抑制氧化磷酸化,从而有利于M1型巨噬细胞在老化皮肤中的积累。Gatheretal研究发现人类老年皮肤中的巨噬细胞至少增加了50%,更多的巨噬细胞表现出M1样促炎特征,且这些巨噬细胞是从单核细胞发育而来的。在光老化中,巨噬细胞亦表现为促炎特征,紫外线照射会先在表皮细胞中引起氧化应激,导致受损细胞和氧化脂质的积累。受损细胞和氧化特异性抗原表位(OSE)会被补体系统识别,从而引发炎症,导致巨噬细胞的浸润和活化。活化的巨噬细胞会释放高水平的MMP和活性氧(reactive oxygen species,ROS),降解ECM。巨噬细胞释放促炎因子,引起慢性炎症和真皮的进一步损伤,从而加速光老化的进程。
综上,巨噬细胞在皮肤老化过程中扮演着重要角色,通过释放炎症因子和蛋白酶,参与皮肤的降解和修复过程。随着年龄的增长,巨噬细胞的功能可能会发生改变,导致炎症反应的持续和加剧,进而加速皮肤老化。有报道指出抗氧化剂(维生素C、 维生素E、超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和辅酶Q10)通过下调丝裂原活化蛋白激酶(MAPK)通路,减少降解胶原蛋白的MMP合成,中和ROS来缓解皮肤老化。
干细胞
Lgr6+干细胞是胚胎早期形成整个表 皮和附件的细胞,有研究者通过激活皮肤中Lgr6+干细胞后发现,受试者皮肤的皱纹和油脂减少,毛孔明显缩小,色素沉着变浅,皮肤弹性和水合能力也有改善的趋势。有证据表明在皮肤衰老 过程中,表皮干细胞的对称分裂和不对称分裂的平 衡会发生变化,主要倾向于对称分裂。所以,随着年龄的增长,不对称分裂的减少会导致表皮变薄。另外,表皮干细胞中半桥粒成分胶原XⅦ在不同干细胞之间存在差异表达以驱动细胞竞争,有助于维持皮肤的整体结构和完整性。但是,半桥粒成分胶原XⅦ的表达会随年龄增长、氧化应激和紫外线照射 而下降,限制了干细胞之间的竞争,从而促使皮肤老化。高超通过探讨人脐带间充质干细胞来源的外泌体对皮肤光老化模型的影响,发现其能缓解户外紫外线诱导的皮肤光老化损伤小鼠的炎性细胞浸润与皮肤弹性的下降,减少皱纹的产生,改善表皮细胞坏死,能极大的缓解皮肤光老化的发生。
综上,干细胞随着年龄的增长自我更新能力下降,导致皮肤修复和再生能力减弱。在皮肤老化治疗领域,干细胞技术的研究是近年来关注的热点。脂肪来源的干细胞产生一系列生长因子,如血管内皮生长因子、碱性DFs生长因子等对周围细胞发挥作用治疗皮肤老化。
皮肤老化中的细胞互作机制
皮肤老化过程中的一个主要组织学改变是ECM的变化。ECM的重塑,包括其成分的沉积和降解,这一过程由DFs和巨噬细胞等细胞完成。Gatheretal通过巨噬细胞与皮肤成纤维共培养实验观察到,经M1型巨噬细胞条件培养基处理的DFs中 MMP-2的表达明显增加,而原胶原蛋白的合成量下降30%。经M2型巨噬细胞条件培养基处理的DFs中转化生长因子-β(transforming growth factor-β,TGF-β)表达增加,TGF-β可增加原胶原蛋白的合成,并抑制MMP-2的表达。在皮肤中,M1型巨噬细胞能够促使DFs释放趋化因子和炎症因子(IL-6、IL-8、TNF-α等)来增强炎症水平,M2型巨噬细胞分泌可溶性因子驱动DFs增殖并产生抗炎效应。相反,经DFs条件培养基处理的巨噬细胞中促炎细胞因子分泌减少,这表明巨噬细胞和DFs存在相互影响。这导致老化皮肤中M2型巨噬细胞的减少可能促进 DFs分泌促炎因子,进一步又会促进巨噬细胞向M1型极化,导致炎症和慢性组织损伤的恶性循环。具体皮肤老化中巨噬细胞与DFs相互作用机制见图2。
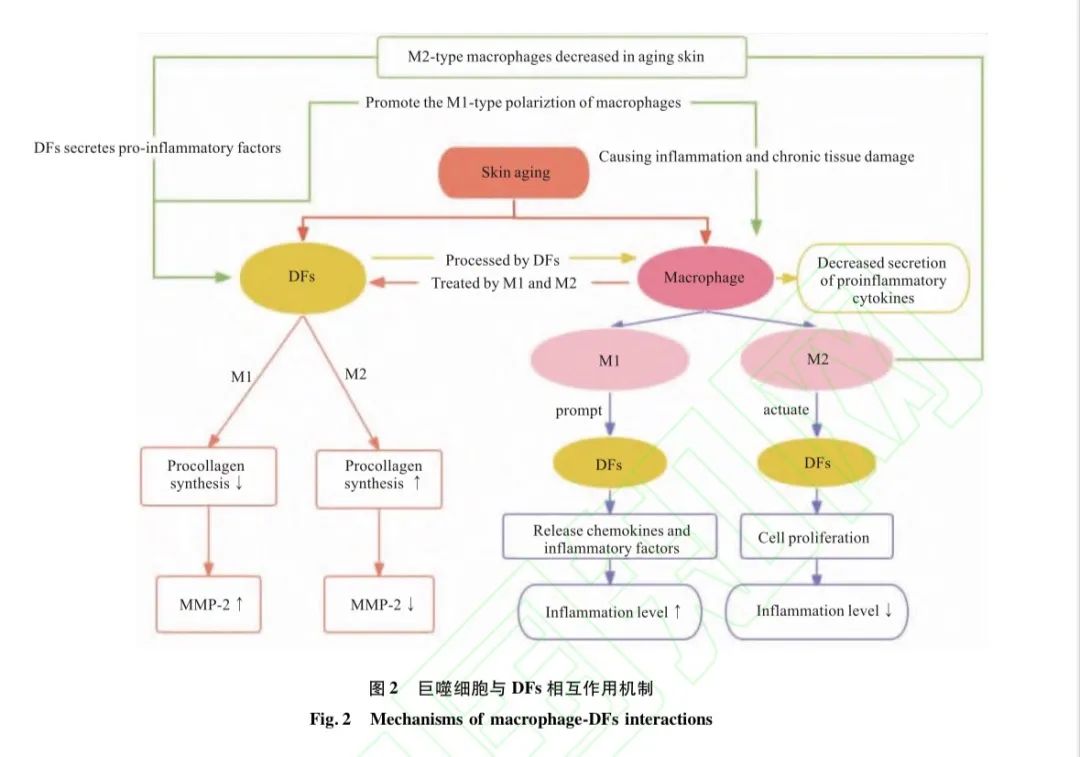
研究表明衰老细胞可以通过激活炎症小体和产生IL-1α等旁分泌的方式诱导邻近细胞发生衰老。小鼠模型中人DFs产生的衰老相关分泌表型通过p38丝裂原活化蛋白激酶(p38MMPK)和核因子κβ通路上调TGF-β表达,TGF-β刺激细胞周期蛋白依赖性激酶抑制剂的表达(如p16INK4A和p21/WAF1),从而引发周围其他细胞衰老。真皮DFs分泌的IGF-1是角质形成细胞增殖的主要调节因子,衰老DFs IGF-1表达下调导致角质形成细胞中无法维持适当的IGF-1受体(IGF-1receptor,IGF-1R)。在受到紫外线照射时,活化的IGF-1R可以通过产生ROS和维持p21的表达使角质形成细胞过早衰老。而改变的IGF-1/IGF1R会使角质形成细胞对紫外线诱导的细胞凋亡更敏感,从而损害表皮的保护屏障功能。另外,有研究表明,细胞外囊泡也是可能的作用方式,与非衰老DFs相比,衰老DFs会分泌更多的细胞外囊泡,从而减弱真皮对角质形成细胞的分化影响。
展望
通过深入研究这些细胞的生物学行为及其相互作用机制,为开发有效的抗皮肤老化策略提供理论依据。未来研究可聚焦于皮肤微环境的调控,探索多细胞协同作用的分子机制,为延缓皮肤老化提供新的治疗靶点。
参考文献:
1.孙阳,招冠钰,黄英荷等.皮肤老化过程中细胞及其作用机制的研究进展[J].安徽医科大学学报,2025,60(6):1160-1165.
2.高超.脐带间充质干细胞外泌体对皮肤光老化的保护作用 [D].合肥:安徽医科大学,2022.
3.窦涵钰,崔白苹,丁小雷.创面瘢痕形成机制研究进展[J]. 上海大学学报(自然科学版),2022,28(5):831-840.
4.更多参考文献(略).


