【衡道丨病例】病理诊断——脾脏错构瘤
时间:2025-08-09 12:33:38 热度:37.1℃ 作者:网络
病史介绍
女性,60岁,“查体发现脾脏占位1周”入院。
辅助检查
腹部B超(图1):
脾脏不大,形态正常,实质回声均匀。脾上极边缘处与左肾上极之间探及混合性回声包块,大小约3.5x3.8x3.3cm,边界尚清,内回声不均,内见多个囊样结构,与脾上极分界不清(图1)。
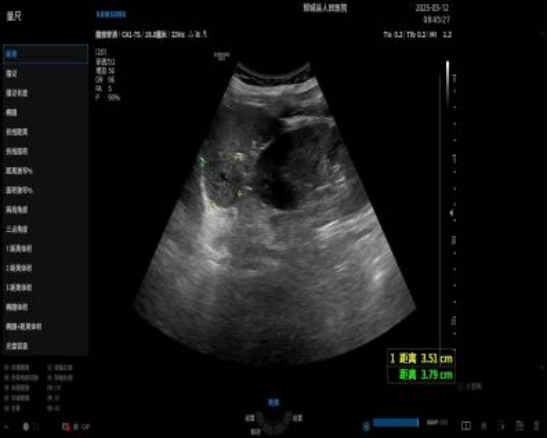
图1:超声见脾上极边缘处与左肾上极之间探及混合性回声包块,大小约3.5x3.8x3.3cm,边界尚清,内回声不均,内见多个囊样结构,与脾上极分界不清。
腹部强化MRI(图2-图3):
左上腹后部软组织块,示鸟嘴征,长径约4.5cm,T1WI等低信号,T2WI等低信号,内见类圆形略长T2信号,DWI等低信号为主,反相位信号较同相位略高,增强扫描较明显不均匀强化,提示富血供,突出脾脏轮廓之外,与胃关系密切。诊断左上腹后部富血供占位性病变,脾脏来源良性肿瘤可能性大,不除外脾血管瘤、窦岸细胞细胞瘤。
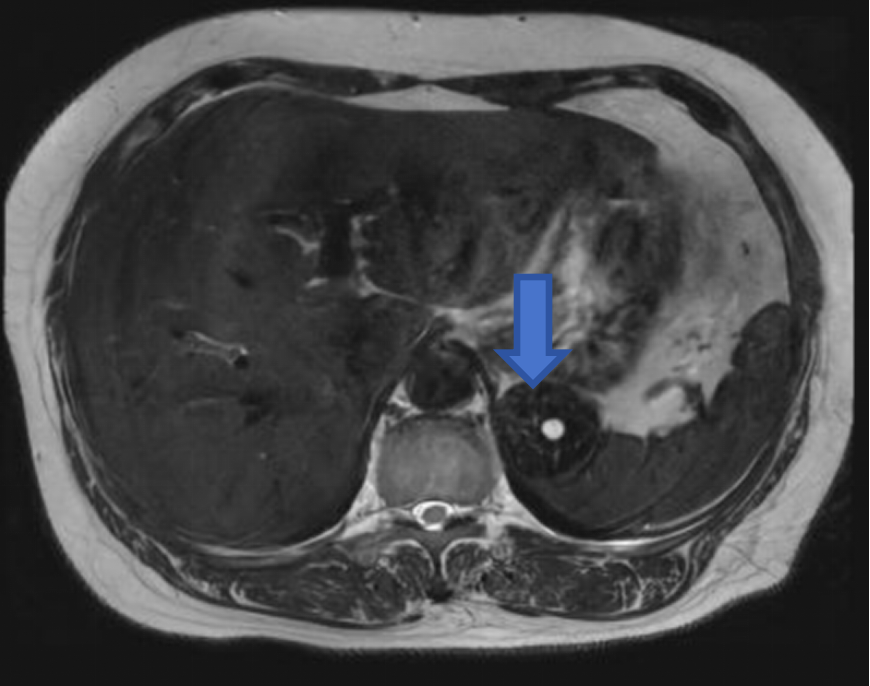
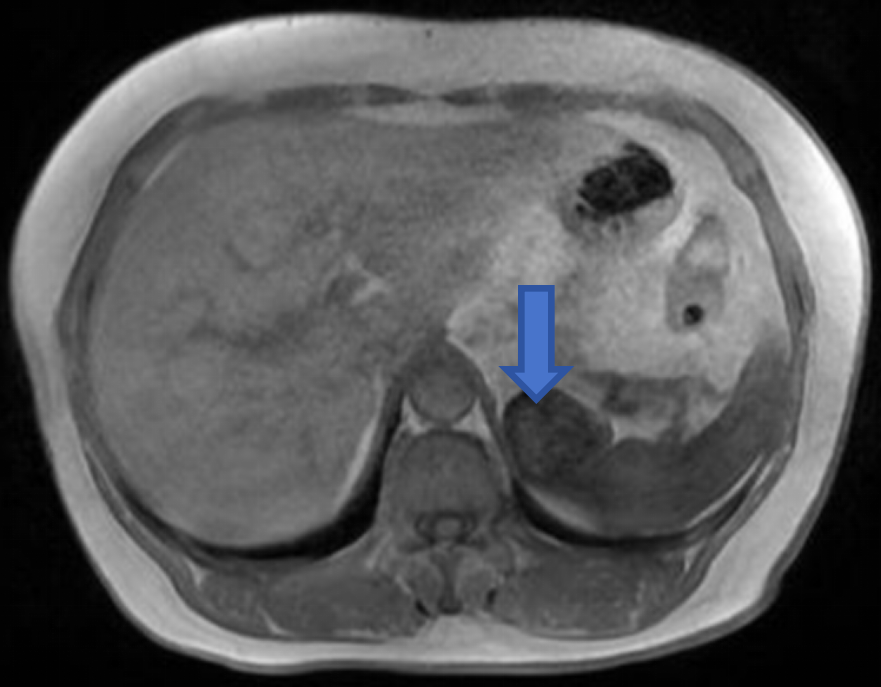
图2:T2WI病灶以低信号为主,内见散在条形高信号;T1WI正相位病灶呈等低信号;
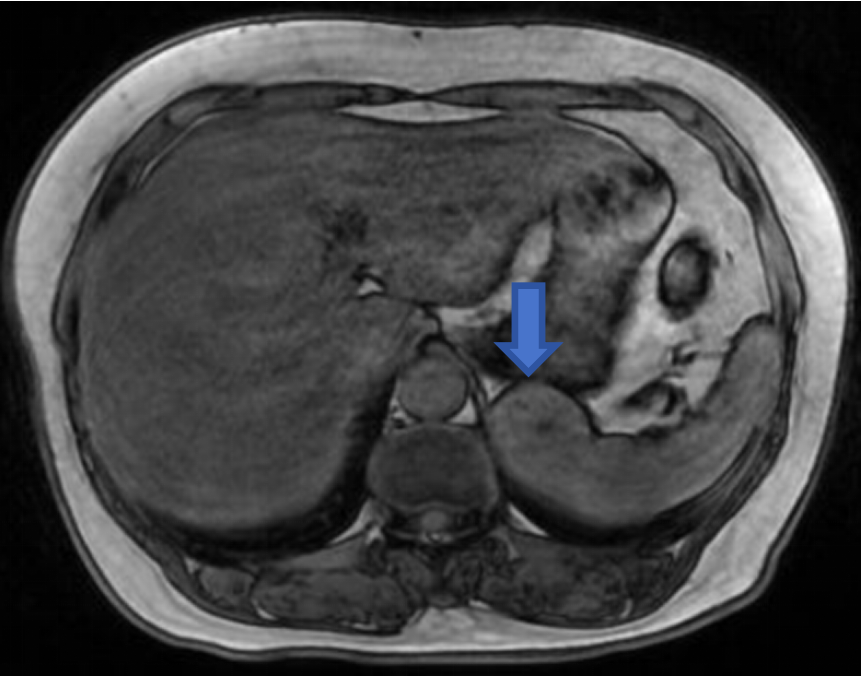
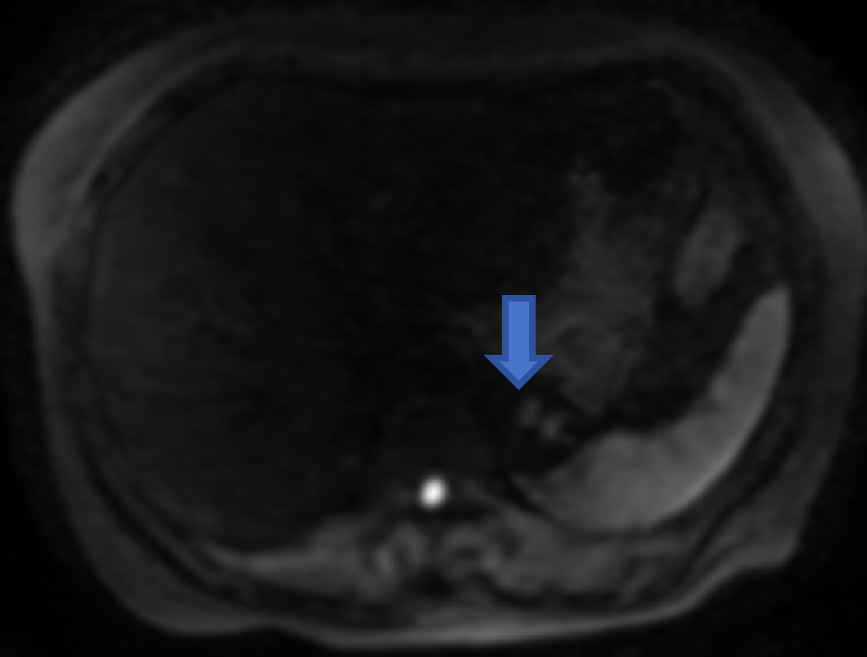
图3:T1WI反相位病灶呈等信号;DWI病变呈低信号;
组织病理检查
1、肉眼观(图4):
脾脏组织多块,总体积12.5㎝×8㎝×3㎝,表面部分光滑附被膜,其中两块组织切面查见一肿物,总体积4㎝×3.5㎝×3㎝,灰红质中,紧邻被膜,与周围脾脏组织分界尚清。其余脾切面灰红质中。
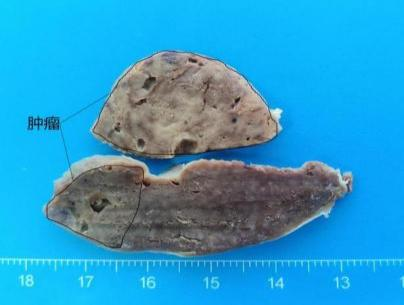
图4:肿瘤切面灰红质中,紧邻被膜,与周围脾脏组织分界尚清。
2、镜下观(图5-图6):
肿瘤内脾脏正常结构消失,正常成分比例失调,排列紊乱,以窦隙状血管及小血管为主,局灶血管簇状增生,管壁玻璃样变性,内衬上皮扁平或立方状,圆形或卵圆形,形态温和。少量梭形细胞及大量淋巴细胞、组织细胞穿插分布其间,并见散在单核、双核或多核,核形不规则的奇异间质细胞,部分核仁明显,类似RS细胞,部分染色质模糊深染,呈退行性改变,未见核裂。
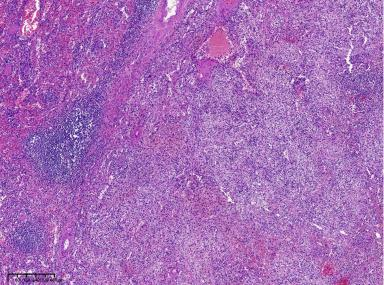
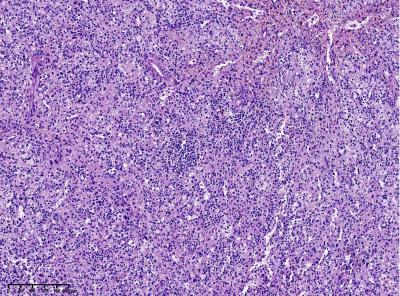
图5:肿瘤边界尚清,脾脏正常结构消失,正常成分比例失调,排列紊乱,以窦隙状血管及小血管为主,少量梭形细胞及大量淋巴细胞、组织细胞。(40X)
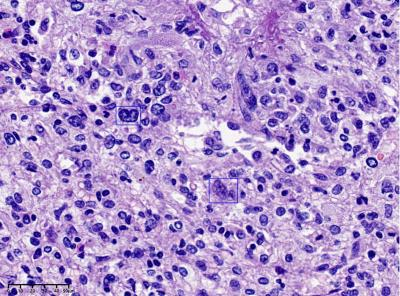
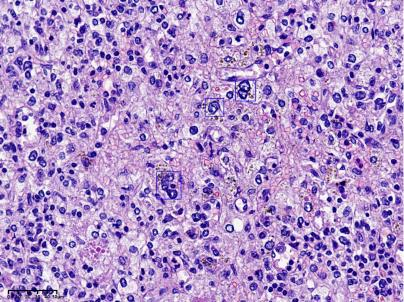
图6:散在单核、双核或多核,核形不规则的奇异间质细胞,部分核仁明显,类似RS细胞,部分染色质模糊深染,呈退行性改变,未见核裂(框内)。
3、免疫组化:
阳性:CD31(窦内皮+)、CD61(部分+)、CD8(窦内皮+)、ERG(窦内皮+)、MPO(少许+)、CD68(部分窦内皮+)、Desmin(个别奇异核细胞+)、SMA(少量细胞+)、Vimentin(+)、CD3(T细胞+)、CD20(B细胞+)、Ki67(+,约2%)。
阴性:CD34(窦内皮-)、CK(-)、S-100(-)、CD21(-)、CD23(-)、CD30(-)、ALK(-)、LCA(-)、EMA(-)。
原位杂交:EBER(-)
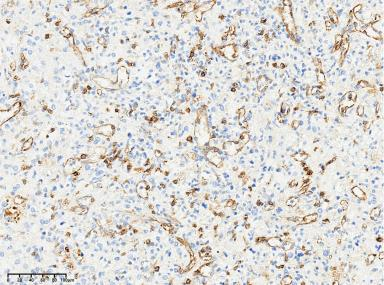
200X
100X
图7:CD8窦内皮细胞强阳性 免疫组化染色(Envision plus法)。CD68窦内皮细胞及组织细胞阳性(Envision plus法)。
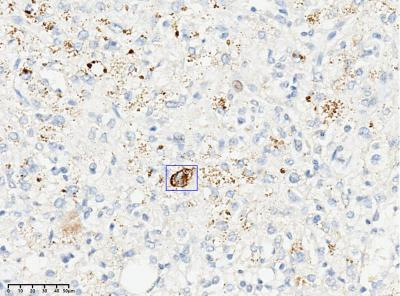
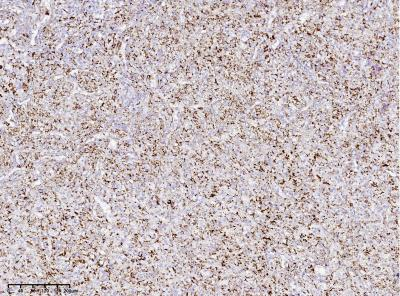
400X
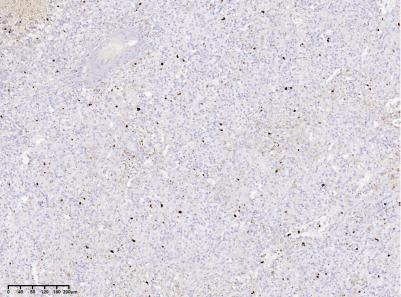
100X
图8:Desmin个别奇异核细胞表达(Envision plus法)。增殖指数Ki67表达率低,约2%(Envision plus法)。
病理诊断
(脾脏)伴较多间质奇异细胞的脾脏错构瘤
讨论
背景:
1、WHO定义:
脾脏错构瘤是一种脾实质境界清楚的良性病变,由排列紊乱的红髓成分组成,没有形成良好的白髓。
ICD-O编码:无
2、临床病理特点
(1)临床特征
大多数脾错构瘤是脾切除标本或尸检时偶然发现。约20%的患者出现与肿块病变相关的症状(如腹部不适和脾破裂)或与脾功能亢进相关的血液学并发症(如血小板减少症或贫血)。
流行病学:脾脏错构瘤并不常见,在尸检系列中报告的发病率为0.024%至0.13%。它们可发生在任何年龄组,包括儿童,中位年龄40岁,并且没有性别倾向。
病因学:未知。结节性硬化症患者中发生罕见病例。报告的与实体或血液系统恶性肿瘤的关联可能是由于这些患者的放射检查或手术探查而偶然发现的脾错构瘤。
发病机制:脾脏错构瘤被认为是一种畸形、血管肿瘤或创伤后反应性病变。虽然人类雄激素受体检测(HUMARA)检测提示多克隆病变,但有一例克隆核型异常报道。
(2)影像学
CT平扫:脾脏错构瘤多单发,少数为多发,病灶大小不等;伴有脂肪组织及钙化是典型的影像学特征,但极少见。平扫常表现为等或稍低密度,有时仅能凭借轮廓改变判断病灶的存在。
MR平扫:T1WI上常呈等或稍低信号;T2WI上纤维型表现为低信号、其余类型呈高或稍高信号,同时病灶内髓窦扩张越明显、纤维成分及钙化越少,则T2WI信号越高,反之信号越低;DWI成像主要表现为低信号
增强MRI:红髓型及混合型富含脾窦,为富血供,动态增强扫描表现为动脉期不均匀斑片状轻度强化或明显强化、门静脉期及延迟期持续强化,强化程度接近或稍高于脾脏;白髓型富含淋巴组织,为乏血供,动态增强扫描强化不明显;纤维型富合纤维组织,动态增强扫描表现为延迟性强化;少数病灶因完全囊变或钙化而增强扫描无强化。
(3)病理学特征
1)肉眼观(图片源自WHO)
脾错构瘤是圆形的,有界限,但无包膜。大多数是孤立的,但有些是多个。它们呈现暗红色至白色,平均直径5cm(范围1cm-20cm)。
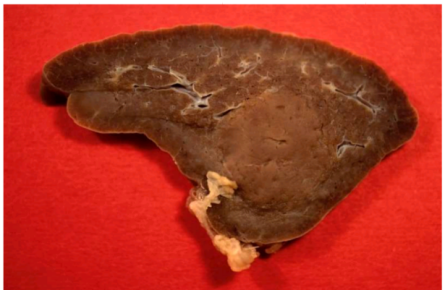
脾脏错构瘤,脾脏切面显示一个边界清楚的结节,缺乏周围正常脾脏所见的小梁血管。
2)镜下观(图片源自WHO)
尽管大体检查边界清楚,但显微镜下边界往往不清楚。病变由不规则分散的窦状血管裂隙组成,血管裂隙内衬饱满的内皮,巨噬细胞与纤维血管间质混合,在结构上使人联想到紊乱的红髓组织。没有形成良好的白髓,尽管可以发现淋巴聚集体。其他特征可包括局灶性硬化、钙化、出血、紫癜、浆细胞增多、髓外造血、巨噬细胞大量聚集(富含组织细胞的变体)、黄色瘤组织细胞、嗜酸性粒细胞和肥大细胞。罕见的是,散在的奇异细胞,细胞质不清,核不规则,染色质有泡和明显的核仁。在该群体中细胞角蛋白、肌动蛋白或结蛋白的不同程度表达,提示副网状细胞分化。
根据肿瘤成分不同一般分为3型,红髓型、白髓型或混合型,也有将明显纤维化者另外归类为纤维型。红髓型最常见。
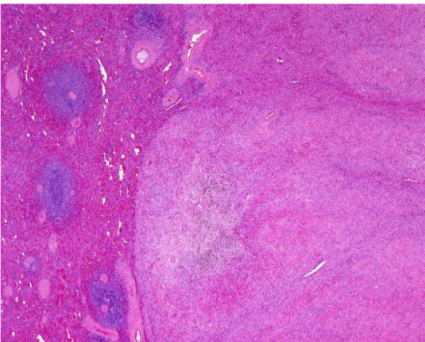
病变(右视野)与正常脾组织(左视野)界限清楚。
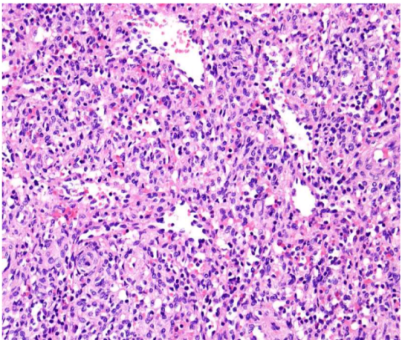
病变包括不规则散在的血管裂隙,内衬有饱满的内皮细胞,使人联想到脾窦。组织细胞和间质细胞位于两者之间。
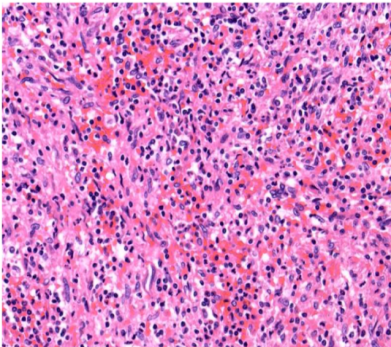
血管腔隙并不明显,间质细胞、组织细胞及淋巴细胞混合存在,脾窦型血管不明显。
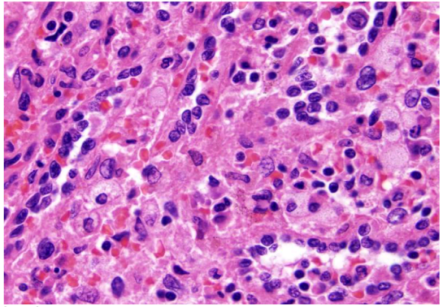
脾窦型血管明显,并被许多组织细胞(一些泡沫细胞)隔开,在结构上使人联想到混乱的红髓组织。
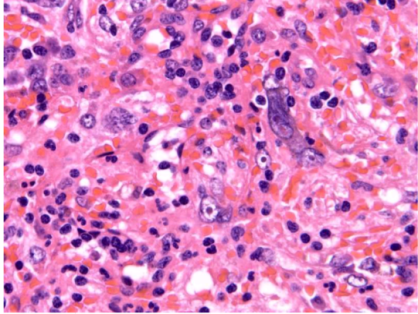
一个具有散在的奇异间质细胞的病例。
3)免疫组化(图片源自WHO)
窦隙状血管成分表达CD8、CD31,部分表达CD68,CD34阴性,CD8为T淋巴细胞的标记物,脾窦内皮表达CD8为本病特异性的表现。淋巴细胞表达CD3、CD20。CD21、CD23阴性,表明无生发中心存在。梭形细胞成分表达SMA、Vimentin。间质内个别奇异核间质细胞表达Desmin。Ki67增殖指数低。
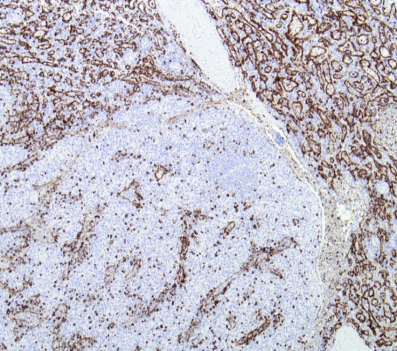
CD8免疫染色显示周围正常脾组织(上野)有序的脾窦,错构瘤(下野)中间隔更宽、形状不规则的脾窦。
鉴别诊断
(1)血管源性肿瘤:
脾脏错构瘤因血管丰富,易于血管源性肿瘤混淆, 脾脏血管瘤单结节或多结节状,呈海绵状血管瘤或毛细血管瘤样。免疫组化表达CD31、CD34,不表达CD8和CD68。窦岸细胞瘤内皮细胞肥大增生,可成鞋钉状或乳头状,胞浆嗜酸性,免疫组化表达CD31、CD68,CD34一般阴性,不表达CD8。硬化性血管瘤样结节状转化,由多发性血管瘤样结节和纤维硬化间质组成,因血管类型不同并表达不同的标记物。三种常见脾脏血管源性肿瘤均可以通过形态及免疫组化进行鉴别。错构瘤的血管内皮不具备恶性的形态特征与恶性肉瘤亦不难鉴别。
(2)霍奇金淋巴瘤:
因存在RS样细胞、淋巴细胞及组织细胞背景,形态上两者需要鉴别,错构瘤RS样细胞CD15、CD30阴性,窦隙状血管丰富,窦内皮CD8阳性可鉴别。
(3)局灶性髓外造血:
SH间质内出现奇异核细胞需要与脾髓外造血鉴别,脾脏髓外造血时脾脏肿大,巨核细胞表达CD61,不会表达Desmin,同时有红系及髓系存在,并表达相应的标记物。
(4)慢性脾血肿:
SH有时会模拟慢性脾血肿,但是SH一般不会出现脾小体的生发中心。
(5)炎性假瘤:
梭形的纤维母及肌纤维母细胞增生,伴胶原化间质,散在急慢性炎细胞浸润,不表达血管源性标记CD31、CD34、CD8。
(6)EBV阳性炎性滤泡树突细胞细胞肉瘤:
肿瘤细胞圆形或椭圆形,边界不清,小核仁,与散在的淋巴细胞、浆细胞混合分布,常见一些扩张的血管,其血管壁有纤维素物质沉积,并且可见大的异型细胞甚至RS样细胞散在分布,二者形态非常类似,但免疫组化CD21、CD23、SMA阴性及ISH-EBER阴性,CD8窦隙样血管阳性表达可鉴别。
治疗及预后
手术切除是治疗的最佳手段。专家建议根据实际情况尽量选择部分脾脏切除,尽最大可能保留脾脏的功能,也防止损伤胰尾。完整切除后,未见复发及转移的报道。
参考文献:
[1]Ohta M , Tsutsumi Y , Tanaka Y .SPLENIC HAMARTOMA[J].Pathology International, 1986.DOI:10.1111/j.1440-1827.1986.tb01036.x.
[2]Obeidat, Khaled A et al. “Splenic Hamartoma: A Case Report and Literature Review.” The American journal of case reports vol. 23 e937195. 21 Sep. 2022, doi:10.12659/AJCR.937195
[3]Asian J Surg. 2024 Nov 12:S1015-9584(24)02520-X. doi: 10.1016/j.asjsur.2024.10.186. Online ahead of print.
[4]Xu, Shao-Yan et al. “Successful treatment of pancreatic accessory splenic hamartoma by laparoscopic spleen-preserving distal pancreatectomy: A case report.” World journal of gastrointestinal oncology vol. 14,5 (2022): 1057-1064. doi:10.4251/wjgo.v14.i5.1057
[5]Sabra, Tarek Abdelazeem et al. “A splenic hamartoma: Adding a new case to the literature: A case report.” International journal of surgery case reports vol. 90 (2022): 106647. doi:10.1016/j.ijscr.2021.106647
[6]Cheuk W , Lee A K C , Arora N ,et al.Splenic hamartoma with bizarre stromal cells.[J].American Journal of Surgical Pathology, 2005, 29(1):109-14.DOI:10.1097/01.pas.0000146026.69082.68.
[7]Obeidat, Khaled A et al. “Splenic Hamartoma: A Case Report and Literature Review.” The American journal of case reports vol. 23 e937195. 21 Sep. 2022, doi:10.12659/AJCR.937195


