胎儿先天性心脏病的产前介入治疗进展
时间:2025-08-26 12:08:58 热度:37.1℃ 作者:网络
摘 要
本文聚焦胎儿先天性心脏病的产前介入治疗领域,着重阐述胎儿主动脉瓣成形术(fetal aortic valvuloplasty,FAV)与胎儿肺动脉瓣成形术(fetal pulmonary valvuloplasty,FPV)的最新研究动态。FAV 旨在优化左心血流动力学,预防左心发育不良综合征,推动双心室循环的建立;FPV 致力于改善室间隔完整的肺动脉闭锁及室间隔完整的危重肺动脉瓣狭窄的疾病进程,缓解右心室流出道梗阻,促进双心室循环。文中深入探讨两种手术的患者筛选标准、技术操作要点、风险评估策略及临床治疗效果,点明当前研究面临的困境,如患者选择标准缺乏统一性、长期预后研究匮乏等问题。同时,剖析国内胎儿心脏介入治疗的发展契机与挑战,并对未来研究方向与改进举措提出建设性意见,以期为该领域的深入发展提供参考依据。
正 文
先天性心脏病(先心病)作为最常见的先天性畸形,2020年先心病在围产儿(妊娠28周到出生后7 d)中的患病率达 17.32/1 000 [1]。其中,主动脉狭窄(aortic stenosis,AS)的发病率占先心病总数的8.1%,左心发育不良综合征(hypoplastic left heart syndrome,HLHS)占1.11%,妊娠中期(13~27孕周)确诊严重AS的胎儿,常于出生前进展为HLHS[2-4]。肺动脉狭窄(pulmonary stenosis,PS)及室间隔完整的肺动脉闭锁(pulmonary atresia/intact ventricular septum,PA/IVS)的发病率在先心病亚型中排第4,且国内发病率相对欧美地区偏高,占所有先心病的11.80%[4-5]。胎儿心脏介入(fetal cardiac intervention,FCI)自首次报道至今已逾 30 年,大量研究[6]表明其在缓解心室流出道阻塞、改善心脏功能及促进心脏再发育方面成效显著。胎儿主动脉瓣成形术(fetal aortic valvuloplasty,FAV)经扩张主动脉瓣与二尖瓣,提升左心流量,减轻左室压力负荷,优化左心妊娠期生长轨迹与血流动力学,防范HLHS发生,助力双心室循环(biventricular circulation,BVC)[7]。胎儿肺动脉瓣成形术 (fetal pulmonary valvuloplasty,FPV)则通过扩张肺动脉瓣和三尖瓣,改善疾病进程、缓解右心室流出道梗阻、促进右心室及三尖瓣生长、减少心肌损伤,推动BVC,降低发病率与死亡率[8]。本研究旨在梳理相关研究成果,剖析现存问题与不足,进而为未来研究方向与改进策略的规划提供思路。
1 胎儿主动脉瓣成形术
1.1 主动脉狭窄的病理生理和血流动力学
AS主要病理特征为左心室流出道狭窄,导致左心室压力升高和功能障碍,进而引发一系列血流动力学改变和心脏结构异常。胎儿期的AS会限制左心室发育,由于左心室无法有效扩张和充盈,其腔室逐渐变小,这种情况下,左心室无法在出生后维持足够的系统性心输出量,最终发展为HLHS[9]。
同时,左心室流出道梗阻会导致二尖瓣关闭不全,二尖瓣反流会使左心房压力升高,进一步加重左心室的负担,且由于二尖瓣反流和左心室充盈压力升高,左心房逐渐扩张,导致肺静脉回流受阻,进而引起肺循环压力升高。在胎儿期,卵圆孔和动脉导管开放,允许血液从右心房流入左心房,部分缓解左心房压力。这种代偿机制在胎儿期可以维持相对稳定的血流动力学状态,但出生后卵圆孔和动脉导管关闭,代偿机制消失,最终导致左心室无法维持足够的系统性心输出量,造成严重的血流动力学障碍[9-10]。
1.2 胎儿主动脉瓣成形术的临床意义和发展
在国内,AS发病率为每1000个活产婴儿 0.73 例,HLHS发病率为每 1000个活产婴儿0.10 例,中期妊娠确诊严重AS的胎儿多在出生前进展为HLHS[2-4]。FAV旨在通过恢复主动脉瓣血流,优化心脏血流动力学,促进左室心肌生长发育,改善妊娠中期胎儿AS向HLHS演变的自然病程,力求实现胎儿出生后BVC[11]。
1991年,Maxwell等[12]首次尝试开展FAV,在其报道的2例患者中,1例取得技术上的成功,但2例胎儿均未能取得长期的生存结局。此后 10 年间,FAV仅报道 12 例,其中 7 例技术成功,主要受限于胎儿选择标准不统一、手术设备适配性欠佳及专业手术团队稀缺等因素[13]。伴随宫内介入技术的持续革新与对 AS 疾病演变机制的深入探究,21 世纪初FAV迎来大规模临床实践,并收获众多技术成功案例,在此过程中,患者筛选标准与术后管理方案得以逐步完善[3]。近10年间,FAV 开展愈发频繁,但仍需依托具备完备医疗资源与丰富经验的医学中心开展[14]。
1.3 胎儿主动脉瓣成形术的患者选择和风险评估
在理想情形下,FAV 适用于未经干预将进展为单心室循环,但经手术干预有望使胎儿左心室功能充分恢复,以维持终生全身血液循环的病例。欧洲儿科心脏病学会(AEPC)收集107例AS胎儿的自然史数据发现,约30%符合潜在HLHS标准的患者和40%以上被认为是FAV理想候选者的胎儿,在未接受产前干预的情况下出生后实现 BVC[2]。因此,精准甄别能从 FAV 手术获益的胎儿,仍是制约该技术推广的关键难题。
当前主流患者筛选标准源自 McElhinney 等[15] 2009 年构建的多变量阈值评分系统,其借助z评分区分产后可能达成BVC的胎儿。该系统涵盖明确的主动脉瓣狭窄或闭锁、左室长径z值>–2,并需满足以下至少4点:左室长径z值>0;左室短径z值>0;主动脉瓣环z值>–3.5;二尖瓣环z值>–2;二尖瓣反流或主动脉瓣最大压差≥20 mm Hg(1 mm Hg=0.133 kPa ),以此筛选出左心室与二尖瓣发育未严重不良的胎儿,确保左心室产后具备支撑全身循环的压力生成能力。2018 年Friedman等[10]在原有标准基础上新增两项:左室压力>47 mm Hg、升主动脉z值>0.57,并指出左心室压力、升主动脉尺寸z值、二尖瓣流入时间z值、左心室长轴尺寸z值等与BVC结果显著相关的独立预测因子,同时强调主动脉瓣尺寸z值在评估胎儿心脏状况及预测FAV术后结局的关键意义,但这些因子的预测效能与适用性尚待大规模多中心临床研究验证。
z评分系统存在固有缺陷,其对心脏结构尺寸测量精度要求严苛,易受扫描平面与角度干扰,不同研究z值计算方法差异致使相同测量值可能对应不同结果,且对测量细微变化过度敏感,易引发心脏结构评估偏差。2022 年 Tulzer 等[9]提出采用右心室与左心室长度比率预测BVC结果,该方法规避复杂z值运算,结合二尖瓣反流最大速度可提升预测准确性。
1.4 胎儿主动脉瓣成形术的技术细节
FAV 技术成功判定标准为在超声引导下精准穿越主动脉瓣并有效扩张瓣膜,同时顺行主动脉瓣血流增加和(或)出现新的主动脉反流[7, 11, 16]。
手术通常选在20~26孕周实施,首先运用超声心动图精准定位胎儿,经孕妇腹壁与子宫壁,以长15~20 cm的18号针经胎儿次肋骨途径抵达左室近心尖部。穿刺针就位后,引入导丝穿过主动脉瓣进入升主动脉,随后沿导丝推送预装标记的冠状动脉球囊导管至主动脉瓣处,重复充气扩张(6~15 bar),目标球囊与瓣环比例控制在1.1~1.2,实现瓣膜扩张与血流改善[6, 17-19]。手术全程借助超声心动图动态监测胎儿心脏功能与手术效果,确保瓣膜有效扩张并及时排查主动脉瓣反流及其他并发症。手术成功的关键在于保障胎儿体位适宜、导管操作精确、球囊扩张适度及并发症监测严密。
手术风险方面,近年技术成功率约77%~94%,胎儿死亡率10%~11%。主要胎儿术后并发症包括心动过缓、胸腔积液、心包积液、左心室血栓、胎盘早剥、球囊破裂及早产等,截至目前仅报道1例胎盘早剥,母体严重并发症尚无报道[14, 20]。
1.5 胎儿主动脉瓣成形术的临床结果和预后
表1显示,随着手术量的增加,FAV技术成功率和双心室率都有所提高,在FAV技术成功的AS或HLHS胎儿中,约40%~70%出生后实现BVC[14, 18, 21-22]。一项研究显示,干预组主动脉瓣环直径z值由术前–2.5±0.9降至–2.9±1.0,二尖瓣环直径z值从–1.2±1.2 降至–2.2±1.3,升主动脉直径z值从–0.4±2.0降至–0.6±1.5,左心室长轴z值自0.9±1.8提升至1.4±1.5,均优于未治疗组,表明心室与瓣膜发育获一定程度改善[10, 16]。但需注意,左心室尺寸术后无显著变化,这可能是HLHS内在病理特性、早期不可逆损伤、生长潜能局限、手术时机选择、血流动力学改变有限、个体生理反应差异、评估方法局限及疾病持续进展等多因素共同作用结果,致使左心室对手术干预反应不明显[15, 19]。
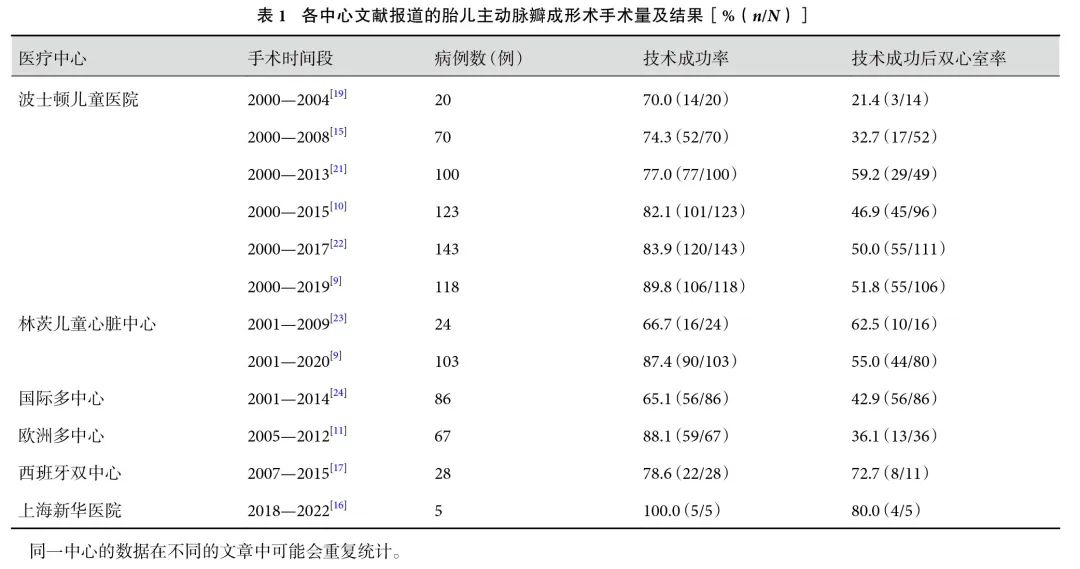
FAV可提升胎儿生存率,有研究[22]推算接受FAV的胎儿6岁前无移植生存率近82%(无论能否实现BVC),未接受手术者约72%。在波士顿儿童医院的回顾性研究[21]中,100例接受FAV患者中,88例活产,38例(43%)实现BVC。中位随访5.4年,结果显示,双心室患者5年无心脏死亡生存率为96%±4%,10年为84%±12%,优于单心室循环患者(log-rank P=0.04)。虽然BVC策略的长期生存率较高,但需要多次干预,多数患者左心室功能正常,但超1/3存在心室扩张,这些患者仍面临主动脉瓣和二尖瓣疾病,需进一步干预或瓣膜置换[25]。
尽管倾向得分模型分析显示FAV组与自然历史(natural history,NH)组BVC结局(36%与38%)无显著差异,但FAV组因改善血流动力学与保护左心生长,10年随访生存率更佳,且与最终循环类型无关。不过,因缺乏随机对照试验,FAV对实现BVC的确切益处仍有待明确[26]。
2 胎儿肺动脉瓣成形术
2.1 肺动脉狭窄及室间隔完整的肺动脉闭锁的病理生理和血流动力学
PS主要病理特征为肺动脉瓣口狭窄或右心室流出道梗阻,导致右心室压力升高和功能障碍,胎儿时期长期的压力负荷增加会使右心室扩张,严重时影响右心室的发育。在胎儿期,由于右心房压力升高,右心房的血液通过卵圆孔向左心房分流增加,卵圆孔内径偏大,呈持续开放状态。而肺动脉内压力减低,主动脉的血液可能通过动脉导管反向流入肺动脉。出生后,卵圆孔和动脉导管关闭,肺循环中断,可导致严重的低氧血症。
PA/IVS是一种复杂的先心病,其病理特征和血流动力学改变更为显著,由于肺动脉闭锁,右心室无法将血液射入肺动脉,导致右心室发育不良,右心室小且肥厚。所有体循环静脉血通过卵圆孔进入左心房和左心室,导致左心容量负荷加重,右心室压力显著升高,导致冠状动脉血流减少,甚至形成右心室依赖的冠状动脉循环[27]。
2.2 胎儿肺动脉瓣成形术的临床意义和发展
国际上PS发病率为每1000例活产儿0.5例,国内高达每1 000例活产儿1.06例[4-5]。FPV 作为治疗胎儿严重 PS 或 PA/IVS 的宫内介入手术,旨在通过胎儿期干预优化右心室血流动力学,促进右心室及三尖瓣发育,提升出生后BVC可能性。其临床意义在于改变胎儿右心室发育不良综合征(hypoplastic right heart syndrome,HRHS)自然病程,减少心肌损伤,改善胎儿血流动力学状态,进而提高胎儿出生后生存率与生活质量,降低单心室修复手术需求,提高BVC成功率[28]。
20世纪90年代胎儿介入治疗概念兴起之初,研究重点集中于FPV。伴随影像与介入技术的进步,2002年林茨儿童医院率先开展2例FPV,术后12周虽2例胎儿均出现瓣膜再狭窄并提前分娩接受再次手术,但多普勒超声心动图显示FPV显著改善右心室功能、延长妊娠期,最终2例胎儿均实现BVC,凸显FPV潜力的同时也揭示诸多待攻克难题[8]。2016年,广东省人民医院在国内率先成功为1例PA/IVS胎儿实施宫内FPV[29]。此后国内团队持续推进FPV治疗研究,胎儿先心病介入治疗体系日臻完善[30-31]。
2.3 胎儿肺动脉瓣成形术的患者选择和风险评估
FPV 主要适用于 PA/IVS 和危重肺动脉瓣狭窄(critical pulmonary stenosis,CPS)病例。理想情况下,应施用于若不干预将进展为单心室循环,且干预后右心室功能有望恢复至足以支撑终生全身循环的胎儿。
患者选择标准方面,纽约和波士顿中心侧重右心z值评分,在膜性肺动脉闭锁、存在可识别肺动脉瓣叶或膜且室间隔完整或高度受限基础上,以右心室发育不良、三尖瓣环z值<–2作为手术介入标准[32-33]。马德里和多伦多中心则更关注左右心结构比例,在三尖瓣/二尖瓣比值<0.7、右心室/左心室长度比值<0.6、三尖瓣流入持续时间<31.5%心动周期长度、存在右室冠状动脉连接4个参数中满足3个时,可100%敏感性和75%特异性预测非双心室结局[34-36]。同时提及波士顿中心标准,即三尖瓣z值<–3时双心室修复可能性极低,故其FCI标准涵盖可识别的小但明确的右室及三尖瓣z值<–2[37]。然而,全球范围内仍缺乏统一、基于循证医学的FPV患者选择标准,不同研究及中心标准各异,增加FPV胎儿与非干预胎儿对比难度。
2.4 胎儿肺动脉瓣成形术的技术细节
FPV技术流程与FAV相似,但前者针对肺动脉瓣且技术难度更高。手术时机通常选在妊娠26~29周[38]。术前借助超声心动图详细评估胎儿心脏,明确肺动脉瓣狭窄或闭锁程度及右心室、三尖瓣发育状况。手术在超声引导下,以18或19号穿刺针依次穿透孕妇腹壁、子宫壁、胎儿胸壁,经胎儿次肋骨途径精准进入右心室流出道,引入冠状动脉导丝穿过肺动脉瓣口至动脉导管,沿导丝推送预定尺寸球囊至肺动脉瓣口充气扩张,恢复右心室至肺动脉前向血流。术中持续超声监测胎儿心脏功能与手术效果,确认瓣膜有效扩张并排查肺动脉瓣反流及其他并发症,同时密切监测胎儿心率,心动过缓时立即心内注射肾上腺素或阿托品救治。术后经超声心动图评估手术效果,涵盖瓣膜开放、血流改善及右心室发育情况[29, 34, 39-40]。FPV手术成功关键在于精准穿刺定位、合适球囊选择及并发症快速有效处理。
FPV手术难度较高,技术成功率约70%~80%,胎儿死亡率7%~12%[39, 41-42]。术后胎儿并发症包括心动过缓、心包积液和心脏压塞、心脏损伤、提前分娩及宫内死亡等,但随着技术进步与经验积累,成熟胎儿治疗中心此类风险已显著降低[41, 43-44]。
2.5 胎儿肺动脉瓣成形术的临床结果和预后
FPV 临床结果与预后总体较为乐观,接受手术的胎儿中约71%~89% 出生后实现BVC[39, 42-43]。有临床研究[16, 40, 45]表明,与术前相比,成功接受 FPV的胎儿右心室的三尖瓣大小、三尖瓣/二尖瓣比值、右室/左室比值、肺动脉瓣/主动脉瓣比值均显著改善,证实右心室存在实质性生长且有追赶生长趋势。但右心室与三尖瓣发育可能不同步,宫内右心室发育迅速,三尖瓣出生后发育更显著,这可能影响最终心脏功能与预后,尤其在 6 个月至 1 年期间,三尖瓣发育速率优势明显[42, 44, 46]。部分FPV技术成功病例出现三尖瓣再度狭窄或闭锁,可能与术中球囊尺寸受限、术后瓣膜粘连或PS和PA/IVS病理机制相关,导致右心室和三尖瓣再次发育无法满足BVC要求[29, 45, 47]。
总体而言,FPV可改善胎儿血流动力学,促进右心室生长与功能恢复,显著改善三尖瓣和肺动脉瓣尺寸及功能[48]。但现有研究多为短期随访,长期预后数据匮乏,尤其是术后心室功能、生活质量及远期生存率等信息亟待补充。
3 胎儿房间隔造口术
胎儿房间隔造口术(fetal atrial septal intervention,FASI)适用于HLHS伴完整或限制性房间隔(I/RAS),通过球囊扩张卵圆孔促进血流进入左心系统,推动双心室系统发育。
当前该领域研究相对较少,2008 年波士顿儿童医院报道 21 例此类病例,技术成功 19 例,但术后生存率仅 58%[49];2011 年林茨儿童医院相关报道中胎儿生存率亦偏低[23]。2018 年青岛妇女儿童医院开展全国首例FASI[50]。2024 年一项研究[51]对比 FASI 治疗与期待管理治疗的 HLHS 伴 I/RAS 胎儿结果,123 例 FASI 患者中 107 例技术成功,与 623 例期待管理组相比,分娩时平均胎龄、新生儿结局(活产、新生儿死亡、存活至出院)均无差异。FASI 预后较差,可能与胎儿宫内治疗时机偏晚有关,即便扩大房间隔,左心室发育逆转仍困难重重[52]。
4 总结
在国际范围内,FCI已经取得了显著进展,特别是在欧洲和北美的一些中心,这些地区的医疗团队在FAV和FPV方面积累了丰富的经验。相比之下,国内在这方面的发展尚处于早期阶段,尽管有一些成功的案例报告,但整体而言,国内在FCI的实施频率、技术成功率以及长期预后方面与国际先进水平还存在明显差距。
参考国外先进医疗中心的经验,人员培训是提升手术成功率和安全性的关键。由于医务人员对FCI的认识不足,我国大部分医疗中心在产前一旦诊断出先心病,往往不考虑畸形的复杂程度和治疗预后,导致约90%的胎儿面临引产[38]。此外,强化多学科团队的协作培训至关重要,FCI需要产科医师、儿科心脏病专家以及超声科医师等不同专业领域的专家协同工作。因此,确保这些专业人员之间有效沟通和协作的培训计划对于手术的成功至关重要。
其次,器械研发是提高FCI效果的另一个关键因素。当前使用的器械大多基于成人心脏介入治疗的设计,可能不适合胎儿的解剖特点。因此,开发专为胎儿设计的介入器械,如更小的球囊导管和更精确的定位系统,对于提高手术效果和减少并发症具有重要意义。
综上所述,胎儿先心病的产前介入治疗,尤其是FAV和FPV,在改善胎儿心脏功能和预后方面展现出良好的前景。尽管国内在这一领域的研究和实践仍处于起步阶段,但随着技术的不断进步和多学科团队合作的加强,未来有望缩小与国际先进水平之间的差距。通过不断的研究和实践,我们期待为更多胎儿提供有效的治疗方案,改善其生存率和生活质量,为家庭带来希望和光明的未来。
利益冲突:无。
作者贡献:胡洛铭进行研究设计、文献检索、数据分析、撰写初稿、修改与完善;袁海云为本文的写作方向进行了详细规划;陈寄梅为本文提供了研究思路和写作框架,并对展望部分提出了其个人见解。


