罹患结直肠癌/非典型白血病/脑肿瘤年轻患者检出胚系致病性CHEK2/APC突变和体细胞JAK2 V617F变异
时间:2025-08-29 12:13:35 热度:37.1℃ 作者:网络
在直肠腺癌、肺鳞状细胞癌、乳腺癌、卵巢癌及其他多种癌症患者中,CHEK2和JAK2的高表达与较好的生存率相关。有研究表明,CHEK2和JAK2表达降低或缺失导致的基因组改变可能会加剧癌症进展,并预示患者预后不良。本报告呈现一例 35 岁患者的临床病例,该患者表现为多灶性肿瘤,病程进展迅速,其基因检测结果显示存在CHEK2基因胚系突变、体细胞JAK2 V617F突变,以及腺瘤性息肉病coli(APC)基因的一个新的胚系意义未明变异。考虑到该变异的基因组位置,其可能是导致患者息肉病和髓母细胞瘤的原因。此外,两种胚系突变(CHEK2和APC)也可能在该患者中引发两种并发疾病,从而导致较差的临床病程。
背 景
CHEK2是一种在DNA损伤时被激活的蛋白激酶,参与细胞周期停滞。由CHEK2致病性变异引起的癌症易感综合征的特征是结直肠癌、乳腺癌和前列腺癌的发病风险增加。尽管CHEK2被认为是中等外显率基因,但癌症风险可被视为一个连续变量,受家族史和其他修饰因素的影响。JAK2激酶是参与细胞因子受体信号传导的酪氨酸激酶家族成员。JAK2 V617F与某些慢性骨髓增殖性疾病(MPN)的发生有关,如真性红细胞增多症、原发性血小板增多症和特发性骨髓纤维化。尽管这些基因与不同的生物学过程相关,但人们越来越关注探索它们之间潜在的分子和表型联系。JAK2介导的信号通路与CHEK2调节的细胞周期控制功能之间的潜在相互作用,可能揭示某些血液系统疾病和恶性肿瘤发病机制中的共同机制或协同作用。一项全基因组关联研究发现,CHEK2、TERT、SH2B3、TET2、ATM、PINT和GFI1B基因的胚系变异与普通人群中年龄相关的JAK2 V617F克隆性造血以及骨髓增殖性肿瘤的易感性相关。这些基因影响多种生物学通路,如DNA损伤修复和/或肿瘤抑制功能(CHEK2、ATM、PINT)、JAK-STAT信号通路(JAK2、SH2B3)、细胞衰老(TERT)、表观遗传调控(TET2)以及红系/巨核细胞发育(GFI1B)。未来旨在理解JAK2和CHEK2突变之间相互作用的研究,对于拓展临床对潜在病理生理过程的理解以及开发更精确有效的治疗策略至关重要。JAK2 V617F克隆性造血与不良结局相关,包括更高的血液系统癌症风险和总体死亡率。此外,研究表明已识别的遗传变异可能成为未来克隆性造血和骨髓增殖性肿瘤研究及治疗的潜在靶点。Turcot综合征是一种常染色体隐性遗传病,由错配修复(MMR)基因的双等位基因突变引起,其特征是结肠息肉病和中枢神经系统肿瘤。相反,腺瘤性息肉病coli(APC)基因的单等位基因突变会导致家族性腺瘤性息肉病(FAP)和脑肿瘤-息肉综合征,主要表现为髓母细胞瘤(79%),作为FAP的肠外表现。在此背景下,本文报告一例表现为结肠息肉病、结直肠癌、非典型白血病和脑肿瘤的患者,该患者携带CHEK2和JAK2基因的致病性变异以及APC基因的一个意义未明变异(VUS)。
病 例
患者男,35 岁,父母非近亲结婚,有高血压病史,因左髂腹痛就诊于急诊科。计算机断层扫描(CT)显示直肠内有一个 5.6 cm的肿瘤性肿块,位于距肛缘 10 mm处(图1)。此外,结肠镜检查发现约 30 个无蒂、腺瘤性和息肉状病变(图2)。患者接受了息肉切除术,组织学检查证实存在管状和管状绒毛状腺瘤以及浸润性直肠腺癌。肿瘤免疫组化显示错配修复(MMR)蛋白完整,微卫星不稳定性(MSI)分析阴性。聚合酶链反应(PCR)未检测到BRAF V600突变,但检测到KRAS G12V突变。
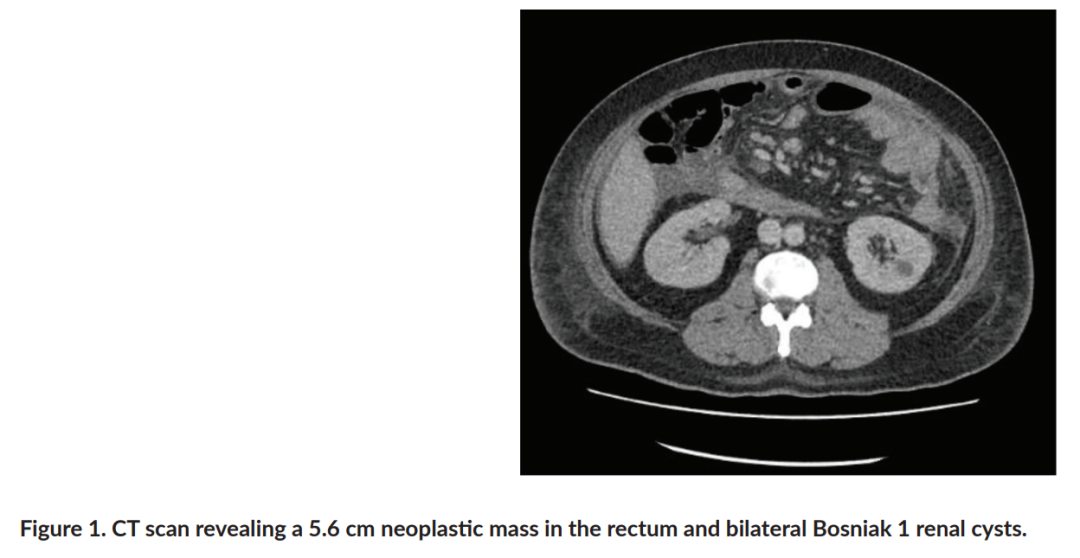
▲图1 CT扫描显示直肠内有一个 5.6 cm的肿瘤肿块和双侧Bosniak 1型肾囊肿
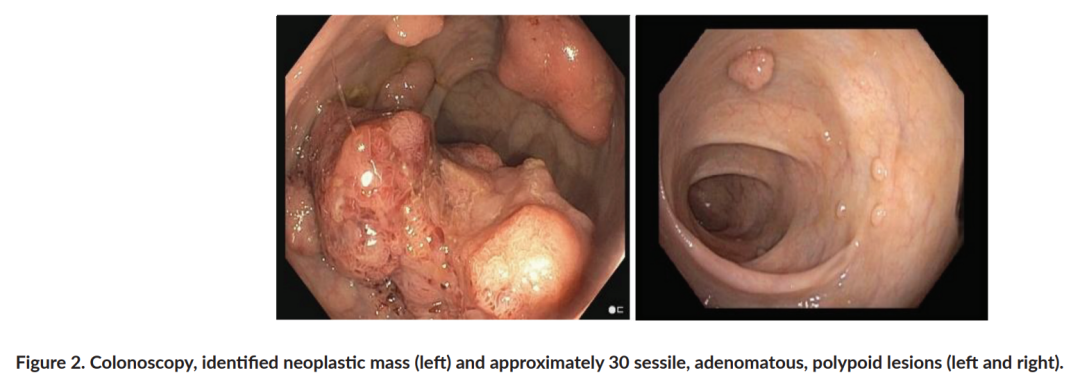
▲图2 结肠镜检查,发现肿瘤肿块(左)和约 30 个无蒂、腺瘤性、息肉样病变(左和右)
此外,腹部磁共振成像(MRI)显示右门静脉和左肾静脉血栓形成的提示性影像、胰尾脂肪瘤、左肾上腺增大、双侧Bosniak 1型肾囊肿、前腹壁表皮结节以及肝门和主动脉前间隙外观可疑的淋巴结。住院期间,患者发生惊厥,脑部MRI显示后颅窝左侧桥小脑角池内有一肿块。该肿块延伸至内听道,并对脑干造成压迫(图3)。由于患者临床状况危急,无法对该肿瘤进行活检,但其临床表现和影像学特征提示为髓母细胞瘤。
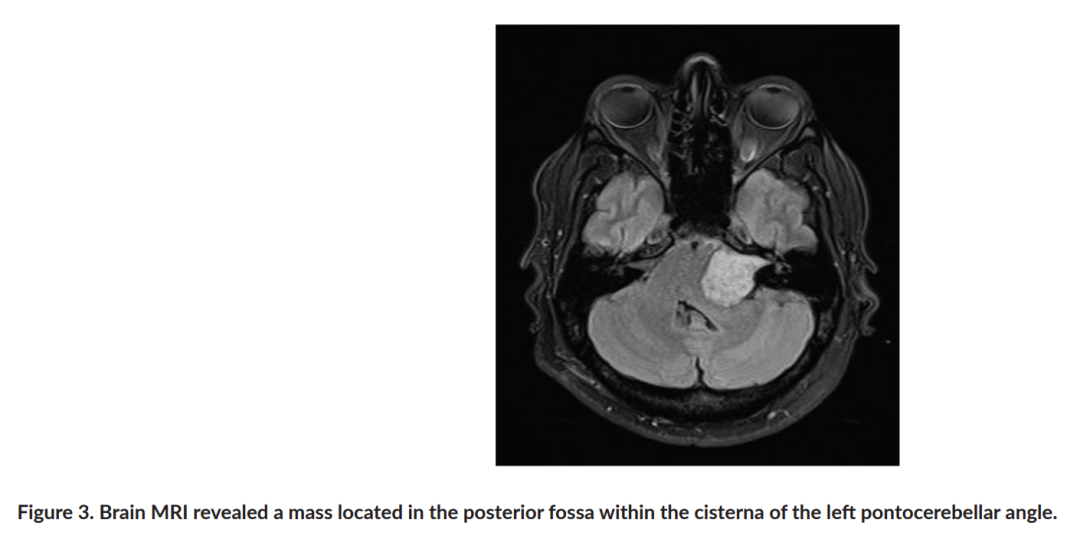
▲图3 脑部MRI显示左脑桥小脑角池内的后颅窝处有一肿块
患者接受了全直肠结肠切除术,术后因多发感染性和出血性并发症在重症监护病房(ICU)延长住院。ICU住院期间,观察到白细胞增多和内脏肿大。随后进行了诊断性检查,包括流式细胞术、骨髓核型分析、BCR/ABL实时聚合酶链反应(PCR)检测以及JAK2 V617F PCR检测。最终诊断为骨髓增生异常综合征/骨髓增殖性肿瘤(myelodysplastic/MPN),具体为费城染色体阴性慢性髓系白血病(CML)。无特殊家族史,除一位 7 岁时诊断为结肠息肉的一级表亲和另一位 34 岁时患子宫癌的一级表亲外,均无近亲结婚史。体格检查发现面部和上胸部有多颗痣,心前区有一块 10×15 cm的色素减退斑。采用下一代测序技术(NGS)进行检测。从外周血样本中提取基因组DNA。未发现MMR变异。检测到CHEK2基因c.1427C>T p.Thr476Met杂合的可能致病性(LP)变异,以及APC基因c.3036T>A p.Asn1012Lys的意义未明变异(VUS)。为研究费城染色体阴性骨髓增殖性肿瘤,对JAK2 V617F突变进行体细胞分析,结果为阳性。患者出现严重并发症,最终在住院期间死亡。
讨 论
本文报告一例成年男性患者,其患有多种肿瘤,包括结肠息肉病、结肠腺癌、双侧肾囊肿、胰腺脂肪瘤、多发腹部结节、中枢神经系统肿块和非典型慢性髓系白血病,分别携带CHEK2和APC基因的两个胚系变异,与遗传性癌症易感性相关。此外,对其骨髓增殖性肿瘤的体细胞分析显示JAK2 V617F突变阳性。
CHEK2胚系变异与肿瘤易感综合征4型、结直肠癌、乳腺癌和前列腺癌相关。CHEK2是编码CHK2激酶的基因,在双链DNA断裂修复过程中起重要作用,因为其在DNA损伤时被激活,可阻止细胞进入有丝分裂。在MRN复合体识别DNA损伤并激活ATM后,CHK2被ATM磷酸化,随后磷酸化p53,导致p53依赖性G1期细胞周期停滞。
本例患者中鉴定出的CHEK2变异位于13号外显子,分类为可能致病性(LP)变异,导致CHEK2蛋白476密码子处的苏氨酸被甲硫氨酸取代,该位点位于蛋白激酶结构域内一个中度保守的残基。已通过基于酵母的体内功能分析评估该变异对DNA损伤修复的影响。Roeb等人将该变异归类为有害变异,而Delimitsou等人观察到中等效应。该特定变异还在多例结直肠癌患者中被发现,以及乳腺癌、前列腺癌、胰腺癌和子宫内膜癌患者中;然而,对该变异的功能测定显示结果不一致。这与CHEK2变异分类的困难相符,该基因被认为是遗传性癌症中解释最具争议的基因之一。具体而言,在结直肠癌中,尚无一致证据表明CHEK2变异显著增加癌症易感性,尽管已发现c.1100delC变异携带者存在低至中度风险,p.I157T携带者存在低风险。
该患者还存在APC基因的一个意义未明变异(VUS)。APC是位于5号染色体长臂的抑癌基因,与结直肠癌的发病机制密切相关。APC基因的遗传改变会导致WNT信号通路激活、细胞增殖和生长失调等。APC胚系变异可导致多种表型,目前均被认为是家族性腺瘤性息肉病(FAP)谱的一部分,包括FAP、衰减型FAP、胃腺癌和胃近端息肉病、gardner综合征、脂肪瘤和纤维瘤等。约半数患者在 15 岁时会出现结直肠腺瘤,几乎所有患者在35岁时都会出现。若不治疗,恶性转化风险极高。肠外表现包括中枢神经系统肿瘤、肝胆胰和肾上腺恶性肿瘤、脂肪瘤及皮肤色素沉着增加。本例患者的APC变异是一种新变异,导致该基因15号外显子发生错义改变,使APC蛋白1012密码子处的天冬酰胺被赖氨酸取代。该变异此前未被描述,在gnomAD样本中不存在,9 种计算机预测工具(Primate AI、LIST-S2、LRT、EVE、MetaLR、DANN、FATHMM-MKL、MutationTaster、CADD)预测其为致病性变异。患者表现出多种肿瘤表现(表1),包括结肠息肉病、结肠腺癌、非典型费城染色体阴性慢性髓系白血病、腹部软组织肿块、中枢神经系统肿瘤、脂肪瘤和皮肤色素沉着增加。所有这些临床表现都可能由APC基因的致病性变异引起。我们认为本病例有助于将该变异临床重新分类为可能致病性(LP)变异。由于无法对未患病的兄弟姐妹/亲属或患病的息肉病表亲进行APC基因变异研究,若该变异存在于息肉病患者中,将支持其重新分类为潜在致病性变异。值得注意的是,患者患有髓母细胞瘤,而APC意义未明变异位于与脑癌(特别是髓母细胞瘤)高风险相关的基因区域。研究人员所在团队已在ClinVar中将此变异报告为与该病例相关的可能致病性变异。另一方面,CHEK2基因变异可能与患者的结直肠癌有关。研究人员推测,CHEK2和APC基因的变异可能解释患者的部分表型,但其在肿瘤发生中的确切作用仍不确定。此外,JAK2突变的存在导致患者出现静脉血栓形成和骨髓增殖性肿瘤的表型。根据最近的报道,这种体细胞突变与胚系变异同时存在与疾病的侵袭性进程相关,本例患者的情况亦是如此。CHEK在癌症易感性中的作用仍是一个有争议,需要进一步研究以确定其在体内癌变的确切参与度。研究人员认为本病例涉及CHEK基因和APC基因两个胚系突变,肿瘤表现与这两个基因相关,尤其是APC基因,且JAK2 V617F突变加重了病情进展。未来研究旨在理解JAK2和CHEK2突变之间相互作用,对于拓展我们对潜在病理生理过程理解以及开发更精确有效的治疗策略至关重要。JAKV617F克隆性造血与不良结局相关,包括更高血液系统癌症风险和总体死亡率;此外,已识别遗传变异可能成为未来克隆性造血和骨髓增殖性肿瘤研究及治疗潜在靶点。
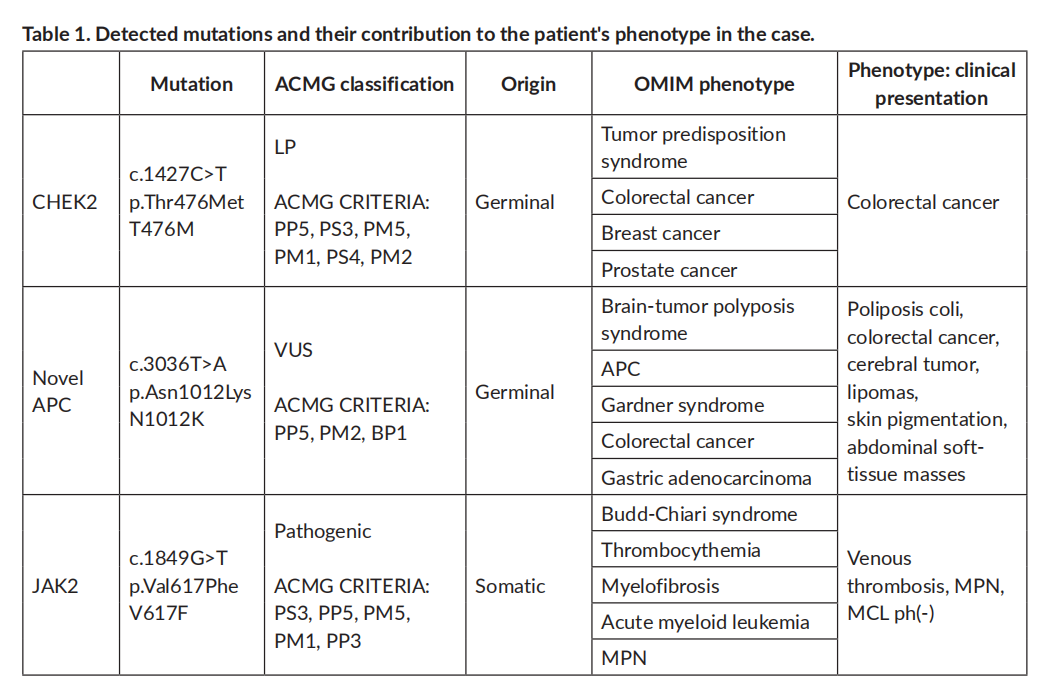
▲表1 病例中检测到的突变及其与患者表型关系
实体瘤1299基因检测、实体瘤272基因检测PLUS、消化系统肿瘤199基因检测、肠癌129基因检测、消化道肿瘤89基因检测项目(NGS方法学),均覆盖了CHEK2基因和APC基因,辅助临床精准诊疗。髓系肿瘤71基因检测(NGS方法学)可检测JAK2基因,辅助分子分型、预后评估和指导用药。
参考文献:
Rojas LXR, Rodriguez JAO, Navarrete SB, Carvajal LV, Silva JJA, Martínez LD, Catanese JAN. Germinal pathogenic CHEK2, novel APC and somatic JAK2V617F variants in a young patient with colorectal cancer, atypical leukemia, cerebral tumour and aggressive course. Ecancermedicalscience. 2025 Jan 23;19:1833. doi: 10.3332/ecancer.2025.1833. PMID: 40177144; PMCID: PMC11959139.


