LVAD学术:心脏移植和人工心脏如何选择?
时间:2025-05-18 12:08:37 热度:37.1℃ 作者:网络
引言
终末期心力衰竭患者预后极差,1年死亡率高达50%。心脏移植作为"金标准"治疗手段虽然效果显著,但手术量有限;而人工心脏(左心室辅助装置,LVAD)技术近年快速发展,为我们提供了新的治疗选择。那么,这两种治疗方法应该如何决策?
终末期心衰的定义
终末期心衰诊断需满足"1+4"条件:首先,患者必须已经接受指南推荐的标准药物治疗(如ARNI/ACEI/ARB、β受体阻滞剂、SGLT2i、MRA等)但仍无效;其次,需符合以下四项临床表现:
-
持续存在严重的NYHA Ⅲ-Ⅳ级心衰症状
-
严重收缩功能减低(LVEF≤30%)
-
一年内≥1次非预期心衰住院
-
严重运动能力丧失(心肺运动试验峰值耗氧量<14 ml·kg^-1·min^-1)
对于这类患者,临床上会使用INTERMACS分级(1-7级)评估病情严重程度,其中1-3级为最重(需静脉正性肌力药物或机械循环支持维持血流动力学稳定),4级为频繁住院,5-7级相对稳定但活动受限。
心脏移植:优势与局限
优势
心脏移植能提供自然生理心脏功能,远期疗效显著。据最新数据,心脏移植患者的1年生存率约85-90%,5年生存率约70%,中位生存期可达12.5年。移植后患者约80%可达到接近正常人群的运动耐量和生活自理水平,生活质量显著提升。

局限性
-
供体短缺:全球每年仅约5,500例心脏移植手术,我国年移植量不到一千例,远不能满足需求。
-
适应证严格:高龄(通常>70岁)、活动性感染、近期恶性肿瘤、严重器官功能不全、固定性肺高压等都是移植禁忌。
-
免疫排斥风险:约15-25%的患者在术后1年内经历至少一次急性排斥,长期还面临慢性排斥(心脏移植物血管病变)风险。
-
终身免疫抑制:带来感染、肿瘤和肾功能损害等并发症风险。
人工心脏(LVAD):优势与局限
优势
-
不受供体限制:可随时使用,无需等待。
-
适应范围更广:可用于部分不适合移植的患者(如高龄、轻中度肺高压等)。
-
疗效显著改善:第三代离心泵(如永仁心、HeartMate 3)的1年生存率已接近90%,5年生存率达58%。
-
决策灵活:可作为"桥接至移植"、"目的地治疗"或"桥接至康复"。
-
有望康复:对非缺血性心肌病患者,心脏有一定概率恢复正常,可撤泵恢复正常生活
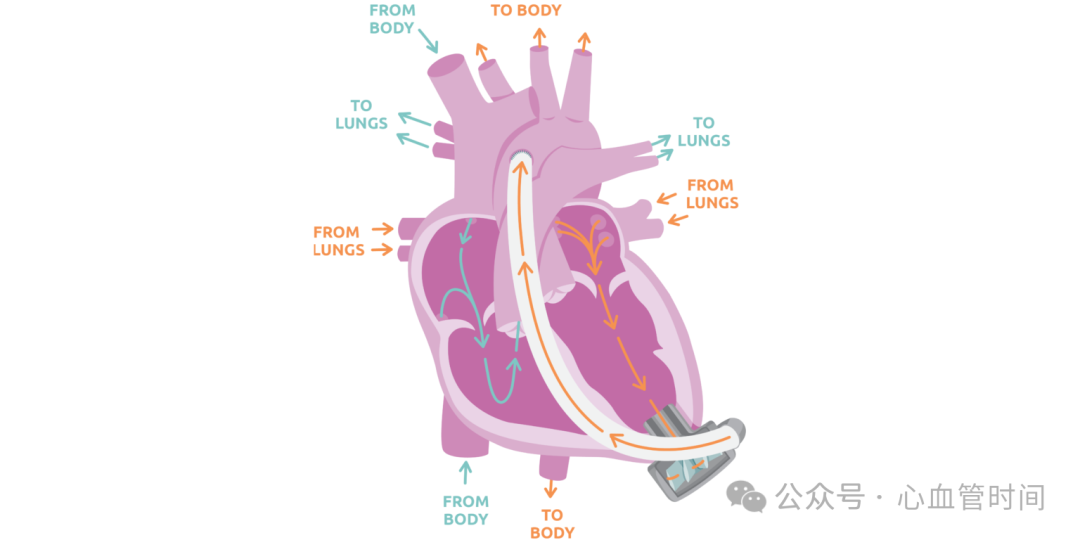
局限性
-
并发症风险:包括驱动线感染(20-30%)、出血(特别是消化道出血)、血栓栓塞、卒中和右心衰竭等。
-
生活便利性受限:需随身携带电池和控制器,不能游泳等接触水活动。
-
费用负担:尽管近年来多地将LVAD纳入医保,但患者自付部分仍有一定压力。
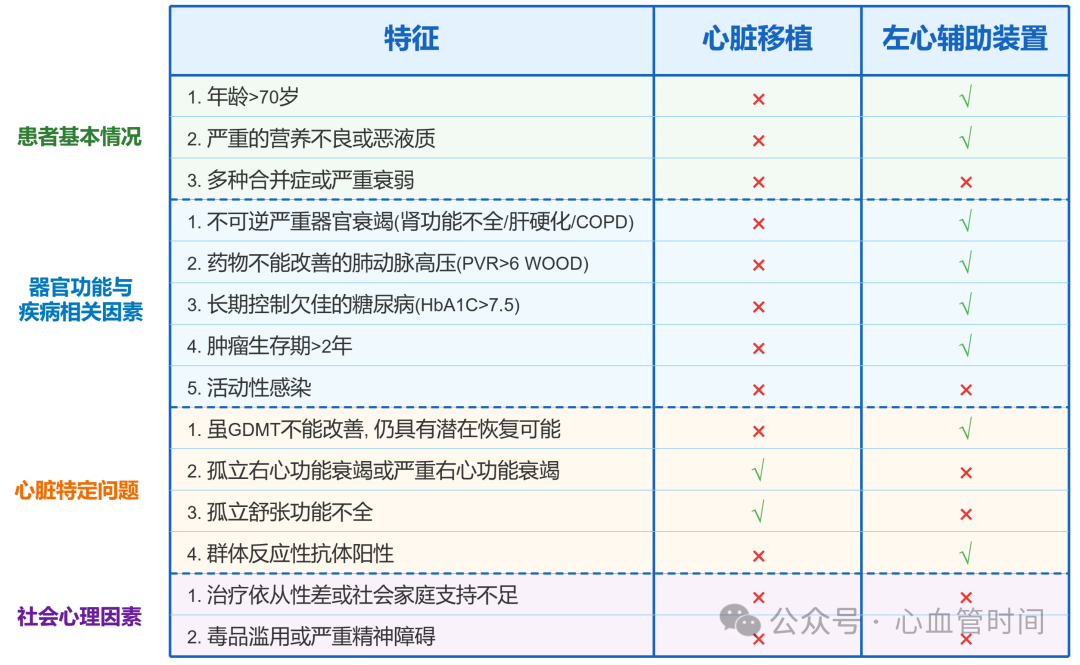
两种治疗方式的比较
生存率
-
短期(1年):移植和LVAD相当(90% vs 88%)
-
中期(5年):移植优于LVAD(70% vs 58%)
💡 笔者提示:应当注意,目前很多VAD患者是评估条件不适合移植后才植入VAD,因此多数VAD患者的基础条件比心脏移植患者差,这也是造成数据差异的原因之一。
生活质量
两种方式均可显著提升生活质量,但方式不同:
-
移植:更接近正常生活,无装置限制,需长期服用抗排异药物
-
LVAD:虽然需要随身携带控制器,但多数患者仍能从NYHA Ⅳ级改善至Ⅰ-Ⅱ级,状态改善明显
如何选择最适合的治疗方式
选择最佳治疗方案需考虑多方面因素:
-
患者年龄:
-
年轻患者(<40岁):考虑LVAD桥接再移植的序贯治疗,最大化总生存时间
-
中年患者(40-65岁):如条件允许优先考虑直接移植
-
高龄患者(>65岁):多考虑LVAD作为长期永久治疗
-
血流动力学状态:
-
INTERMACS 1-3级:需紧急干预,如无立即可用供体,应考虑LVAD
-
INTERMACS 4级:权衡后可考虑任一治疗方式
-
INTERMACS 5-7级:除合并高危因素外,通常不作为手术首选
-
合并症情况:
-
固定性肺高压:避免单纯心脏移植,LVAD可植入降低肺压
-
肾功能不全:肾功能不全患者移植中心通常不会接收,而LVAD则可酌情应用
-
严重糖尿病:不适合移植,移植后免疫抑制药物会促进动脉粥样硬化进展,生存率不佳
-
肿瘤患者:移植后免疫抑制药物有促进肿瘤生长风险,一般不考虑移植,考虑LVAD
-
高凝状态或出血风险高:LVAD风险增加,优先考虑移植
-
特殊情况: 孤立性右心衰竭和单纯舒张功能不全不适合LVAD,这类患者可能更适合考虑心脏移植。
LVAD独特优势
LVAD具有一项独特优势:在特定患者中存在潜在的心肌恢复可能。对于某些可逆性心肌病,如瓣膜性心脏病导致的心衰,LVAD支持一段时间后有可能实现心功能恢复,甚至撤除装置,使患者回归正常生活。
对于年轻患者,心脏移植的预期寿命约为12年,而二次移植风险极高(死亡率达50%-100%)。这意味着30岁的患者直接进行移植,可能在40多岁就面临生命终点。
现代策略倾向于"先LVAD后移植"的序贯治疗模式,即先植入LVAD支持数年,再择期进行心脏移植,从而最大化总生存时间。这种思路也为未来新技术的应用留下了空间,如干细胞治疗等可能在患者LVAD支持期间有突破进展,为后续心衰治疗提供新选择。
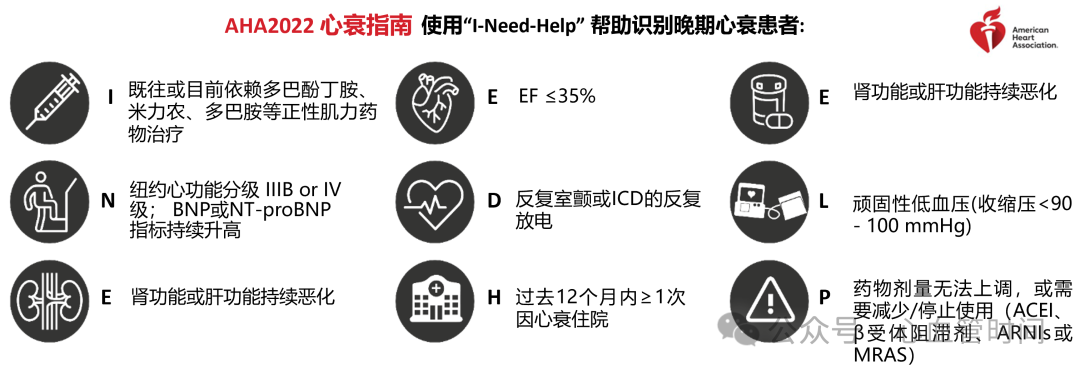
最佳转诊时机
根据临床经验,INTERMACS 3-4级患者是转诊的最佳时机,此时患者病情严重但尚未发展至危及生命的程度,手术风险相对可控。而INTERMACS 1级患者(心源性休克)手术死亡率高达20%,应尽量避免将患者拖至此阶段。
具体来说,以下情况应考虑转诊评估:
-
应用指南推荐药物后心衰症状持续存在
-
一年内多次因心衰住院
-
出现药物不耐受(如血压低不能使用ACEI/ARB/ARNI)
-
心肺运动试验峰值耗氧量<14 ml·kg^-1·min^-1
-
依赖静脉正性肌力药物维持血压
-
肾功能或肝功能逐渐恶化
总结
终末期心衰的治疗选择应结合患者具体情况个体化决策。心脏移植仍是"金标准",但面临供体短缺;LVAD技术快速发展,生存率和生活质量提升已接近心脏移植。
对于年轻患者,"先LVAD后移植"的序贯策略可能是最大化生存时间的理想选择,但需要专业团队管理和患者及家属的全力配合。


