Chin Med:肠道微生物介导皂苷类药物转化的物种差异与个体化变异
时间:2025-08-27 12:12:35 热度:37.1℃ 作者:网络
肠道微生物群被誉为人体的“第二基因组”,其基因数量远超人类自身基因组,且在药物代谢中扮演着至关重要的角色。皂苷类天然产物作为广泛应用于临床的活性成分,其结构复杂,口服生物利用度通常较低,主要依赖肠道微生物通过酶促反应如脱糖苷化转化为更易吸收且具有活性的代谢物。此外,不同物种及个体的肠道菌群组成存在巨大差异,这导致皂苷类药物的生物转化和药效表现具有高度的异质性。尽管已有研究探讨了单一菌株对皂苷的代谢能力,但缺乏系统的跨物种及人群层面的综合比较,尤其是利用混合肠道菌群模型的相关研究尚属空白。

本研究首次系统比较了人源与鼠源混合肠道微生物对五种代表性皂苷类化合物的体外生物转化能力,揭示了两者在代谢产物生成上的显著差异。基于50名健康志愿者的粪便样本,进一步阐明了肠道微生物介导的皂苷代谢存在显著的个体间差异,尤其是在对人参皂苷Rb1的代谢上表现突出。通过16S rRNA基因测序等多组学手段,明确了特定细菌属与代谢活性的相关性,为精准医学中利用肠道菌群调节药物代谢提供了理论依据。
研究人员选取了五种代表性皂苷:人参皂苷Rb1、人参皂苷Re、甘草酸、柴胡皂苷D和皂苷元甾体苷,采用优化的GB培养基在厌氧条件下分别与小鼠及人类来源的混合肠道微生物共培养,利用UPLC-MS/MS技术监测原药物及代谢物水平。此外,基于50位健康志愿者的粪便样本,使用相同培养系统评估三种皂苷(Rb1、甘草酸、柴胡皂苷D)的个体间代谢差异。通过16S rRNA基因测序分析肠道菌群组成及多样性,并结合生物信息学方法预测功能代谢通路。
主要结果
1、物种特异性差异:人源与鼠源肠道微生物对五种皂苷的生物转化表现出显著差异。人源菌群能将人参皂苷Rb1转化为更具生物活性的代谢物人参皂苷CK,甘草酸转化为18β-甘草次酸,以及柴胡皂苷D转化为柴胡皂苷G,鼠源菌群对此类代谢物生成能力较弱或未检测到。
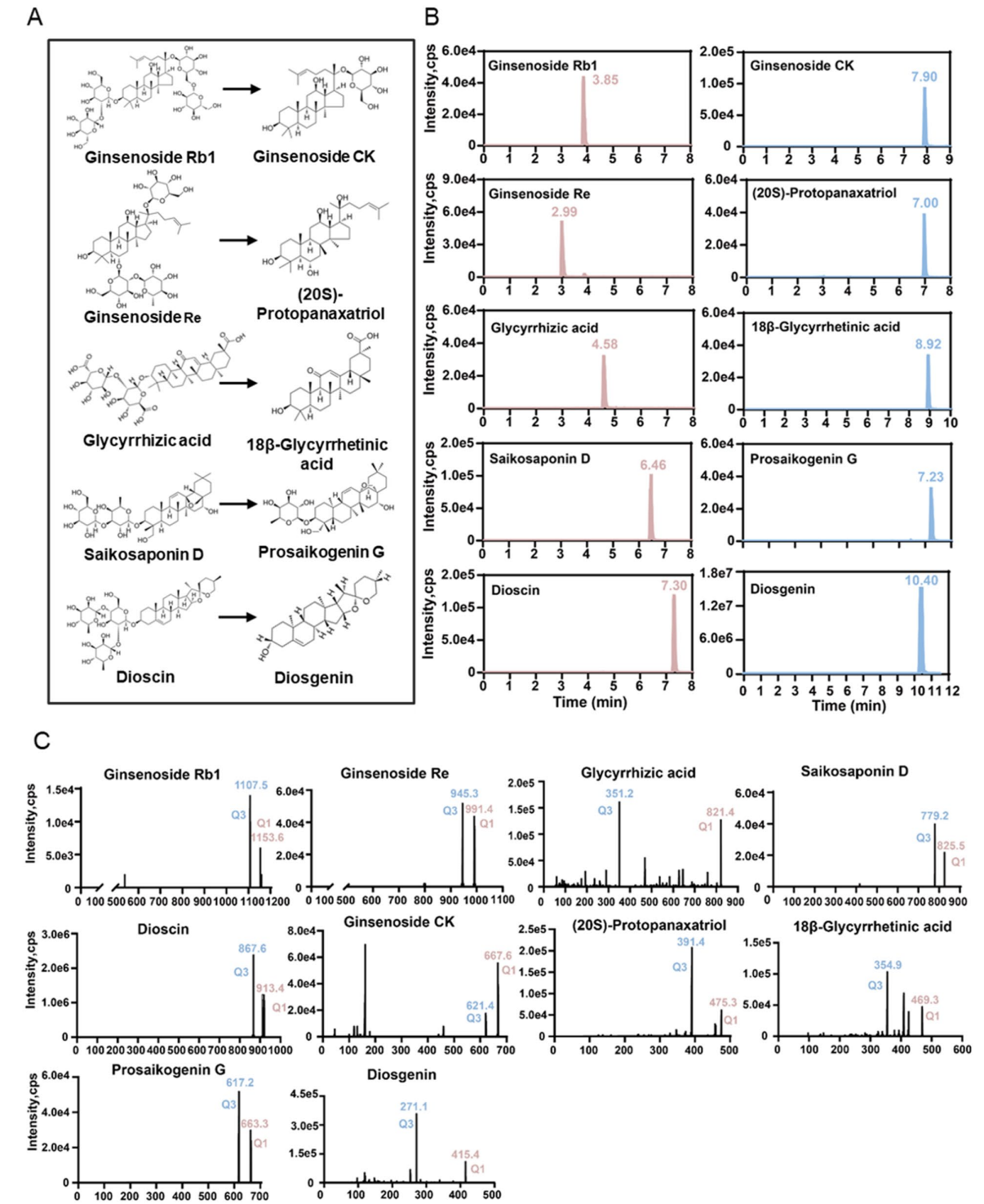
图:五种皂苷成分及其代谢物的UPLC-MS/MS检测方法
2、个体间差异:50名志愿者肠道微生物对三种皂苷的代谢能力差异显著,尤其是人参皂苷Rb1的转化效率呈现明显个体化特征。根据代谢能力将受试者分为高转化组(Top_10)、中间组和低转化组(Bottom_10),两极组间的代谢产物生成量及菌群结构差异显著。
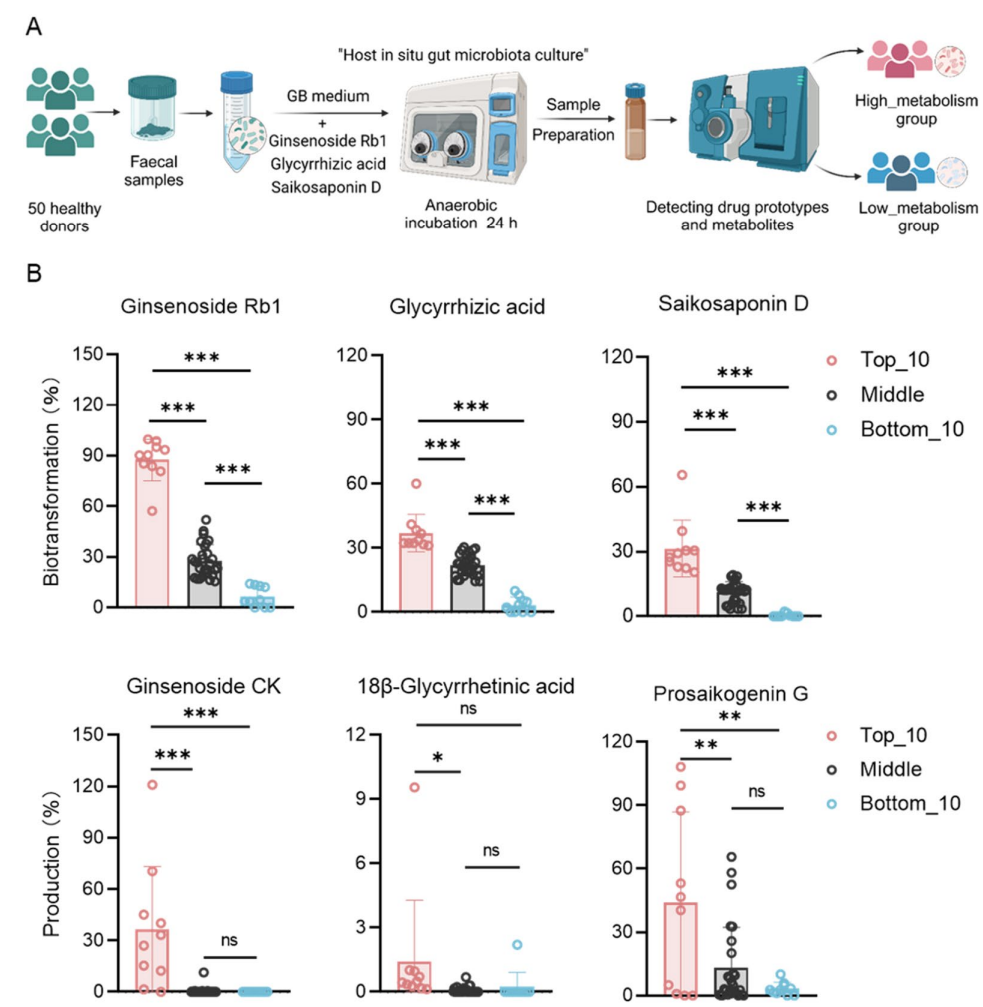
图:体外模拟人肠道微生物群对药物代谢的个体化影响
3、肠道菌群多样性与代谢能力相关:高转化能力组表现出更高的微生物多样性和丰富度,优势菌属包括Eubacterium、Barnesiella、Coprococcus、Bifidobacterium等,与皂苷代谢能力呈正相关。
4、代谢通路预测显示,高代谢组肠道菌群在甾体激素信号通路、IL-17信号通路、某些抗生素生物合成及细胞信号通路等功能上显著富集,提示这些代谢活动可能促进皂苷的生物转化。
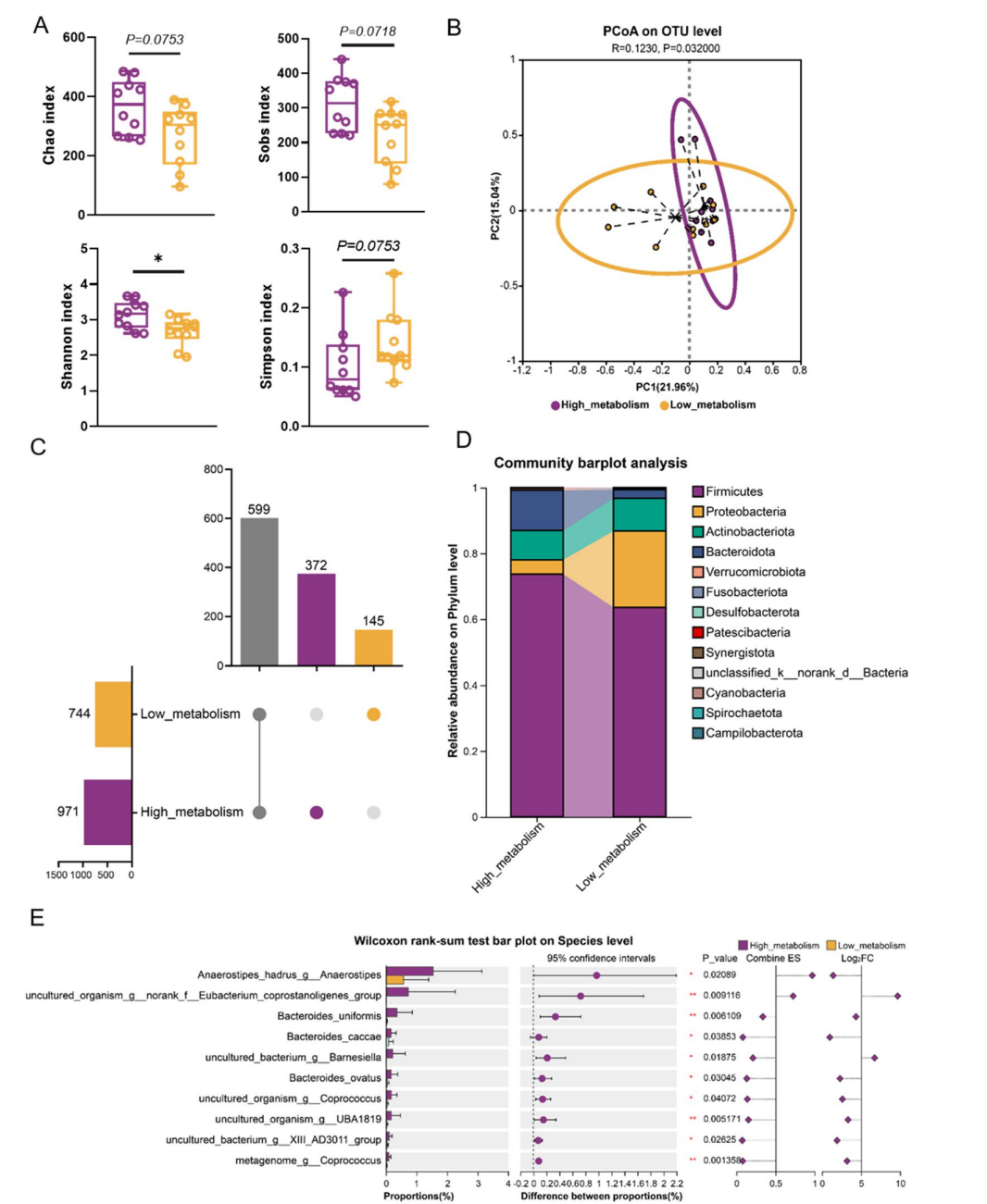
图:基于体外人参皂苷Rb1生物转化差异的人类肠道微生物群分析
5、皂苷对肠道菌群生长无显著影响,排除皂苷本身抑制或促进菌群生长对代谢差异的影响。
综上,本研究系统揭示了肠道微生物介导皂苷类药物生物转化过程中的物种差异和个体化变异现象,明确了人源肠道菌群在皂苷代谢中的关键作用及其与菌群组成和功能的相关性。这不仅为理解皂苷类天然产物的药效发挥机制提供了新视角,也为未来基于肠道微生物的药物代谢调控和精准用药策略奠定了基础。此外,所鉴定的关键菌属和代谢通路为筛选特异性微生物菌株或酶,优化皂苷类药物的临床应用提供了潜在靶点。
原始出处
Wei, W., Li, M., Pan, L. et al. Inter-species and individualized biotransformation of five saponins by human being- and mouse-derived fecal microbiota. Chin Med 20, 132 (2025). https://doi.org/10.1186/s13020-025-01190-2


