【协和医学杂志】肿瘤骨转移精准治疗新进展
时间:2025-08-10 12:08:40 热度:37.1℃ 作者:网络
肿瘤骨转移是指原发性肿瘤细胞通过血液循环或淋巴系统扩散至骨骼的过程,常见于乳腺癌、前列腺癌、肺癌和肾细胞癌等多种恶性肿瘤。骨转移不仅会导致骨痛、病理性骨折和高钙血症等骨相关事件(SRE)的发生,还显著降低了患者的生活质量与预期生存期[1]。因此,探索有效的综合治疗策略对于提高患者的生存率和生活质量至关重要。目前针对肿瘤骨转移的治疗方案主要以全身治疗(如化疗、免疫治疗、靶向治疗)为主,联合骨保护药和镇痛治疗改善患者生活质量,并通过外科手术及放疗对骨转移病灶加强局部治疗,进一步控制骨转移相关症状[2]。
然而,现有治疗仍面临以下诸多挑战:难以实现完全消除转移病灶、药物耐药现象普遍、长期治疗毒副作用显著[3]。因此,深入研究肿瘤骨转移的生物学机制,识别新的治疗靶点和策略,将有助于提高治疗效果。此外,人工智能辅助的影像组学技术在早期诊断和疗效预测方面已展现出重要价值[4]。本文拟系统阐述乳腺癌、前列腺癌、肺癌和肾细胞癌骨转移的精准治疗最新进展,以期通过整合基础研究成果和临床实践经验,为优化临床治疗决策提供参考。
1 放射治疗
1.1 外照射与立体定向放射治疗
外照射放疗(EBRT)作为骨转移相关中重度疼痛的一线治疗方案,已在临床实践中展现出显著的镇痛效果和生存质量改善作用。一项前瞻性研究表明,既往未接受放疗的疼痛性骨转移患者在EBRT治疗后疼痛缓解,生活质量评分显著提升[5]。Shulman等[6]的队列研究进一步证实,对于无症状骨转移患者,预防性EBRT可降低疼痛和SRE的风险,但未改善总生存期(OS)。多数情况下,单次放疗(如8 Gy的单次照射)与多次分次照射(如30 Gy/10次)在疼痛控制上疗效相当,可能是更方便的辅助治疗手段[7]。
目前,EBRT在骨转移的治疗中主要适用于局部病灶的控制。然而,对于广泛性骨转移患者,EBRT存在明显的局限性:首先,其照射范围有限,难以实现对全身多发病灶的有效覆盖;其次,大范围照射可能导致周围正常组织(如骨髓、邻近脏器)的放射性损伤。更重要的是,广泛性骨转移往往提示肿瘤已进入全身播散阶段,单纯依赖局部放疗难以实现疾病的全面控制。现有临床证据表明,此类情况下EBRT的临床获益有限且性价比较低[11]。
近年来,立体定向放射治疗(SBRT),已被证实通过高精度靶向照射,实现增加生物剂量效应并减少对周围健康组织的损害。荟萃分析显示,与传统EBRT相比,接受SBRT的实体瘤骨转移患者对疼痛的完全缓解率更高,这表明SBRT在减轻疼痛方面具有潜在益处[8]。除控制局部症状外,在极少数情况下,SBRT还可产生远隔效应,使照射区域外的肿瘤缩小,为放疗研究开辟了新的途径[9]。
Nguyen等[10]对比了高剂量 SBRT(根据病灶大小,剂量为12~16 Gy)和常规多次分割姑息放疗(30 Gy/10次)在治疗疼痛性非脊柱骨转移患者中的止痛持久性,结果显示,治疗1个月时,SBRT组与常规放疗组的止痛反应(完全或部分)率分别为44%和30%,治疗3个月时分别为40%和21%。接受16 Gy SBRT的患者止痛反应率高达62%,相较于12 Gy SBRT(30%)和 30 Gy/10 次放疗(21%)有显著优势。因此,笔者认为SBRT因其更高的生物效应剂量可显著提升临床疗效。针对体能状态良好、预期生存期较长且转移病灶局限的特定患者群体,推荐优先考虑SBRT作为局部治疗策略。同时,建议开展多中心Ⅲ期临床试验,以进一步验证SBRT在该适应证中的生存获益及安全性。
1.2 FLASH
FLASH放疗采用超高剂量率照射,对正常组织保护效应更显著,初步研究表明其在疼痛缓解和副作用控制方面具有良好的应用前景[12]。FAST-01临床试验首次评估了质子FLASH放疗在肢体骨转移患者中的应用可行性。研究结果显示,该技术不仅具有可靠的安全性,其疼痛缓解效果与常规光子放疗(单次8 Gy)相当,同时显著降低了正常组织的放射毒性[13]。基于这一积极结果,后续开展的FAST-02研究将重点评估FLASH技术在胸壁骨转移姑息治疗中的安全性和有效性,以进一步拓展其临床适应证范围[14]。
然而,FLASH放疗技术的临床应用仍面临若干挑战:首先,该技术对设备及操作要求较高,目前尚处于研究阶段;其次,对于脊柱等邻近关键器官(如脊髓)的骨转移病灶,由于FLASH可能直接照射到敏感神经组织,其安全性尚未得到充分验证,故暂不适合采用该技术治疗。总体而言,FLASH放疗仍处于临床研究阶段,其广泛应用尚需更多循证医学证据支持。
1.3 骨靶向放射性核素治疗
镭-223(223Ra)是一种具有高度骨靶向性的α粒子发射型放射性药物。其作用机制基于其与钙离子的生物相似性,能够选择性浓聚于骨代谢活跃区域,特别是成骨性骨转移病灶。223Ra通过发射高线性能量转移的α粒子,可在局部产生强效的细胞毒性效应,导致肿瘤细胞DNA双链断裂,同时显著减少对周围正常组织的辐射损伤。223Ra半衰期约11.4 d,在体内存留时间短,有助于减少长期辐射影响[15]。ALSYMPCA Ⅲ期临床试验证实,与安慰剂相比,223Ra可显著提高前列腺癌骨转移患者的中位OS,改善患者生活质量,降低骨髓抑制的发生率,并延迟了SRE的发生[16]。
锶-89(89Sr)是骨转移放疗常用的放射性药物,通过模拟钙离子的代谢途径选择性浓聚于成骨活跃的骨转移病灶,其发射的β射线可有效抑制肿瘤生长并缓解疼痛,临床研究证实其安全性良好,罕见3级及以上不良事件[17]。值得注意的是,89Sr具有较长的物理半衰期(50.5 d),体内存留时间较长,能够在较长时间内持续发挥治疗效果。
177Lu-前列腺特异性膜抗原(PSMA)疗法利用177Lu(半衰期6.65 d)标记的PSMA配体,通过抗原-抗体特异性结合实现对转移病灶的精准靶向。临床试验研究证实,对于PSMA阳性的转移性去势抵抗性前列腺癌(mCRPC),177Lu-PSMA-617可显著延长患者中位OS并改善生活质量[18]。基于此,美国食品药品监督管理局(FDA)于2022年3月批准其用于mCRPC治疗,为前列腺癌骨转移患者提供了新的治疗选择。
当前,放疗联合靶向治疗及免疫治疗等新型治疗模式的探索已成为研究热点。临床前研究及早期临床试验显示,这种多模式联合治疗策略可能通过协同作用机制,显著提升抗肿瘤效果并延长患者生存期[19]。
综上,放疗在肿瘤骨转移的治疗中发挥着不可或缺的作用,EBRT治疗骨转移起效迅速,局部病灶控制效果显著,但对于多部位骨转移,治疗周期较长且存在周围正常组织受照风险。骨靶向放射性核素治疗具有靶向性强、可同时治疗多部位骨转移的优点,但存在骨髓抑制风险和对骨转移灶周围软组织肿瘤细胞的杀伤力较弱。建议临床治疗方案的制定应遵循个体化原则,通过精准的靶区勾画和剂量优化,实现治疗效果的最大化。同时,应充分考虑患者的具体情况进行动态调整,以期获得最佳临床获益。
2 免疫治疗
免疫检查点抑制剂(ICIs)通过阻断PD-1/PD-L1或CTLA-4信号通路,恢复T细胞抗肿瘤活性,已成为多种实体瘤的重要治疗手段[20]。然而,骨转移病灶对ICIs的治疗反应呈现显著异质性。研究表明,非小细胞肺癌(NSCLC)、肾细胞癌、前列腺癌和黑色素瘤等骨转移患者接受ICIs治疗后,客观缓解率(ORR)较非骨转移患者降低,这可能与肿瘤异质性和骨转移微环境中存在免疫抑制相关[3]。而接受免疫治疗的骨转移患者在生存率和生活质量方面均有显著提升[21]。
2.1 NSCLC
Qiang等[22]对110例骨转移的NSCLC患者开展的回顾性研究表明,与接受二线治疗或更高治疗的患者相比,接受一线帕博利珠单抗(Pembrolizumab)治疗的患者具有更高的ORR、更长的无进展生存期(PFS)和OS。该结果支持发生骨转移的晚期 NSCLC 患者尽早接受免疫治疗。ICIs与地舒单抗联用治疗骨转移患者则表现出协同作用,能在不增加副作用的同时提高生存期[23]。此外,姑息性放疗介导的免疫调节可能增强ICIs的疗效,减轻骨转移症状并提高患者生存期[24]。一项回顾性研究表明,ICIs还可与抗血管生成剂联合使用,改善骨转移患者的 PFS,并降低 SRE发生率[25]。
2.2 乳腺癌
与单独化疗相比,ICIs与化疗联合治疗晚期和转移性三阴性乳腺癌(TNBC)患者,其PFS有所提高[26]。阿替利珠单抗(Atezolizumab)联合紫杉醇延长了PD-L1阳性亚组中转移性TNBC患者的PFS,且不良反应可控[27]。与安慰剂相比,帕博利珠单抗联合化疗治疗转移性TNBC患者,其PFS显著改善[28],且骨转移的出现对ICIs治疗组无明显负面影响,说明ICIs在乳腺癌骨转移患者中有较高的治疗潜力。
2.3 前列腺癌
ICIs可能会增强化疗对前列腺癌的治疗效果。一项针对已接受雄激素剥夺治疗(ADT)的初治mCRPC骨转移患者的Ⅱ期临床试验表明,纳武利尤单抗(Nivolumab)联合多西他赛治疗的ORR为 36.8%, 前列腺特异性抗原(PSA)缓解率为 46.3%[29]。另外一项Ⅱ期CheckMate 650临床试验表明,伊匹木单抗(Ipilimumab)与纳武利尤单抗联合治疗既往接受多西他赛治疗的mCRPC(78/90 骨转移)患者,其肿瘤大小和PSA缓解率均有所降低,提示双重ICIs治疗也许能进一步提高前列腺癌骨转移的疗效。
尽管ICIs在肿瘤骨转移治疗中取得了一定进展,但实际治疗效果个体差异较大,部分患者可能出现免疫相关不良反应,这要求临床医生在应用免疫治疗时需进行个体化评估和监测[30]。此外,接受ICIs治疗的患者可能出现骨质流失并增加骨折风险,这与骨转移的存在无关,表明ICIs治疗对骨骼健康具有负面影响[31]。目前ICIs治疗肿瘤骨转移的临床研究多局限于小样本回顾性队列研究,且细胞治疗等新型免疫疗法研究不足,有待进一步验证。尽管免疫治疗在肿瘤骨转移的应用前景广阔,但仍需进一步研究以优化联合治疗策略并提高患者获益。
3 骨改良药物
骨改良药物又称“破骨细胞抑制剂”,在减少肿瘤骨转移患者SRE的发生以及延缓其发作方面的疗效已得到广泛研究证实[32]。未来随着骨转移患者的生存期进一步延长,骨改良药物的长期应用在维持带瘤生存患者骨骼健康与生活质量中具有重要的临床意义,然而在制定治疗方案时,需综合考虑其疗效与潜在风险,以实现最佳治疗效果。
3.1 双膦酸盐
双膦酸盐作为焦磷酸盐分子的稳定类似物,可以选择性结合骨矿化基质,抑制破骨细胞介导的骨吸收,进而改善骨质量。双膦酸盐类药物是肿瘤骨转移患者最常用的药物之一,而第三代双膦酸盐唑来膦酸(ZA)一直是首选标准药物,该药物的使用可减少溶骨性骨转移疾病如多发性骨髓瘤或晚期癌症(乳腺癌、肺癌等)SRE发生率并改善生存结局[33-34]。而针对成骨性骨转移疾病如前列腺癌骨转移等,ZA虽然能减少SRE发生,但对OS改善作用不明显[35-38],目前尚无充足证据推荐前列腺癌治疗常规使用骨改良药物[39],前列腺癌治疗中骨保护药的价值有待进一步研究。
双膦酸盐的不良反应主要包括颌骨坏死、肾毒性和低钙血症,用药期间应密切监测,及时发现并尽早积极治疗[40]。一项针对359例接受双膦酸盐治疗的骨转移肺癌患者的回顾性研究表明,长期治疗(>24个月)可能会增加SRE的发生风险。然而,与接受≤24个月治疗的患者相比,继续治疗>24个月的患者无SRE发生,但需密切监测潜在的不良反应[41]。
一项针对早期癌症患者预防性使用骨保护药的研究表明,早期乳腺癌患者每6个月输注1次ZA与单次给药辅助治疗在生活质量评分、无复发生存期、无骨转移生存期、OS方面没有显著差异[42],而在急性期反应发生率方面,单次输注组为77.6%,6个月组为84.6%。因此延长骨改良药物的给药间隔可能避免不良事件的发生风险。
3.2 核因子-κB受体活化因子配体抑制剂
地舒单抗(Denosumab)为代表的核因子-κB受体活化因子配体(RANKL)抑制剂通过阻断核因子-κB受体活化因子(RANK)-RANKL信号通路,精准抑制破骨细胞活化,临床优势显著。荟萃分析显示,在7441例晚期实体瘤和多发性骨髓瘤骨转移患者(尤其是乳腺癌患者)中,地舒单抗在减少SRE、延迟SRE时间、减少病理性骨折方面显示出优势[43]。此外,地舒单抗还与较少的肾毒性和急性期反应有关,但增加了低钙血症和颌骨坏死的风险[33]。研究显示,与ZA相比,地舒单抗与CDK4/6抑制剂联合治疗乳腺癌骨转移患者的首次SRE发生时间延迟且SRE发生率更低[44]。
LY01011是我国研发的全球首个上市的地舒单抗生物类似药,其药代动力学、药效学、安全性、耐受性和免疫原性与地舒单抗有相似特征[45]。在一项纳入850例实体瘤骨转移患者的多中心、随机、双盲Ⅲ期临床试验中,LY01011与地舒单抗的疗效和安全性相当,且治疗13周后更换治疗药物不会影响两组的疗效、安全性或免疫原性特征。
纳鲁索拜单抗是一种新型全人源化单克隆抗RANKL抗体,在针对乳腺癌、肺癌、胃癌等实体瘤骨转移患者Ⅰ期临床试验中耐受性良好且安全性可控[46]。另一项主要纳入乳腺癌和前列腺癌的Ⅰb期临床试验证明,纳鲁索拜单抗在抑制破骨细胞标志物和缓解疼痛方面具有出色疗效[47]。受限于较短研究周期,纳鲁索拜单抗在预防SRE的疗效方面有待进一步评估。在骨巨细胞瘤多中心Ⅰb/Ⅱ期临床试验中,纳鲁索拜单抗ORR高达93.3%,对疼痛缓解和骨吸收有稳定和持续的影响,且安全性可控[48]。
目前两类骨改良药物对骨转移患者的OS及疾病进展的影响相当,其中地舒单抗类RANKL 抑制剂在控制SRE与延缓疼痛方面更具临床优势,需注意的是,骨改良药物的使用全程均需密切监测相关不良反应的发生。
4 小分子靶向治疗
靶向药物旨在通过针对特定的分子靶点来抑制肿瘤细胞的生长和转移。目前靶向肿瘤的小分子药物在肿瘤骨转移临床治疗方面展现出一定的优势,同时随着对骨转移微环境的细胞间相互作用的进一步研究,许多靶向骨转移微环境的药物在临床前试验中取得了一定进展。
4.1 酪氨酸激酶抑制剂
奥希替尼是第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),已作为单药治疗用于晚期EGFR突变阳性NSCLC患者。文献报道3例晚期 EGFR突变肺腺癌骨转移患者在接受奥希替尼治疗后PFS相对较长(12~22.7个月)[49]。一项多中心回顾性研究表明,接受TKI治疗的NSCLC患者中位OS为28个月(95% CI: 24.1~31.8),且长期治疗发生SRE的风险较高,建议早期联合应用骨改良药[50]。安罗替尼是一种新型多靶点酪氨酸激酶抑制剂,与ICIs联用可以提升ICIs单药治疗效果,明显改善NSCLC骨转移患者预后[51]。
TKI联合ICIs疗法从根本上改变了转移性肾细胞癌的治疗前景,美国临床肿瘤学会(ASCO)指南对于伴有骨转移的转移性肾细胞癌患者推荐卡博替尼(Cabozantinib)联合ICIs进行全身治疗,同时应用骨改良药预防SRE并对有症状的骨转移患者进行骨定向放疗[52]。
4.2 PARP抑制剂
多聚腺苷二磷酸核糖聚合酶抑制剂(PARPi)通过抑制同源重组修复(HRR)基因突变导致DNA双链修复缺陷的肿瘤细胞内DNA单链修复过程,促进不可修复的DNA损伤积累进而导致肿瘤细胞凋亡,目前已在转移性患者中应用。EMBRACA临床试验表明,与化疗相比,单药他拉唑帕尼(Talazoparib)治疗局部晚期或转移性BRCA1/2突变乳腺癌患者的PFS显著改善[53]。约25%以上mCRPC患者肿瘤细胞中存在HRR突变,一项纳入377例HRR突变的转移性mCRPC患者Ⅲ期临床试验表明,相比于激素疗法,奥拉帕尼(Olaparib)的PFS较长,缓解指标和患者报告的终点较好[54]。荟萃分析提示进一步联合PARPi和雄激素受体信号抑制剂(ARSI)可进一步提升mCRPC治疗效果[55]。
4.3 骨微环境靶向药物
唾液酸结合性免疫球蛋白样凝集素(Siglec)-15/唾液酸糖-免疫检查点轴在骨转移微环境中具有多重作用,乳腺癌骨转移灶中Siglec-15水平的升高可以促进肿瘤诱导的破骨细胞生成,并抑制抗原特异性T细胞反应。临床前研究证实,靶向Siglec-15的抗体不仅可以治疗乳腺癌骨转移,还可抑制转移性肿瘤细胞从骨病变向其他器官的扩散[56]。
调节昼夜节律的褪黑素已被发现具有抗肿瘤特性,在骨内注射前列腺癌转移模型中,褪黑素能够控制前列腺癌肿瘤细胞的生长,抑制体内内皮素-1(ET-1)的产生和成骨细胞分化。骨转移前列腺癌患者血清ET-1水平明显高于非骨转移患者,褪黑素可能是治疗成骨型前列腺癌骨转移的新方法[57]。
当前小分子靶向治疗的效果还受肿瘤类型、分子特征及其对靶向药物的敏感性等多种因素的影响[58]。靶向治疗并非对所有患者均有效,患者的基因组特征和肿瘤微环境差异可能导致靶向药物的疗效不同。因此,个体化治疗策略的制定至关重要,结合基因组测序和生物标志物检测,可以帮助医生更好地选择合适的靶向药物,提高治疗效果。
5 小结与展望
近年来,肿瘤骨转移治疗领域已实现从单一姑息治疗向多模态精准治疗的革命性转变,放疗、免疫治疗、骨改良药物和靶向药物等多种治疗策略的相互结合(图1),体现了医学界对肿瘤骨转移复杂性和异质性的深刻认识,标志着治疗策略正朝着个体化和精准化方向发展。
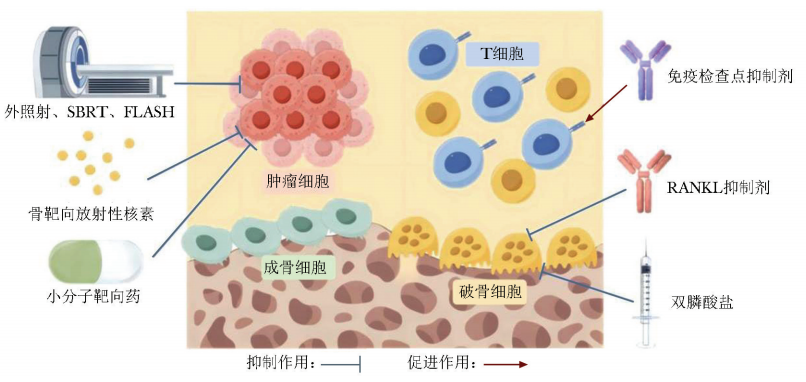
图1 肿瘤骨转移治疗方案示意图
SBRT:立体定向放射治疗;RANKL:核因子-κB受体活化因子配体
肿瘤细胞在骨微环境中的生存机制为靶向治疗提供了新的切入点,使得研究者能够开发出针对特定分子标志物的靶向药物,从而提高治疗的特异性和有效性。此外,通过激活机体的免疫系统,免疫治疗能够有效抑制肿瘤细胞的生长和转移,然而其在骨转移患者中的应用仍然需谨慎评估,特别是在疗效和副作用的权衡上。
在多种治疗方案的结合应用中,如何进行疗效评估显得尤为重要。现有的评估标准往往侧重于肿瘤的缩小程度,而忽视了患者生活质量的改善。未来研究应更加注重患者的主观感受和生活质量的提升,结合生存期、疼痛控制等多维度指标,全面评估治疗效果。此外,随着纳米技术的应用,未来有望开发出更为精准的药物递送系统,以提高药物的生物利用度和靶向性,减少对正常组织的损伤。
然而,在推动肿瘤骨转移治疗方案发展的过程中,也必须面对不同研究结果之间的差异与争议。不同研究在设计、样本选择、疗效评估标准等方面可能存在不一致,这就要求我们在解读研究结果时,保持谨慎的态度。通过系统的荟萃分析和大规模临床试验,能够更好地平衡不同观点,形成更为可靠的治疗依据。
总之,肿瘤骨转移的治疗方案正在经历快速演变,未来的研究应继续聚焦于个体化治疗的探索、疗效的综合评估以及新技术的应用。随着对肿瘤骨转移机制的进一步理解,相信上述治疗策略能够提高治疗效果并显著改善患者的生活质量。此外,未来应该以患者为中心,关注其整体健康状况和生活质量,从而为肿瘤骨转移的治疗提供更有效的解决方案。
参考文献
[1]Coleman R E, Croucher P I, Padhani A R, et al. Bone metastases[J]. Nat Rev Dis Primers, 2020, 6(1): 83.
[2]支修益, 王洁, 刘伦旭, 等. 中国肺癌骨转移临床诊疗指南(2024版)[J]. 中国胸心血管外科临床杂志, 2024, 31(5): 643-653.
[3]Liu C, Wang M, Xu C L, et al. Immune checkpoint inhibitor therapy for bone metastases: specific microenvironment and current situation[J]. J Immunol Res, 2021, 2021: 8970173.
[4]Dong X Y, Chen G L, Zhu Y P, et al. Artificial intelligence in skeletal metastasis imaging[J]. Comput Struct Biotechnol J, 2024, 23: 157-164.
[5]Faris A, Expósito J, Martínez-única A, et al. The efficacy of three-dimensional conformal radiation therapy on pain and quality of life in patients with painful bone metastases: a prospective study[J]. Croat Med J, 2020, 61(3): 215-222.
[6]Shulman R M, Meyer J E, Li T Y, et al. External beam radiation therapy (EBRT) for asymptomatic bone metastases in patients with solid tumors reduces the risk of skeletal-related events (SREs)[J]. Ann Palliat Med, 2019, 8(2): 159-167.
[7]Tseng Y D. Radiation therapy for painful bone metastases: fractionation, recalcification, and symptom control[J]. Semin Radiat Oncol, 2023, 33(2): 139-147.
[8]Bindels B J J, Mercier C, Gal R, et al. Stereotactic body and conventional radiotherapy for painful bone metastases: a systematic review and meta-analysis[J]. JAMA Netw Open, 2024, 7(2): e2355409.
[9]Ashrafizadeh M, Farhood B, Eleojo Musa A, et al. Abscopal effect in radioimmunotherapy[J]. Int Immunopharmacol, 2020, 85: 106663.
[10]Nguyen Q N, Chun S G, Chow E, et al. Single-fraction stereotactic vs conventional multifraction radiotherapy for pain relief in patients with predominantly nonspine bone metastases: a randomized phase 2 trial[J]. JAMA Oncol, 2019, 5(6): 872-878.
[11]Grosinger A J, Alcorn S R. An update on the management of bone metastases[J]. Curr Oncol Rep, 2024, 26(4): 400-408.
[12]Nishioka K, Takahashi S, Mori T, et al. The need of radiotherapy optimization for glioblastomas considering immune responses[J]. Jpn J Radiol, 2023, 41(10): 1062-1071.
[13]Mascia A E, Daugherty E C, Zhang Y B, et al. Proton FLASH radiotherapy for the treatment of symptomatic bone metastases: the FAST-01 nonrandomized trial[J]. JAMA Oncol, 2023, 9(1): 62-69.
[14]Daugherty E C, Zhang Y, Xiao Z, et al. FLASH radiotherapy for the treatment of symptomatic bone metastases in the thorax (FAST-02): protocol for a prospective study of a novel radiotherapy approach[J]. Radiat Oncol, 2024, 19(1): 34.
[15]Suominen M I, Fagerlund K M, Rissanen J P, et al. Radium-223 inhibits osseous prostate cancer growth by dual targeting of cancer cells and bone microenvironment in mouse models[J]. Clin Cancer Res, 2017, 23(15): 4335-4346.
[16]Parker C, Nilsson S, Heinrich D, et al. Alpha emitter radium-223 and survival in metastatic prostate cancer[J]. N Engl J Med, 2013, 369(3): 213-223.
[17]Saito A I, Inoue T, Kinoshita M, et al. Strontium-89 chloride delivery for painful bone metastases in patients with a history of prior irradiation[J]. Ir J Med Sci, 2023, 192(2): 569-574.
[18]Konopnicki A, Zaliznyak M, Roy M, et al. The therapeutic use of 177 Lu-PSMA-617 radioligand therapy in prostate cancer treatment: a review of literature and ongoing trials[J]. Horm Cancer, 2024, 15(1): 791.
[19]Gueiderikh A, Faivre J C, Golfier C, et al. Efficacy of innovative systemic treatments in combination with radiotherapy for bone metastases: a GEMO (the European Study Group of Bone Metastases) state of the art[J]. Cancer Metastasis Rev, 2025, 44(1): 28.
[20]Alsaafeen B H, Ali B R, Elkord E. Resistance mechanisms to immune checkpoint inhibitors: updated insights[J]. Mol Cancer, 2025, 24(1): 20.
[21]Li G Y, Bao J G, Sun D D, et al. Bone marrow metastasis from testicular seminoma coexisting with treatment-associated acute myeloid leukemia[J]. Clin Lab, 2022, 68(2).
[22]Qiang H P, Lei Y Q, Shen Y C, et al. Pembrolizumab monotherapy or combination therapy for bone metastases in advanced non-small cell lung cancer: a real-world retrospective study[J]. Transl Lung Cancer Res, 2022, 11(1): 87-99.
[23]Li H S, Lei S Y, Li J L, et al. Efficacy and safety of concomitant immunotherapy and denosumab in patients with advanced non-small cell lung cancer carrying bone metastases: a retrospective chart review[J]. Front Immunol, 2022, 13: 908436.
[24]Zhao X R, Shao C L. Radiotherapy-mediated immunomodulation and anti-tumor abscopal effect combining immune checkpoint blockade[J]. Cancers (Basel), 2020, 12(10): 2762.
[25]Xie X H, Zhou M L, Wang L Q, et al. Effects of combining immune checkpoint inhibitors and anti-angiogenic agents on bone metastasis in non-small cell lung cancer patients[J]. Hum Vaccin Immunother, 2023, 19(2): 2241310.
[26]Lin S F, Fu B H, Khan M. Identifying subgroups deriving the most benefit from PD-1 checkpoint inhibition plus chemotherapy in advanced metastatic triple-negative breast cancer: a systematic review and meta-analysis[J]. World J Surg Oncol, 2024, 22(1): 346.
[27]Schmid P, Adams S, Rugo H S, et al. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer[J]. N Engl J Med, 2018, 379(22): 2108-2121.
[28]Cortes J, Cescon D W, Rugo H S, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial[J]. Lancet, 2020, 396(10265): 1817-1828.
[29]Fizazi K, González Mella P, Castellano D, et al. Nivolumab plus docetaxel in patients with chemotherapy-nave metastatic castration-resistant prostate cancer: results from the phase II CheckMate 9KD trial[J]. Eur J Cancer, 2022, 160: 61-71.
[30]Li J, Liu L S, Li J P, et al. Ectopic pleural thymoma with T-cell lymphocytosis and bone metastasis: a case report[J]. BMC Pulm Med, 2024, 24(1): 280.
[31]Joseph G J, Johnson D B, Johnson R W. Immune checkpoint inhibitors in bone metastasis: clinical challenges, toxicities, and mechanisms[J]. J Bone Oncol, 2023, 43: 100505.
[32]Tamiya H, Nishino K, Kato Y, et al. Impact of bone-modifying agents on post-bone metastasis survival across cancer types[J]. Curr Oncol, 2025, 32(1): 42.
[33]Wajda B G, Ferrie L E, Abbott A G, et al. Denosumab vs. zoledronic acid for metastatic bone disease: a comprehensive systematic review and meta-analysis of randomized controlled trials[J]. Cancers (Basel), 2025, 17(3): 388.
[34]Hu Z G, Tian Y F, Li W X, et al. The efficacy and safety of zoledronic acid and strontium-89 in treating non-small cell lung cancer: a systematic review and meta-analysis of randomized controlled trials[J]. Support Care Cancer, 2020, 28(7): 3291-3301.
[35]Fukuokaya W, Mori K, Urabe F, et al. Bone-modifying agents in patients with high-risk metastatic castration-sensitive prostate cancer treated with abiraterone acetate[J]. JAMA Netw Open, 2024, 7(3): e242467.
[36]Kamba T, Kamoto T, Maruo S, et al. A phase III multicenter, randomized, controlled study of combined androgen blockade with versus without zoledronic acid in prostate cancer patients with metastatic bone disease: results of the ZAPCA trial[J]. Int J Clin Oncol, 2017, 22(1): 166-173.
[37]Denham J W, Joseph D, Lamb D S, et al. Short-term androgen suppression and radiotherapy versus intermediate-term androgen suppression and radiotherapy, with or without zoledronic acid, in men with locally advanced prostate cancer (TROG 03.04 RADAR): 10-year results from a randomised, phase 3, factorial trial[J]. Lancet Oncol, 2019, 20(2): 267-281.
[38]James N D, Pirrie S J, Pope A M, et al. Clinical outcomes and survival following treatment of metastatic Castrate-Refractory prostate cancer with docetaxel alone or with strontium-89, zoledronic acid, or both: the TRAPEZE randomized clinical trial[J]. JAMA Oncol, 2016, 2(4): 493-499.
[39]Damaj N, Najdi T, Seif S, et al. Zoledronic acid in metastatic castrate-sensitive prostate cancer: a state-of-the-art review[J]. J Bone Oncol, 2025, 51: 100667.
[40]Billington E, Aghajafari F, Skulsky E, et al. Bisphos-phonates[J]. BMJ, 2024, 386: e076898.
[41]Wei Z X, Pan B, Jia D X, et al. Long-term safety and efficacy of bisphosphonate therapy in advanced lung cancer with bone metastasis[J]. Future Oncol, 2022, 18(18): 2257-2267.
[42]Zhao M C, Hu X C, Zhuang P P, et al. A multicenter, randomized, double-blind trial comparing LY01011, a biosimilar, with denosumab (Xgeva) in patients with bone metastasis from solid tumors[J]. J Bone Oncol, 2025, 51: 100661.
[43]Maestri M, Cicerone O, Messina A, et al. Pink-on-pink: hepatocellular carcinoma metastatic to oncocytic carcinoma of the thyroid[J]. Pathologica, 2024, 116(3): 158-162.
[44]Öner i, Anik H, Kurt nci B, et al. A comparison of the efficacy and safety of denosumab and zoledronic acid in patients with bone metastatic breast cancer receiving CDK4/6 inhibitor therapy[J]. Medicina (Kaunas), 2025, 61(2): 360.
[45]Ding Y H, Liu Y S, Dou C L, et al. A randomized trial comparing LY01011, biosimilar candidate, with the reference product denosumab (Xgeva®) in healthy Chinese subjects[J]. J Bone Oncol, 2023, 42: 100499.
[46]Liang X, Xue J L, Ge X X, et al. Safety, tolerability, and pharmacokinetics/pharmacodynamics of JMT103 in patients with bone metastases from solid tumors[J]. Front Oncol, 2022, 12: 971594.
[47]Ran R, Li H T, Sun T, et al. Efficacy and safety of JMT103 in patients with bone metastases from solid tumors: a randomized Phase Ib clinical trial[J]. Int J Cancer, 2025, 156(11): 2178-2187.
[48]Xu H R, Zhou Y, Liang L, et al. Efficacy and safety of JMT103 in patients with unresectable or surgically-challenging giant cell tumor of bone: a multicenter, phase Ib/II study[J]. Nat Commun, 2024, 15(1): 9541.
[49]Guo Q, Feng W Q, Hu S, et al. Efficacy of 3rd generation TKI in patients with EGFR mutation lung adenocarcinoma with bone metastases: a review of 3 case reports and literature[J]. Medicine (Baltimore), 2023, 102(34): e34545.
[50]Laganà M, Gurizzan C, Roca E, et al. High prevalence and early occurrence of skeletal complications in EGFR mutated NSCLC patients with bone metastases[J]. Front Oncol, 2020, 10: 588862.
[51]Shi Y, Ji M, Jiang Y Y, et al. A cohort study of the efficacy and safety of immune checkpoint inhibitors plus anlotinib versus immune checkpoint inhibitors alone as the treatment of advanced non-small cell lung cancer in the real world[J]. Transl Lung Cancer Res, 2022, 11(6): 1051-1068.
[52]Rathmell W K, Rumble R B, Van Veldhuizen P J, et al. Management of metastatic clear cell renal cell carcinoma: ASCO guideline[J]. J Clin Oncol, 2022, 40(25): 2957-2995.
[53]Litton J K, Rugo H S, Ettl J, et al. Talazoparib in patients with advanced breast cancer and a germline BRCA mutation[J]. N Engl J Med, 2018, 379(8): 753-763.
[54]De Bono J, Mateo J, Fizazi K, et al. Olaparib for metastatic castration-resistant prostate cancer[J]. N Engl J Med, 2020, 382(22): 2091-2102.
[55]Messina C, Giunta E F, Signori A, et al. Combining PARP inhibitors and androgen receptor signalling inhibitors in metastatic prostate cancer: a quantitative synthesis and meta-analysis[J]. Eur Urol Oncol, 2024, 7(2): 179-188.
[56]Wang Y X, Xu Z, Wu K L, et al. Siglec-15/sialic acid axis as a central glyco-immune checkpoint in breast cancer bone metastasis[J]. Proc Natl Acad Sci U S A, 2024, 121(5): e2312929121.
[57]Lin L W, Lin T H, Swain S, et al. Melatonin inhibits ET-1 production to break crosstalk between prostate cancer and bone cells: implication for osteoblastic bone metastasis treatment[J]. J Pineal Res, 2024, 76(7): e70000.
[58]Meti N, Kelly D, Allen M J, et al. Genomic sequencing to inform therapy in advanced pancreatic cancer: a systematic review and meta-analysis of prospective studies[J]. Cancer Treat Rev, 2021, 101: 102310.


