【BJH】综述:MRD指导的急性髓系白血病治疗
时间:2025-09-11 12:15:14 热度:37.1℃ 作者:网络
在急性髓系白血病(AML)中,治疗后残留疾病的存在与复发风险相关,可测量残留病(MRD)量化了治疗后通过常规方法检测不到的残留癌症数量。在具有单一、可测量、驱动克隆的白血病中,MRD指导治疗已成为标准方案。例如,在急性早幼粒细胞白血病(APL)中,任何水平的疾病检测都具有预后价值并确立治疗意义,在急性淋巴细胞白血病(ALL)中,旨在根除MRD的MRD指导治疗已被证明有效。
然而,MRD在非APL AML中的应用远远落后于其他白血病,这是由于AML的异质性、克隆演化的倾向以及检测方法的技术挑战和缺乏标准化。虽然MRD检测在AML中的预后价值已得到充分证实,但仍然存在许多问题:尚不清楚应使用哪些方法、相关的阈值是什么,或者某些分子标记是否不应构成MRD,也尚不清楚MRD阳性是否仅仅是一个不良预后发现(一种更高危疾病的生物标志物),还是应该用于指导治疗。另外,AML中尚无确立的MRD根除方法。检测灵敏度的不断进步以及新型靶向疗法的出现,使得MRD在AML中的临床应用成为一个“移动的目标”。
《British Journal of Haematology》近日发表综述,纪念斯隆-凯特琳癌症中心Eytan M. Stein教授作为通讯作者,阐明了当前MRD在AML中使用的一些复杂性和争议,重点关注其最新进展以及在不同亚组中的应用。作者强调了MRD作为AML决策工具的不断演变的角色,指出了证据中的关键差距,并为未来研究优化个性化治疗方法提出了方向。

MRD检测方法
2021年,欧洲白血病网(ELN)发布了关于AML中MRD使用的更新指南,当时他们仅认可两种经过验证的AML MRD评估方法:多参数流式细胞术(MFC)和定量实时聚合酶链反应(RT-qPCR)。
MFC是一种基于抗体的方法,报告特定群体中异常细胞的百分比。为了正确识别白血病细胞群体,推荐结合两种技术。第一种侧重于诊断时检测到的患者特异性“白血病相关免疫表型”(LAIPs),第二种则检查异常分化/成熟模式,称为“different-from-normal”法(DfN)。MFC-MRD被认为是用户依赖性的,因为样本收集、设门、与再生或分化相关的“噪音”都可能潜在地影响可靠性。MFC-MRD的灵敏度范围从检测1000个细胞中的1个白血病细胞(灵敏度10−3,或0.1%)到10000个中的1个(10−4或0.01%)。在AML的MRD检测方法中,MFC-MRD灵敏度最低,但最快速、最广泛可用,并且适用于最大比例的患者。MRD检测技术的比较见表1。

RT-qPCR是一种分子方法,基于核糖核酸(RNA)的分离,转化为互补脱氧核糖核酸(DNA),然后使用等位基因特异性引物进行扩增,并通过实时荧光检测转录本水平。与MFC-MRD相比,该技术靶向疾病特异性突变或易位,这些必须经过验证与疾病相关,而非持续性白血病前克隆性造血。RT-qPCR比MFC更敏感,范围在10−5到10−6之间,可用于外周血(PB)以及骨髓(BM)抽吸物。
AML的复杂性在于并非所有细胞遗传学或分子标记都代表真正的疾病,特别是在克隆性造血的情况下。部分克隆可能消失而其他克隆持续存在,使得任何“MRD阴性”结果都是突变特异性的。经过验证的AML-MRD分子靶点包括NPM1突变和核心结合因子(CBF)易位(RUNX1::RUNX1T1或CBFB::MYH11),这些可以通过RT-qPCR进行定量测量。KMT2A-MLLT3或DEK-NUP214中的易位也是RT-qPCR监测的可靠分子靶点,但关于WT1突变存在一些争论。其他突变如IDH1/2和RUNX1已被研究作为MRD标记物,但其使用尚未得到验证。总的来说,只有大约40%的AML患者拥有可通过RT-qPCR测量的可靠分子MRD标记物。
二代测序(NGS)也是一种分子方法,通常在分离的DNA上进行。它是一种高通量技术,涉及目标基因的大规模平行测序。常见平台的灵敏度远低于MFC-MRD或RT-qPCR,范围在1%到2%之间。NGS最初被认为不可靠用于MRD评估,原因在于其相对较低的灵敏度,以及担心许多NGS可检测的突变与年龄相关的克隆性造血相关,而非实际疾病。
虽然常规NGS灵敏度有限,但最近发展的高灵敏度NGS检测(统称为NGS-MRD)结合了错误校正方法,如独特分子标识符和深度测序,以实现低至10−4的检测限,适用于广泛的突变。相关研究正在积累,检查了结局与NGS-MRD之间的相关性,探索了不同突变在不同时间点使用不同方法的MRD有效性。
数字PCR(dPCR)是一种分子方法,将样本分配到微滴中,可通过PCR反应绝对定量目标DNA或RNA,而无需依赖标准曲线。虽然它比RT-qPCR更敏感,但由于需要进行检测特异性验证,其临床应用受到限制。该技术广泛用于检测热点突变,特别是IDH1/2和NPM1突变,并有新兴数据支持其用于MRD监测。
结合不同的MRD评估方法表明,当结合方法时,例如NGS与MFC或RT-qPCR与MFC,MRD阴性具有附加的预后价值。应注意的是,部分研究对MFC-MRD的预后效用提出了质疑,例如pre-MEASURE项目发现集中化的MFC-MRD与NGS-MRD之间没有相关性。
MRD检测和监测的研究性方法包括设计患者特异性引物,测量循环肿瘤DNA或基因组测序。
确定MRD阴性的阈值
阻碍AML中MRD指导决策的异质性体现在,有的研究表明,在某些AML亚型中,低水平MRD可能以稳定方式持续存在,不一定表明即将复发,而在其他亚型中,任何水平的MRD都是有害的。理想情况下,临床有意义的MRD阴性阈值应根据AML亚型、患者年龄、治疗方案和时间点,针对每种方法分别进行验证,最好以前瞻性方式进行。
对于MFC-MRD,确定MRD阳性的阈值≥0.1%(10−3)异常原始细胞被广泛接受,并且是ELN指南中建议的临界值,这也得到几项多中心试验的支持。HOVON/SAKK组在60岁以下的de novo AML患者中证明,两个周期强化疗后MFC-MRD高于0.1%与无复发生存期(RFS)和总生存期(OS)不良相关。来自NCRI AML16试验的分析显示,类似的MFC-MRD阈值对60岁以上患者具有预后意义。 0.1%的阈值通常用作前瞻性MRD指导研究以及回顾性研究中MFC-MRD阳性的临界值,尽管部分研究建议使用更低的阈值。
分子RT-qPCR评估的预后显著阈值较不明确,可能具有突变特异性。ELN指南将阳性MRD定义为循环阈值<40(≥2/3次重复)。这也是Ivey等人研究中使用的临界值,该研究显示NPM1突变AML患者中阳性MRD的预后意义。该阈值大致对应于检测限,即大约在10,000个守门员基因(通常是ABL1)中存在一个异常拷贝。几项研究报告了更高的阈值具有预后意义,例如Dillon等人显示,BM中每105个ABL1拷贝中有1000个突变NPM1转录本(1%),PB中有200个(0.2%),对移植后结局可提供最大区分度。Kayser等人报告了类似的阈值,即BM中每104个ABL1拷贝中有100个突变NPM1拷贝(1%)具有预后意义。一些小组提出了预测复发风险的不同临界值,例如第一次巩固治疗后0.05%。另一种定义涉及对数减少动力学。一项研究显示,RT-qPCR转录本减少超过3-log10的患者复发率为30%~35%,而减少较少的患者复发率为75%。对ALFA0702试验中NPM1突变AML患者的分析表明,诱导后PB中4-log10的减少可预测长期无复发生存。该研究还显示,PB RT-qPCR MRD比匹配的BM MRD样本低一个对数。一项对具有RUNX1::RUNX1T1易位的AML患者的调查发现,一个诱导周期后2.5-log10的减少或两个强化化疗周期后3-log10的减少具有预后意义。
使用NGS进行MRD检测和监测的验证程度低于PCR或MFC,并且受到克隆演化和每个突变意义未明的阻碍。一项研究表明,当排除DTA突变(DNMT3A、TET2和ASXL1中的体细胞突变,可能被视为年龄相关的克隆性造血突变)时,在其他髓系相关突变的任何等位基因频率下检测都具有预后意义。其他研究则表明,即使是移植前DTA持续存在也可能具有预后意义。 用于检测FMS样酪氨酸激酶3内部串联重复(FLT3-ITD)的高灵敏度NGS MRD检测报告称,非常低水平的变异等位基因频率(VAF)具有预后意义。pre-MEASURE研究确定,在异基因干细胞移植(allo-HCT)前,VAF高于0.01%具有预后意义。
不同风险类别中MRD的预后意义
AML的风险分层对于指导缓解后治疗至关重要。在首次形态学缓解(CR1)后的确定时间点纳入MRD评估,可以在单纯基线风险因素的基础上增强预后精确性(图1)。通常来说,对于估计复发风险超过35%~40%的患者,首选在CR1进行allo-HCT;然而如下所述,MRD监测以及在分子学复发时提供抢先性(pre-emptive)治疗可能会改变这种逻辑。
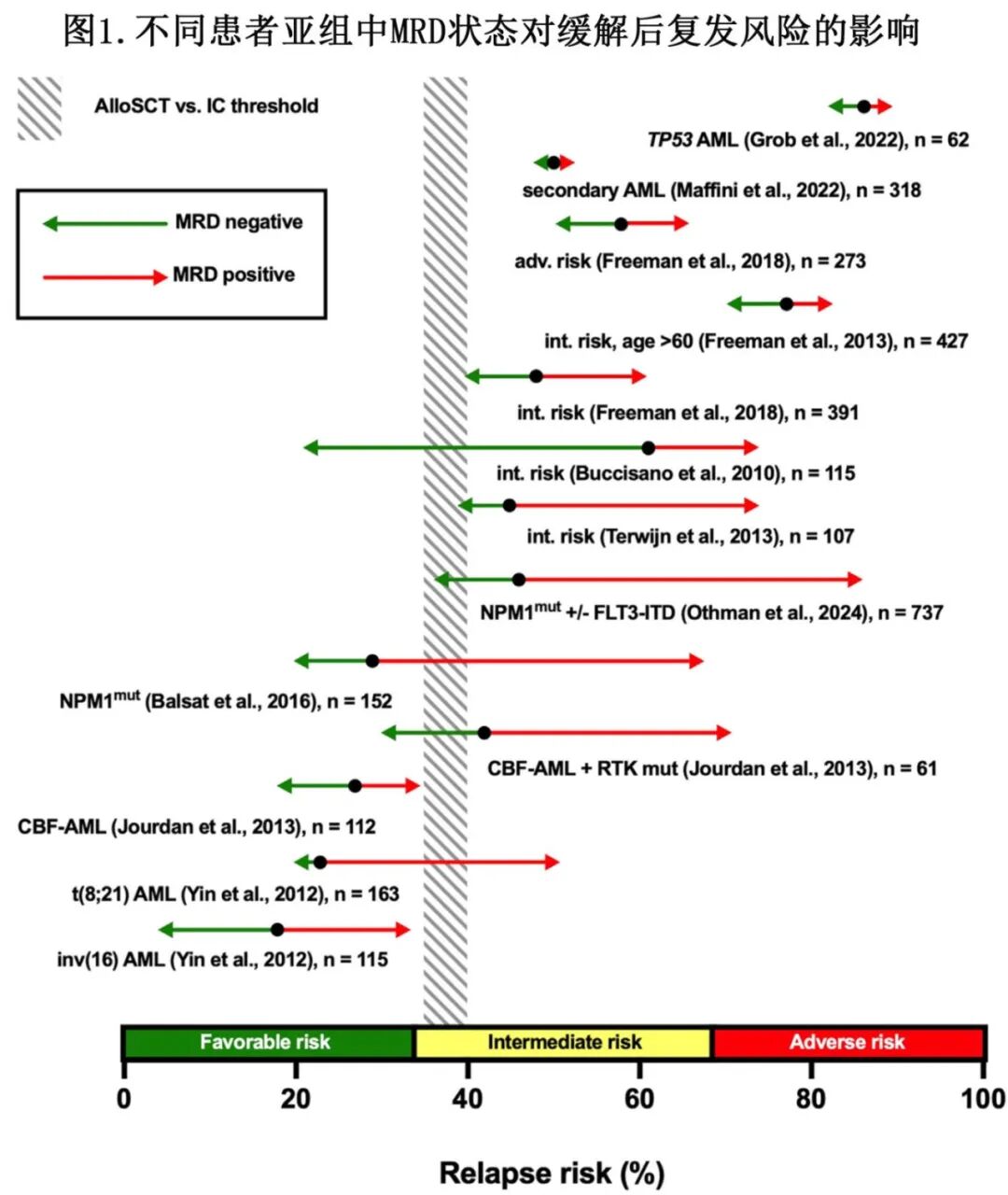
在ELN预后良好AML患者中,已经确立了一些MRD指导的策略。在预后中等或不良患者中,方法仍不太明确,并且因显著的生物学和临床异质性而复杂化。
预后良好
缓解后MRD的预后意义在预后良好AML患者中得到了最广泛的研究,并具有直接的临床意义。随着MRD测量的出现,对大型临床试验的回顾性分析显示,基于MRD检测的结果存在显著差异,表明在几个不同时间点MRD阳性患者的复发率更高(表2)。这在NPM1突变AML和CBF易位患者中得到了最有力的证明,使用PCR-MRD测量(包括PB和BM),并采用如上所述的不同阈值。这种认识改变了CR1的决策,转向推荐对MRD阳性患者在CR1进行allo-HCT。
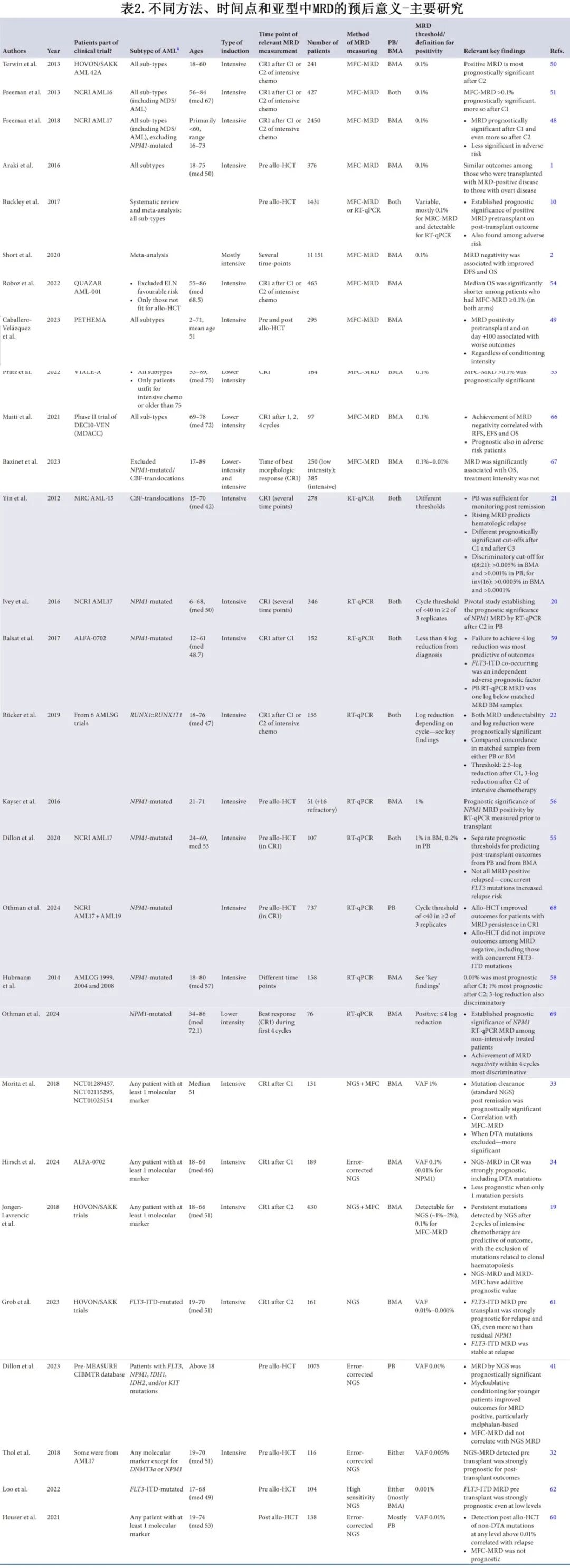
对于具有CEBPA bZIP突变的AML(这是预后良好AML中较少见的亚组),关于MRD预后相关性的数据缺乏。一项回顾性分析发现,在具有bZIP突变的患者中,MRD状态对复发风险没有影响,而在具有非bZIP突变的MRD阳性患者中,复发增加的趋势不显著。
预后中等
在预后中等患者中,MRD持续存在的不良预后价值证据来自多项研究。一项HOVON/SAKK分析中,两个诱导化疗周期后通过NGS或MFC确定的MRD在40%的患者中检测到。通过两种方法中任何一种检测到MRD的患者的4年复发率约为50%,通过两种方法均为MRD阳性的患者为73%,而MRD阴性患者为27%。该研究强调了结合不同MRD模式的附加价值,以及使用NGS进行MRD的可行性。值得注意的是,即使考虑了基线风险因素,MRD持续存在的预后价值仍然存在。
在NCRI AML17试验的一项分析中,该试验纳入60岁以下的患者,单疗程强化疗后43%的患者通过MFC实现MRD阴性,并且与MRD阳性组相比生存期得到改善,5年OS为63% vs. 44%。MRD阴性的积极预后影响在所有细胞遗传学风险组中一致,但在预后不良组获益较低。
NCRI AML16试验证明,MRD仍然是老年患者结局的预测因子。该试验纳入60至70岁的患者,主要包括预后中等患者。MRD阴性定义为MFC低于0.1%,分别在一或两个周期强化化疗后51%和64%的患者实现,并且与更好的OS(3年时42% vs. 26%)和更长的RFS相关。然而,即使在MRD阴性患者中,复发风险仍然很高,3年复发率为71%,而MRD阳性组为83%。与此一致,随后的分析显示,该试验中MRD阳性和阴性患者均获益于CR1 allo-HCT,从而对此时MRD评估指导移植决策的临床效用提出了挑战。
预后中等患者的一个特殊情况为,同时存在NPM1和FLT3-ITD或DNMT3A共突变的疾病。历史上推荐对此类患者在CR1进行allo-HCT,分析表明,该做法可能会通过考虑分子MRD状态而修改。最近,对NCRI AML17和AML19试验的分析得出了类似结论,显示在两个周期强化疗后PB中达到MRD阴性的患者结局优异。值得注意的是,CR1中接受或未接受allo-HCT的患者之间的3年OS(79% vs. 82%)没有差异,无论FLT3或DNMT3A突变状态如何。还有报道,在一组年龄较大(>60岁)的NPM1突变AML(或合并FLT3突变)患者中,尽管强化疗后达到了MRD阴性缓解,但复发率非常高,超过70%,表明MRD状态在老年患者中的意义稍低。
预后不良
在预后不良AML 中实现 MRD 阴性较难,并且在大多数情况下不会显著改变与该亚型相关的较差预后。大多数证据表明,在确定预后时,预后不良AML 患者的基线预后因素取代了 MRD 缓解的作用。在一项大型回顾性分析中,移植前 MRD 状态未显示影响继发性 AML 患者的预后,已知继发性 AML 是一种与高危遗传学相关的亚型。在对入组 NCRI AML17 试验的523例患者进行的分析中,一个疗程后 MFC 检测 MRD 阳性与整个队列的复发和死亡风险明显相关。然而,在定义为继发性 AML 的患者中,基于 MRD 状态的 RFS 或 OS 无显著差异。
最近的 NCRI AML19 试验比较了 CPX-351 与FLAG-Ida(氟达拉滨、阿糖胞苷、粒细胞集落刺激因子和伊达比星)作为诱导治疗新诊断细胞遗传学高危 AML 或高危骨髓增生异常综合征 (MDS) 的年轻成人患者的情况。达到 MRD 缓解的患者的 OS 比未达到 MRD 缓解的患者长近3倍(中位24.3个月vs. 8.4个月)。然而,尽管接受 FLAG-Ida 的患者 MRD 缓解率更高,但两个治疗方案的 OS 率相似。此外,在伴有 MDS 相关突变的患者亚组中,尽管两组中的 MRD 缓解率相似,但CPX-351 组的 OS 显著延长。
TP53 突变AML 是一种独特的疾病亚型,预后特别差。在一项230例 TP53 突变 MDS 或 AML 患者的研究中,使用 NGS 在62例患者中评价了 CR1 时的 MRD 状态,仅17例 (27%) 达到 MRD 阴性。然而,在 MRD 阴性和 MRD 阳性患者之间未观察到生存期差异,因为结局一致较差。同样,另一项关注老年 AML 患者的回顾性研究纳入295例患者,其中约一半为预后不良。该研究显示,当考虑基线风险时(以及在每个风险组内),缓解时 MRD 状态无累加预测价值。
具有 MLLT3 以外融合伴侣的 KMT2A 重排 (KMT2Ar)AML 是另一种特定的预后不良亚型,可通过融合基因靶向定量RT-qPCR.MRD监测进行 MRD 评估。KMT2Ar AML中的 MRD 因存在大量融合伴侣(超过100个)而变得复杂,需要仅靶向最常见的融合基因或开发患者特异性引物。Loo 等人采用了前一种策略,在一项64例 KMT2Ar AML 患者的研究中(迄今为止评价该组患者 MRD 的最大研究),allo-HCT 前使用 PCR 进行 MRD 评估,主要来自 BM 样本。移植前 MRD 的存在与显著较差的结局相关,MRD阴性和阳性患者的2年 RFS 分别为59% vs. 17%,2年 OS 分别为67% vs. 39%。
低强度缓解诱导后MRD的预后意义
减低强度治疗 (LIT) 在 AML 缓解诱导中的应用越来越多,主要是维奈克拉联合去甲基化药物 (HMA) 或低剂量阿糖胞苷 (LDAC)。几项研究已经证明,达到阴性MRD(通过MFC,阈值0.1%)与结局呈正相关。在预后不良患者中也显示了预后意义;然而还必须在更大的队列中进行验证。最近,在 LIT 诱导缓解后的患者中证实了 MRD 在 NPM1 突变 AML 中的实用性。多变量分析显示,4个周期后达到 MRD 阴性是与生存期相关的最重要因素,风险比为0.21。随着 LIT 在 AML 中的使用增加,预期可以进一步验证 MRD 对这些治疗后缓解的不同 AML 亚型的预后意义。
MRD持续存在时的MRD指导干预
基于MRD指导的CR1移植决策
一项针对具有RUNX1::RUNX1T1易位的AML患者的前瞻性研究将高危患者定义为:经过三到四个周期强化疗后未能通过RT-qPCR实现转录本降低3个对数级,或在6个月内失去此种反应的患者。这些患者推荐进行allo-HCT,而低危患者则完成巩固治疗。Allo-HCT改善了高危患者的OS(71.6% vs. 26.7%),但值得注意的是,却降低了低危患者的OS。ALFA-0702研究也表明,对于移植前达到深度分子缓解的NPM1突变患者,allo-HCT没有获益。
对参加NCRI AML17和AML19试验的患者进行的分析证实,对于两个化疗周期后仍持续存在MRD(通过PB的RT-qPCR检测)的NPM1突变AML患者,在CR1期进行allo-HCT具有OS获益,移植患者的3年OS为61%,而未移植者为24%。相反,NPM1 MRD阴性患者在CR1期接受allo-HCT并未显示OS获益,3年OS分别为79% vs. 82%。该研究组进一步检查了同时具有NPM1和FLT3-ITD突变的患者的结局,表明FLT3-ITD状态没有影响,提示在这些患者中,allo-HCT仅改善了基于NPM1状态为MRD阳性患者在CR1期的OS。在一项针对基于风险分层和MRD反应推迟allo-HCT的NPM1突变AML患者的分析中,具有FLT3-ITD突变和年龄大于60岁的患者复发率更高。然而,与直接在CR1期接受allo-HCT的患者相比,OS相似,表明这些患者在复发时通常可以挽救。
GIMEMA AML1310是最早检验CR1期MRD指导决策的前瞻性试验之一。该研究纳入新诊断预后中等AML患者,如果MFC-MRD测量值高于0.035%,或者RT-qPCR可检测到(在CBF或NPM1阳性病例中),则视为MRD阳性。经过两个周期强化疗后仍为MRD阳性的患者推荐进行allo-HCT,而MRD阴性的中危患者则接受自体移植(auto-HCT)。两组之间的结局没有发现显著差异,且与预后良好AML患者的结局相似,表明CR1期allo-HCT可能克服MRD阳性的不良预后影响,并且重要的是,部分预后中等患者可能不需要异基因移植来获得长期缓解。
HOVON-SAKK-132试验评估了在de novoAML强化诱导治疗中加入来那度胺。该研究包括一个针对预后中等患者的MRD指导组,CR1期MRD阳性患者推荐进行allo-HCT,而MRD阴性患者则接受自体移植或额外巩固治疗。两组之间的无病生存期(DFS)没有显著差异,结局与预后良好患者相似,这也再次表明MRD指导的缓解后治疗可能在特定中危患者中省略allo-HCT。将同一队列与经过倾向评分匹配的历史对照组进行比较显示,MRD指导队列中的患者与历史非指导队列中的患者在3年RFS和5年OS率方面相似(分别为54% vs. 47% 和 61% vs. 56%)。其他研究组的回顾性分析也报告了类似的发现。
尽管这些研究为在预后中等MRD阴性患者中省略一线allo-HCT提供了强有力的理论依据,但应注意的是,其复发率相当接近上述35%-40%的历史阈值(高于该阈值则推荐进行allo-HCT)。
针对MRD持续存在的治疗强化
NCRI AML18试验前瞻性评估了强化诱导后MRD阳性患者的治疗强化方案,包括30%(165/533)未达到CR的患者。对MRD阳性患者进行治疗强化,无论是将克拉屈滨加入柔红霉素和阿糖胞苷(DAC)还是使用FLAG-Ida,与继续单独使用柔红霉素和阿糖胞苷(DA)相比,均获得更优的OS(分别为46% vs. 42% vs. 34%)。 当分析仅限于第一疗程后达到CR/血细胞计数未完全恢复的CR(CRi)的患者时,也观察到强化治疗带来更高的MRD转阴率和改善的OS。
由于先前的研究已证明DAC方案优于DA方案作为诱导方案,且与MRD状态无关,MRD阴性患者可能同样会从更强化治疗中受益。此外,这些结果是否可推广到常规使用大剂量阿糖胞苷进行巩固治疗的背景下仍不清楚。
目前尚无前瞻性试验评估在CR1期对MRD阳性患者使用低强度干预措施,尽管在此情况下超说明书使用很常见。回顾性研究已证明在强化诱导缓解后对MRD阳性患者使用LIT的安全性和有效性,主要是在NPM1突变患者中,这些研究合并了MRD持续存在和复发的患者队列。
MRD监测及针对MRD复发的抢先治疗
缓解后MRD监测的效用是一个活跃的研究领域,同样地,如果在CR后MRD复发,抢先干预的问题也是如此。这对于具有NPM1突变或CBF易位的AML患者尤其重要,因为他们中的许多人在CR1期未接受allo-HCT巩固治疗,并且易于通过分子方法进行监测。
作为在此背景下为数不多的前瞻性研究之一,一项研究纳入AML17和AML19试验的637名患者随机分配至接受RT-qPCR监测与不监测(均在CR1后)。大多数为NPM1突变或CBF易位AML患者。分子复发时的抢先干预由医生选择(发生在45%的队列中), 多数采用强化化疗,一般随后进行allo-HCT。在33%的监测组中,复发动力学太快而无法进行抢先干预,而在8%的病例中监测未能检测到临床复发。有趣的是,除了NPM1和FLT3-ITD共突变患者亚组外,接受监测的患者并未显示OS获益,而CBF易位或NPM1突变/FLT3-ITD阴性患者则无此获益。一项针对114名CBF易位患者的回顾性研究表明,高达74%的患者表现出快速的复发动力学,只有25%的复发有足够的提前时间允许干预。该研究还提示,高达40%的分子复发可能在低水平复发,可能并不预示形态学复发。其他研究也提示了这一点,特别是在RUNX1::RUNX1T1易位患者中(与CBFB::MYH11易位相比)。
CETLAM-12研究的一项分析报告了截然不同的发现,该研究对110名ELN2017预后良好NPM1突变AML患者在MRD阴性CR1后进行了前瞻性监测,并鼓励在分子复发时由医生选择进行干预。结果显示,接受抢先干预的患者2年OS >80%,而在明显复发时治疗的患者约为40%。其他回顾性研究表明,对于CBF易位和NPM1突变AML,在形态学复发前进行抢先干预可改善结局。一项针对所有AML亚型(不包括CBF易位)的研究回顾性检查了对MRD复发(定义为MFC高于0.1%)患者通过allo-HCT或化疗进行的干预,显示接受干预的患者结局更好,且allo-HCT或化疗之间没有差异。
然而,CETLAM-12研究以及回顾性研究中缺乏随机化,极大地限制了这些发现的说服力,因为快速的复发动力学可能既阻碍了及时干预,也表明存在生物学上更具侵袭性的疾病。此外,证据表明可能需要采用亚型特异性方法,因为有数据表明不同AML亚型在复发动力学方面存在差异。因此,研究提示具有CBFB-MYH11易位的患者比具有RUNX1::RUNX1T1易位的患者复发显著更快,这对当前在CBF-AML中每2-3个月进行一次分子监测的实践效用提出了质疑。此外,CBF-AML患者被认为易于挽救治疗,这可能降低了早期复发检测的重要性。
总而言之,目前缺乏前瞻性,特别是随机化数据,阻碍了对任何抢先或监测策略的强力推荐。
采用低强度方案进行抢先干预
RELAZA2试验是一项前瞻性、II期多中心研究,纳入发生MRD复发的AML患者,定义为:分子标志物患者RT-qPCR出现高于1%的水平,或allo-HCT后供体嵌合率下降>80%。这些患者接受阿扎胞苷治疗至少六个周期。12个月时的RFS为46%,并且与MRD降低相关。另一项前瞻性II期多中心研究VALDAC试验纳入具有任何分子标志物的AML患者,这些患者在CR1后出现分子复发(定义为RT-qPCR升高≥1 log10)或低水平原始细胞复发。患者接受维奈克拉联合LDAC治疗中位四个周期。在26名分子复发患者中,46%的患者在两个周期后MRD检测不到,69%的患者有显著的MRD反应,这两者与无MRD降低的患者相比,均与改善的OS相关。尽管仍缺乏随机试验,但这两种前瞻性的MRD指导干预措施令人鼓舞,表明LIT可以在MRD清除中发挥作用并可能改善结局。
几项回顾性研究报告了类似的发现。对强化诱导后出现分子复发(n=52)或分子持续存在(n=27)的NPM1突变患者进行的研究汇总数据表明,LIT是安全有效的。这些患者中,84%有分子反应(MRD降低≥1个对数级),71%达到MRD阴性。56%的患者接受了allo-HCT,其中大多数人不需要额外治疗。allo-HCT前的MRD阴性对OS或EFS没有影响。值得注意的是,18名在达到MRD阴性后停止治疗的患者结局良好,4年分子RFS为62%。在另一个包含11例NPM1突变AML的系列中(9例分子复发,2例分子持续存在),使用阿扎胞苷和维奈克拉作为allo-HCT的桥接。中位随访26个月,90%的患者存活,且全部进行了移植。与之相反,对于不适合强化治疗并无限期接受LIT治疗的患者,达到MRD阴性可用于指导停止治疗,尽管在此背景下可用的数据不太明确。
靶向治疗也可考虑在LIT背景下用于MRD持续存在或复发。一项回顾性分析检查了在MRD持续存在或复发时具有FLT3和NPM1突变、CBF易位或其他分子标志物的患者的超说明书干预措施。使用单药FLT3抑制剂治疗使45%的患者达到MRD阴性,达到分子反应的患者2年OS为91%(95% CI: 81–100),而未达到者为60%(95% CI: 41–89)。用于NPM1突变和KMT2Ar AML的Menin抑制剂或IDH1/2抑制剂主要在研究明显复发时使用,们在MRD水平疾病中的应用正在研究中。
ALLO-HCT前,基于MRD的考虑
allo-HCT的预处理方案范围从清髓性预处理(MAC)到降低强度预处理(RIC)。选择最佳预处理方案时是否应考虑移植前MRD状态仍存在争议。
移植前MFC-MRD阳性与显著更高的复发率和较差的OS相关,即使是清髓性预处理之后也是如此。在一项针对来自NCRI AML17试验的NPM1突变AML患者的回顾性分析中,allo-HCT前外周血RT-qPCR高于0.2%和骨髓(BM)中高于1%与OS负相关。预处理方案或供体类型均未影响MRD阳性患者的结局。在MFC-MRD阳性患者中比较MAC方案与强度较低的方案也未显示结局存在显著差异。几项回顾性研究报告在MRD阳性患者中强化预处理没有获益。
相反,其他研究报告了MAC与移植前MRD阳性患者的优异结局相关。Hourigan等人证明,在通过纠错NGS panel在PB中检测到突变的患者中,与RIC相比,MAC显著改善了OS(3年OS分别为61% vs. 43%;p=0.02),而在MRD阴性患者中未报告差异pre-MEASURE研究使用纠错NGS-MRD回顾性分析了移植前突变与移植后结局的相关性,证明MAC改善了移植前为MRD阳性的年轻患者的结局。该研究组还提示基于美法仑的RIC可能克服MRD阳性的不利影响。
Paras等人的一项研究表明,移植前MFC-MRD与RFS相关,与预处理强度无关。与RIC相比,MAC的MRD转阴率更高(分别为82% vs. 58%, p=0.002)。有趣的是,在达到移植后MRD阴性的患者中,RIC组的3年RFS和OS更好,这可能表明移植后早期MRD阴性的预后意义有限,并且通过RIC的MRD转阴反映出一种反应性更强的白血病。
MRD指导的维持治疗
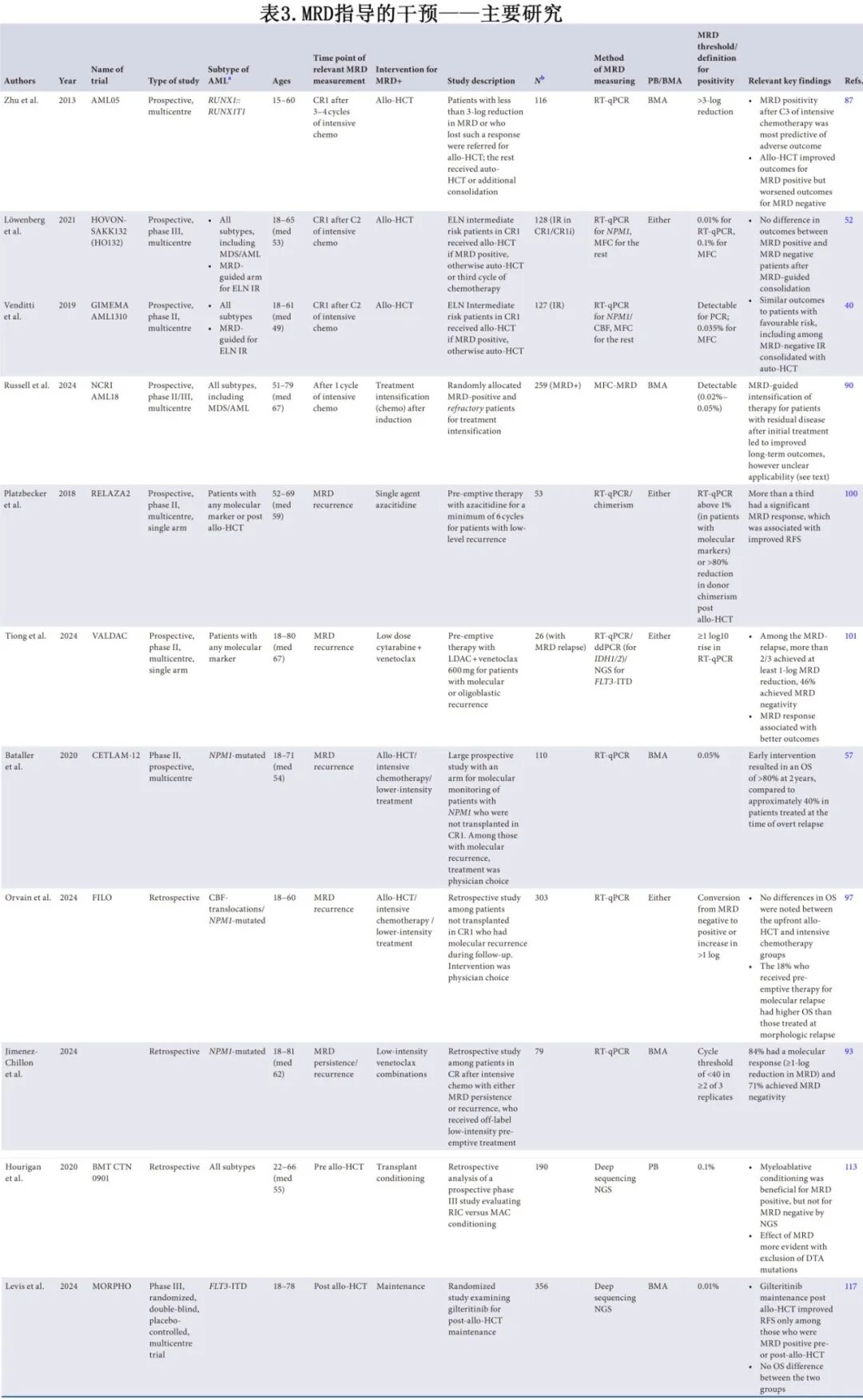
AML的维持治疗正在积极研究中,其作用尚不清楚。由于可能与毒性相关,尤其是在移植后,谨慎的做法是仔细选择最可能从此类干预中获益的患者。索拉非尼是一种第一代FLT3抑制剂,与安慰剂相比,作为FLT3突变患者allo-HCT后的维持治疗进行了评估,显示改善了RFS,在MRD阳性患者中最为显著。MORPHO试验评估了第二代FLT3抑制剂吉瑞替尼作为移植后维持治疗。与安慰剂组相比,在移植前或移植后检测到MRD的患者如果使用吉瑞替尼,则RFS显著改善,但OS没有改善,而两组中MRD阴性患者具有相似的RFS。小型研究在通过基线细胞遗传学或移植后MRD阳性定义的高危患者中使用了维奈克拉联合或不联合HMA维持治疗,表明该方案安全且可能有效。最后,在QUAZAR试验中,口服阿扎胞苷维持治疗具有OS优势,包括在强化疗后未进行移植的CR1期MRD阳性患者。关于检验MRD指导干预措施的研究总结见表3。
结论
尽管阳性MRD在任何类型的AML反应中都具有明确确立的不良预后价值,但MRD检测的临床适用影响仍然很少:在预后良好AML患者中,CR1期MRD阳性是进行allo-HCT的指征。在计划移植预处理时也可能考虑它,并且在某些情况下,移植后维持治疗将基于移植前MRD。
关于所有其他MRD指导的干预措施,目前尚无护理方案。
在CR期MRD持续存在的情况下,如果没有可用的临床试验,可采用风险导向的方法(参见图1)。
在预后不良AML患者中,尽管实现MRD阴性可能对结局有适度影响,但预后仍然很差,因此,MRD评估对临床决策的任何影响仍然很小。这些患者很少实现MRD阴性,即使实现,复发率也很高,因此应始终考虑进行allo-HCT,如果可能的话采用MAC。对于CR1期MRD阴性的预后中等AML患者,可寻求进行allo-HCT。然而,考虑到前瞻性数据可能很快就能足够有力地支持省略移植,建议降低考虑在CR1期采用其他类型巩固治疗并密切进行MRD监测的门槛,特别是在可以通过PB进行PCR-MRD监测的情况下。
在所有时间点针对MRD复发的最佳干预措施仍不清楚,尽管越来越多的证据支持在任何风险类别中在明显复发前进行早期干预。
最近证明了低强度缓解诱导方案后MRD阳性的不良预后价值,预计根据MRD调整治疗将在不久的将来在治疗指导中发挥作用。
在临床试验之外,因为缺乏随机研究而无法推荐直接靶向 CR 期的持续 MRD。然而,鉴于大量数据表明MRD不仅仅是一个不良预后的生物标志物,强烈主张将MRD阳性患者纳入临床试验,无论是在MRD持续存在还是MRD复发的情况下。AML领域也迫切需要建立一种经验证的 MRD 根除方法,以生成支持或拒绝这种干预的数据。
参考文献
Nachmias B, Haran A, Yisraeli Salman M, Stein EM. Measurable residual disease-guided therapy in acute myeloid leukaemia: Practical insights. Br J Haematol. 2025;00:1–21. https://doi.org/10.1111/bjh.70038


