广州医科大学周蕾/张清顺/王簕团队ACS Nano:研发可注射植物磷酸配位化合物黏附水凝胶,为骨质疏松性骨折提供新策略
时间:2025-09-17 12:14:07 热度:37.1℃ 作者:网络
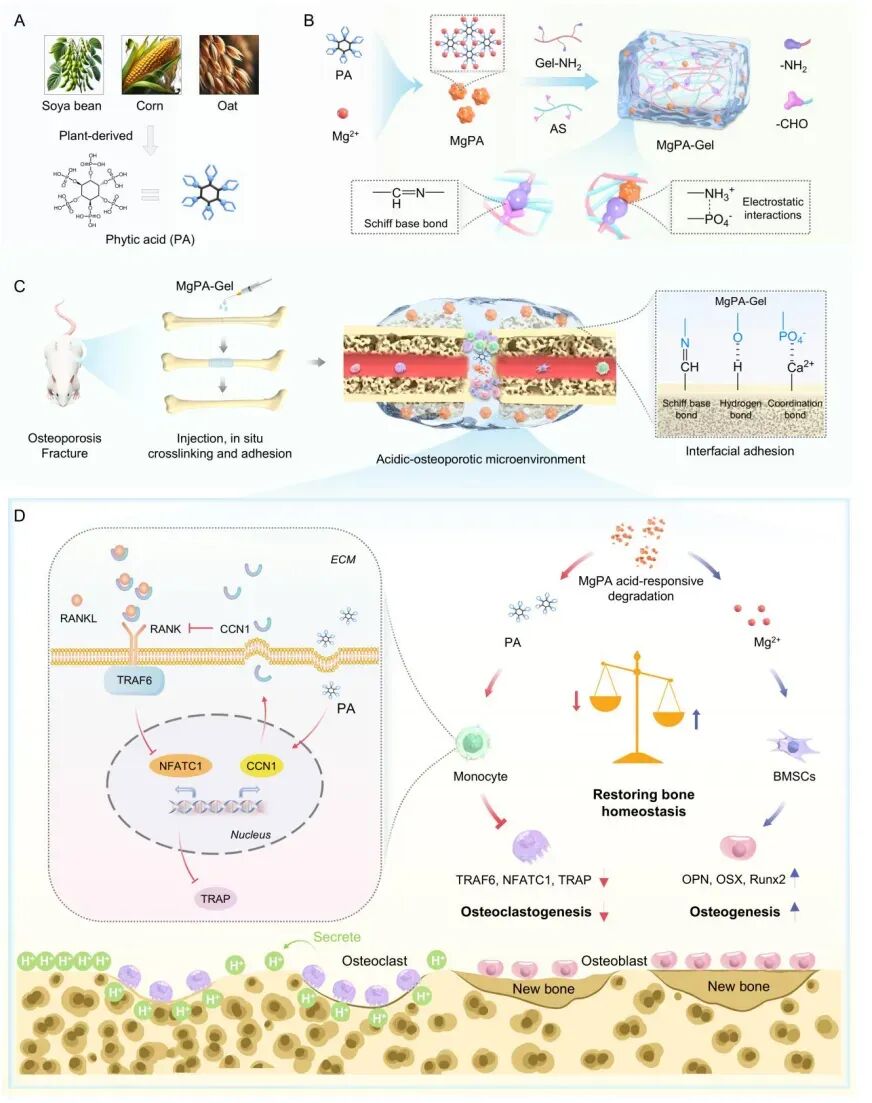
骨质疏松性骨折的愈合难题长期困扰临床,其核心症结在于成骨细胞与破骨细胞功能失衡,现有治疗手段或因疗效有限、或因副作用显著,难以满足临床需求。近日,广州医科大学第三附属医院周蕾教授、张清顺副教授及王簕教授团队在该领域开展深入研究,成功开发出一种可注射植物源磷酸配位化合物基黏附水凝胶(MgPA-Gel)。相关研究成果已在ACS Nano发表:“Injectable plant phosphate coordination compounds-based adhesive hydrogel accelerates osteoporotic fracture healing by restoring osteoclast/osteoblast imbalance”。论文通讯作者是广州医科大学第三附属医院周蕾教授、张清顺副教授及王簕教授。该系统阐明了该水凝胶通过调控骨代谢平衡促进骨质疏松性骨折愈合的作用机制,为后续研究与临床转化提供了重要参考。
临床困境:骨质疏松性骨折治疗亟需突破
骨质疏松是全球高发的骨骼系统疾病,以骨密度渐进性降低、骨量减少为主要特征,患者易因轻微创伤引发骨折。据已有数据显示,全球每3秒即发生1例骨质疏松性骨折,其中绝经后女性因雌激素缺乏导致骨密度维持机制受损,成为高发人群。50 岁以上女性中,约 43% 曾因轻微跌倒或碰撞发生骨裂。更为棘手的是,骨质疏松性骨折自愈能力差、骨不连风险高,不仅显著提升残疾率与死亡率,还会增加再次骨折概率,对患者健康与生活质量构成严重威胁。
当前临床常用治疗手段存在明显局限:维生素 D 与钙补充剂对骨折愈合的促进作用有限;双膦酸盐、地舒单抗等药物及激素治疗虽能在一定程度上调节骨代谢,但需长期持续使用,且可能引发股骨非典型骨折、颌骨坏死等严重副作用。周蕾教授指出,骨愈合与重塑的核心是破骨细胞骨吸收和成骨细胞骨形成的动态平衡,单一靶点的治疗方案难以应对骨质疏松状态下复杂的骨代谢紊乱。研发兼具安全性与有效性的协同治疗策略,已成为骨科领域亟待解决的关键问题。
技术创新:构建植物源配位水凝胶的协同调节体系
团队基于天然材料的安全性与生物活性优势,构建了以植物源植酸(PA)和镁离子(Mg²⁺)配位聚合物(MgPA)为核心的黏附水凝胶系统。该系统通过将 MgPA 纳米颗粒与胺基化明胶(Gel-NH₂)、醛基氧化淀粉(AS)整合,实现了多维度技术突破,具体如下:
1. pH 响应性降解,适配病理微环境
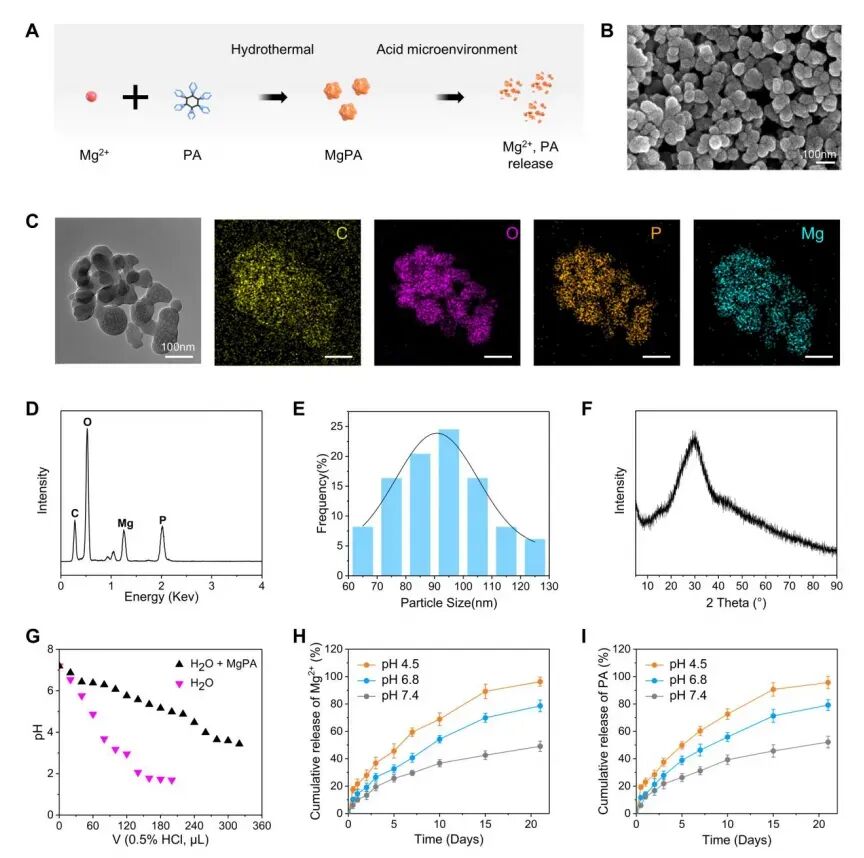
骨质疏松病灶的酸性微环境会严重抑制骨折愈合,而MgPA-Gel 具有精准的 pH 响应降解特性:在中性生理环境中降解缓慢,可避免活性成分过早流失;在 pH 4.5-6.8 的酸性微环境中,则能加速释放 PA 与 Mg²⁺。实验结果显示,该水凝胶在模拟骨质疏松微环境中,20 天内可持续释放活性成分,为骨折愈合关键期提供稳定治疗作用;同时,MgPA 纳米颗粒可中和局部酸性物质,为骨修复营造适宜的化学环境。
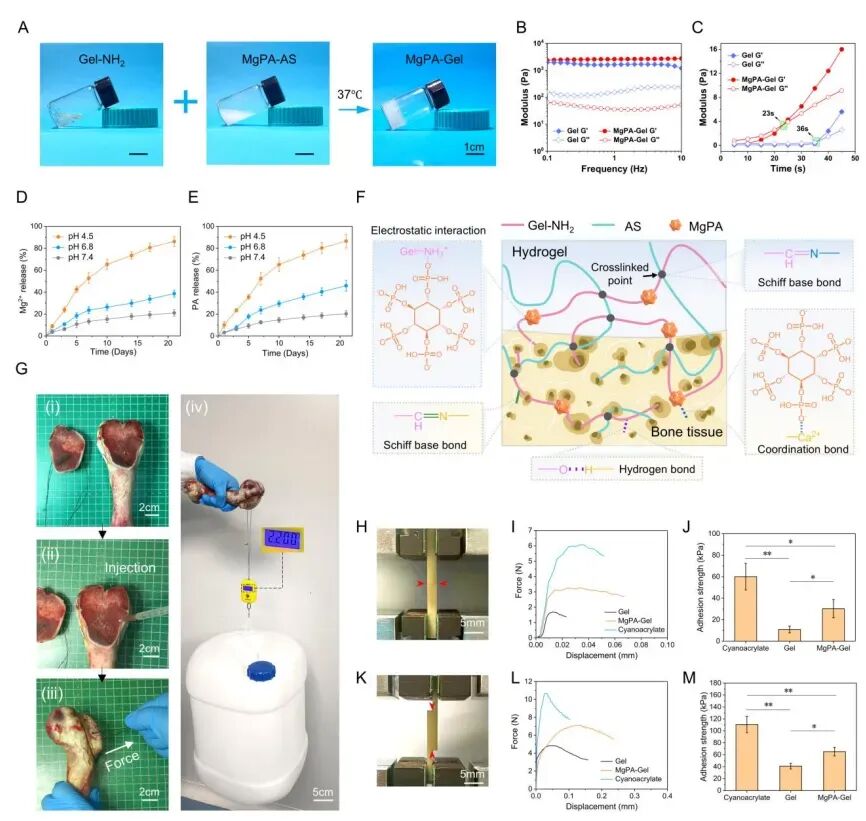
2. 多机制黏附,解决湿面固定难题
骨折部位常伴随血液与体液,传统黏合剂易因湿面环境脱落失效。MgPA-Gel 通过 “多重化学键协同作用” 实现强效湿面黏附:明胶胺基与淀粉醛基形成席夫碱键;MgPA 的磷酸基团与明胶胺基产生静电作用;磷酸基团还可与骨表面钙元素形成配位键,同时辅以氢键结合,即使在出血状态下,仍能快速交联固定。体外实验显示,在猪股骨髁模型中,该水凝胶 23 秒内即可完成交联,且能稳定悬挂 2.2 公斤重物;在兔胫骨粉碎性骨折模型中,其在出血环境下仍可有效连接骨碎片、填充间隙,黏附性能优于多数商用及实验性组织黏合剂。
实验验证:MgPA-Gel 显著促进骨折愈合并提高骨力学性能
为验证 MgPA-Gel 的治疗效果,团队在去卵巢(OVX)诱导的绝经后骨质疏松大鼠股骨骨折模型中开展系统实验,设置空白对照组、氰基丙烯酸酯(CA)黏合剂组、单纯凝胶组及 MgPA-Gel 组,通过影像学、组织学及生物力学分析评估愈合效果,结果如下:
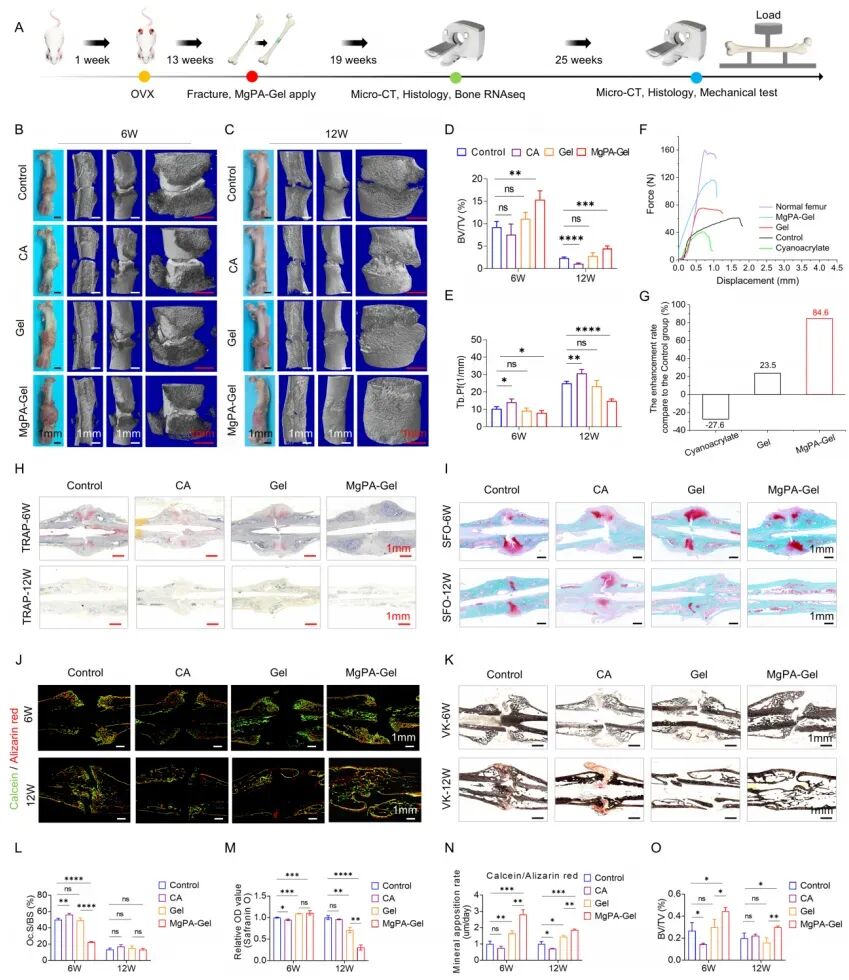
1. 加速骨痂形成与皮质骨修复
术后 6 周micro-CT 结果显示,MgPA-Gel 组骨折端骨痂形成量显著高于其他组别,骨体积/组织体积比(BV/TV)提升明显;术后 12 周,该组皮质骨已形成连续完整结构,表面光滑,而对照组仍存在皮质骨不连续、软骨残留等问题。组织学染色结果进一步证实,MgPA-Gel 组破骨细胞数量(TRAP 阳性细胞)显著减少,且软骨细胞在 12 周时基本完成骨化,其他组别则仍有大量软骨组织残留,提示 MgPA-Gel 可有效加速骨折愈合进程。
2. 提升骨力学强度
三点弯曲实验结果显示,术后 12 周,MgPA-Gel 组股骨抗弯曲能力较单纯髓内固定组提升 84.6%,最大载荷达 150N,骨恢复率达到正常未骨折股骨的 75.4%,显著优于其他实验组。这一结果表明,MgPA-Gel 不仅能促进骨形成,还可提升新生骨的力学稳定性,降低再次骨折风险。
3. 良好生物相容性
安全性评估显示,MgPA-Gel 在大鼠皮下 1 个月内可完全降解,且对心、肝、脾、肺、肾等主要器官无明显损伤。水凝胶的所有成分均为天然可降解材料,其中植酸已被美国 FDA 列为‘一般认为安全’(GRAS)物质,为后续临床转化提供了良好的安全性基础。
机制探索:CCN1/RANKL 通路介导的竞争性抑制作用
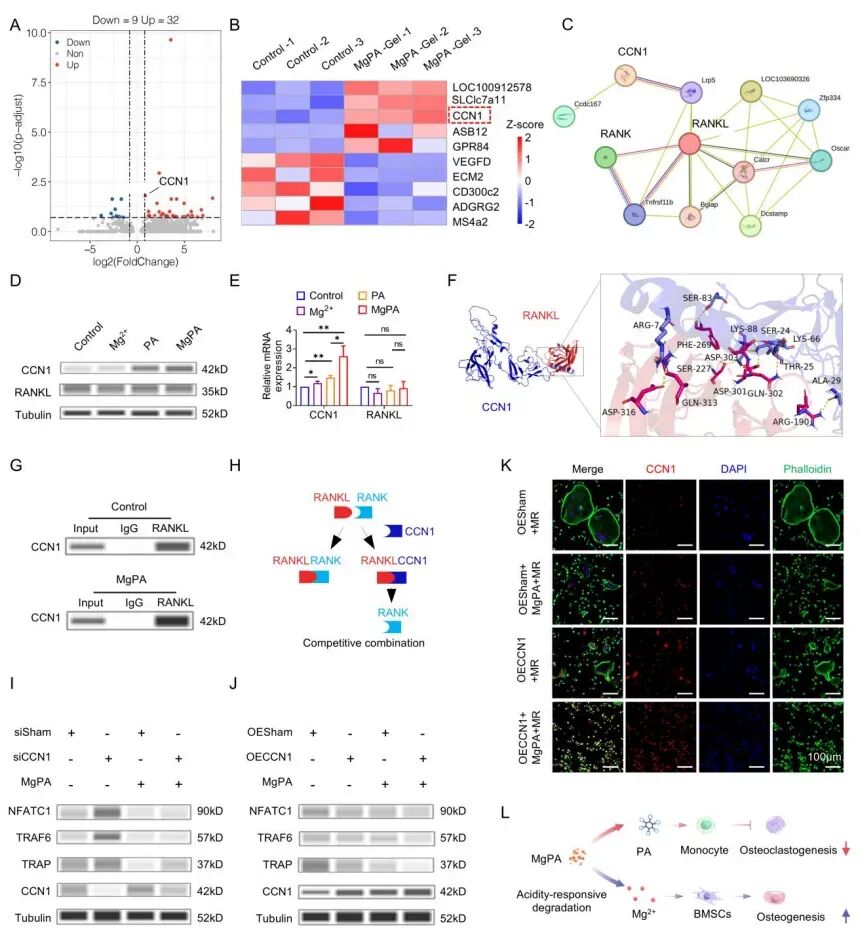
研究的核心设计思路是通过“抑制骨吸收、促进骨形成”的双重作用,恢复骨代谢平衡。研究证实,水凝胶释放的Mg²⁺可激活骨髓间充质干细胞(BMSCs)的成骨分化通路,上调成骨标志物骨桥蛋白(OPN)、成骨细胞特异性转录因子(Osterix)及 Runt 相关转录因子 2(Runx2)的表达。团队通过转录组测序与分子机制研究,进一步揭示了 PA 抑制破骨细胞活性的关键通路:MgPA-Gel 释放的 PA 可特异性上调单核细胞中 CCN1 的表达,且 CCN1 能与 RANKL 直接结合,二者结合可阻断 RANKL-RANK 信号通路的激活,进而下调破骨细胞分化关键蛋白 TRAP、TRAF6 及 NFATC1 的表达。
这一机制与骨保护素(OPG)抑制 RANKL 的作用类似,但 CCN1 由机体自身细胞分泌,更易融入生理调控网络。通过 CCN1 敲减与过表达实验验证,当 CCN1 表达受抑制时,MgPA 对破骨细胞的抑制作用显著减弱;而 CCN1 过表达则可直接阻断破骨细胞分化,证实 CCN1 是 PA 发挥破骨抑制作用的核心介质。
转化前景:为微创与个性化治疗提供可能
MgPA-Gel 的设计充分考虑临床应用需求:采用可注射剂型,无需大型手术,通过微创方式即可注入骨折部位,适用于难以手术固定的复杂骨折;材料来源广泛、合成工艺可规模化,有利于控制成本;同时,该系统可替换为患者自体细胞构建个性化模型,为精准医学治疗提供潜在方向。
下一步,团队将开展大动物实验与临床前安全性评估,重点优化水凝胶的降解速率与黏附强度,推动其向临床应用转化。本研究不仅为骨质疏松性骨折治疗提供了新策略,也为植物源配位化合物在骨修复领域的应用开辟了新思路,或可为其他代谢性骨病的治疗提供参考。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.5c11716


