Menin抑制剂在急性白血病治疗中的作用机制、临床疗效、耐药机制及联合治疗策略
时间:2025-09-18 12:13:23 热度:37.1℃ 作者:网络
Menin是一种支架蛋白,与KMT2A(MLL)等表观遗传调控因子相互作用,维持白血病细胞的异常基因表达(如HOXA/B、MEIS1)。Menin抑制剂通过阻断Menin-KMT2A相互作用,促使白血病细胞分化,产生抗白血病效应。Menin抑制剂revumenib目前已被批准用于治疗伴有赖氨酸甲基转移酶2A(KMT2A)重排的复发或难治性白血病。目前还有多种其他Menin抑制剂正处于临床开发阶段,旨在靶向其他亚型,例如占急性髓系白血病高达30%的核磷蛋白1(NPM1)突变。正如其他癌症靶向治疗所观察到的那样,单药治疗后晚期病例可出现靶向耐药突变,因此需要将Menin抑制剂纳入联合策略以提高缓解的持久性和深度。
《Blood Cancer Discovery》近日发表综述,MD安德森癌症中心和纪念斯隆凯特琳癌症中心学者阐述了Menin抑制剂治疗急性白血病的作用机制、临床疗效、耐药机制及联合治疗策略。

引言
Menin抑制剂的发展开启了急性白血病表观遗传治疗成功的新时代。抑制Menin可破坏导致致癌基因表达的表观遗传复合物,这种表达是造血分化阻滞的原因,从而导致癌细胞正常分化并产生抗白血病效应。Menin与表观遗传调节因子赖氨酸甲基转移酶2A(KMT2A)的相互作用对多种急性白血病亚型至关重要,例如伴有核磷蛋白1(NPM1)突变或KMT2A重排(KMT2Ar)的白血病。Menin抑制剂revumenib于2024年11月获得美国食品药品监督管理局(FDA)批准,用于治疗成人和1岁及以上儿科患者的复发或难治性(R/R)KMT2Ar急性白血病。该批准是基于AUGMENT-101试验一个单臂队列的结果,这是一项开放标签、多中心1/2期试验,revumenib单药治疗后完全缓解(CR)或完全缓解伴部分血液学恢复(CRh)率为21.2%,中位缓解持续时间为6.4个月。此外,目前还有多种其他Menin抑制剂正处于临床开发阶段(图1 A,B,C),无论是作为单药还是与其他药物联合使用,都显示出初步的有希望的结果。然而,与癌症的其他靶向治疗一样,不出所料地出现了阻止抑制剂结合的获得性耐药突变,凸显了menin-KMT2A相互作用在这些白血病亚型发病机制中的关键作用。因此,下一步的目标是通过将Menin抑制剂纳入各种联合方案和疾病阶段,来提高缓解几率并最终实现治愈。
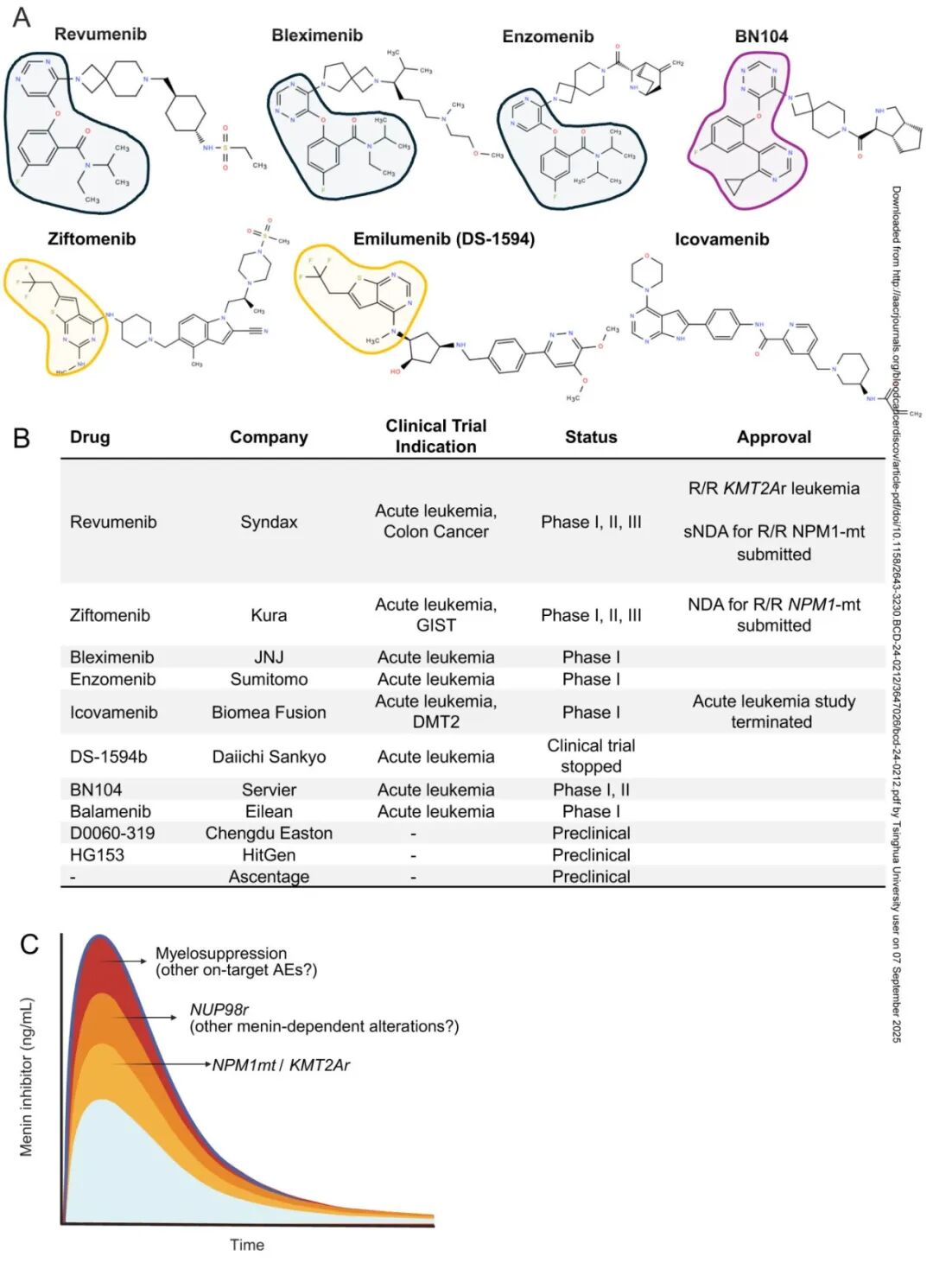
图1:临床开发中的 Menin 抑制剂。
A.menin抑制剂的化学结构。
B.menin抑制剂、正在研究的主要临床适应症和监管批准状态列表。
C.预测靶向每种基因型所需的 menin 抑制的药代动力学特性。虽然较高浓度可能覆盖所有易感基因型,但也可能导致更多的靶向毒性,如骨髓抑制。
作用机制
Menin是一种支架蛋白,与转录调节因子相互作用。此外,Menin最近被鉴定为甲基化组蛋白H3赖氨酸79(H3K79me2)的reader,这是一种用于发育、细胞分化和疾病进展基因调控的表观遗传标记。因此,Menin可能作为一种表观遗传reader,将相互作用的蛋白质招募到H3K79me2染色质标记处并调节基因表达。同源框(HOX)A和B基因及其DNA结合辅因子MEIS1在高达60%的急性髓系白血病(AML)以及其他谱系的急性白血病亚型中异常表达,这种异常的HOXA/B和MEIS1表达导致造血分化阻滞和白血病。Menin与KMT2A的相互作用对于这种异常表达至关重要,其中Menin对于KMT2A表观遗传复合物与该促白血病程序的关键启动子结合是必不可少的。因此,在KMT2Ar或NPM1突变急性白血病的临床前模型中,menin-KMT2A相互作用被确定为一个治疗机会。Menin-KMT2A蛋白质-蛋白质相互作用的小分子抑制剂将Menin从负责白血病的染色质位点驱逐出去,从而逆转异常基因表达,导致造血分化和抗白血病效应。
KMT2A通过一个口袋与Menin结合,针对该口袋已设计了小分子抑制剂(图1, 2)。KMT2Ar白血病是由KMT2A与超过100种不同易位伙伴(大多涉及表观遗传调节因子)的致癌融合引起的,这些融合通过与Menin结合并与MEIS1基因启动子关联,重新连接基因转录,并劫持通常限于未成熟造血干细胞和祖细胞的程序。在临床前KMT2Ar模型中,Menin的基因敲除逆转Hoxa基因表达,从而消除KMT2A融合蛋白的分化阻滞和致癌特性(图2A)。NPM1突变 AML也与HOXA/B基因的上调相关。NPM1的突变导致该核仁蛋白发生胞质转位,然而最近的研究表明,一部分突变型NPM1仍保留在细胞核中,直接与menin-KMT2A相互作用,结合活性染色质区域,并作为表观遗传放大器劫持AML驱动基因的转录。在临床前NPM1突变模型中,小分子Menin抑制可驱逐Menin和野生型KMT2A复合物,导致异常HOXAB基因表达下调和抗白血病效应(图2A)。最后,在其他依赖于menin-KMT2A相互作用的白血病亚型中也发现了类似的作用机制,例如NUP98重排白血病、UBTF串联重复(TD)或涉及脑膜瘤1基因(MN1)的易位(图2A)。鉴于多种急性白血病亚型的特点都是HOX/MEIS1失调,因此存在扩大Menin抑制应用范围的潜力。基于可靠的临床前数据,以及覆盖最大急性白血病患者群体的潜力,几种Menin抑制剂目前正处于临床开发阶段(图1 A,B)。
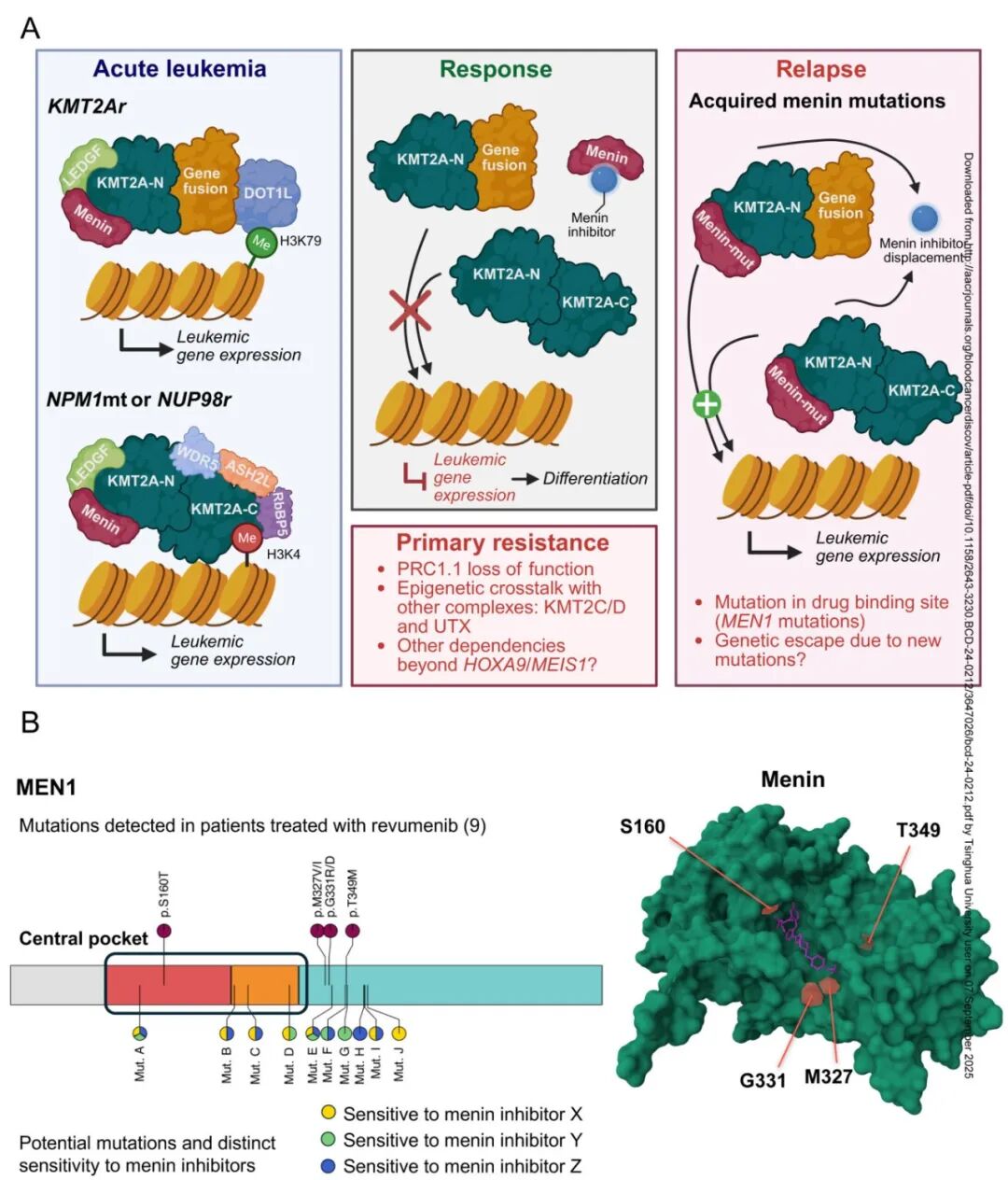
图2:对 menin 抑制剂的反应和耐药性。
A.描绘 menin 抑制剂作用机制的示意图,它通过破坏 menin 与野生型 KMT2A 或 KMT2A 致癌融合蛋白之间的相互作用从而将这种致白血病复合物从染色质中逐出而发挥作用。这导致白血病原始细胞中 HOX 基因表达受到抑制并诱导造血分化。抑制后治疗耐药的多种机制,如获得性遗传逃逸突变体,其可阻止突变型 menin 蛋白与小分子药物结合,但可维持其与KMT2A、KMT2A致癌融合蛋白或突变型核磷蛋白 (NPM1mt) 的相互作用。另外,与其他染色质复合物的表观遗传串扰,包括 KMT2C/D 与组蛋白去甲基化酶 UTX 和 PRC1 或 PRC2 复合物的成分的复合物,可以诱导转录扰动,使肿瘤抑制因子沉默或重新激活癌基因来调节对 menin 抑制的敏感性。
B.药物结合位点的 Menin 耐药突变。A.在接受 revumenib 治疗的患者中检测到编码 menin(MEN1) 的基因的复发性突变。新出现的数据表明,除了Perner et al,Nature 2023描述的突变外,还存在其他突变,基于氨基酸与每种药物的不同化学结构相互作用,对每种 menin 抑制剂具有不同的敏感性,描述了 menin 蛋白结构和药物结合位点的耐药突变
临床结果
疗效
Revumenib获得监管批准用于KMT2Ar白血病,标志着急性白血病靶向治疗和Menin抑制的新时代。这是基于AUGMENT-101单臂队列的结果,该多中心、开放标签研究纳入104名成人及儿科(至少30天龄)R/R KMT2Ar急性白血病患者,排除KMT2A部分串联重复的患者。Revumenib治疗导致CR/CRh率为21.2%,中位缓解持续时间为6.4个月。值得注意的是,尽管有临床活性的证据,Menin抑制剂ziftomenib单药治疗KMT2Ar白血病的反应率低于治疗NPM1突变AML的反应率,并且在该亚组中分化综合征的发生率更高,这可能影响1期试验中的治疗时间和剂量递增。这也导致Kura Oncology决定停止ziftomenib单药治疗KMT2Ar AML的临床开发,并继续研究其与其他药物联合用于该亚型。目前处于临床开发阶段的Menin抑制剂单药治疗结果总结在表1和表2中。
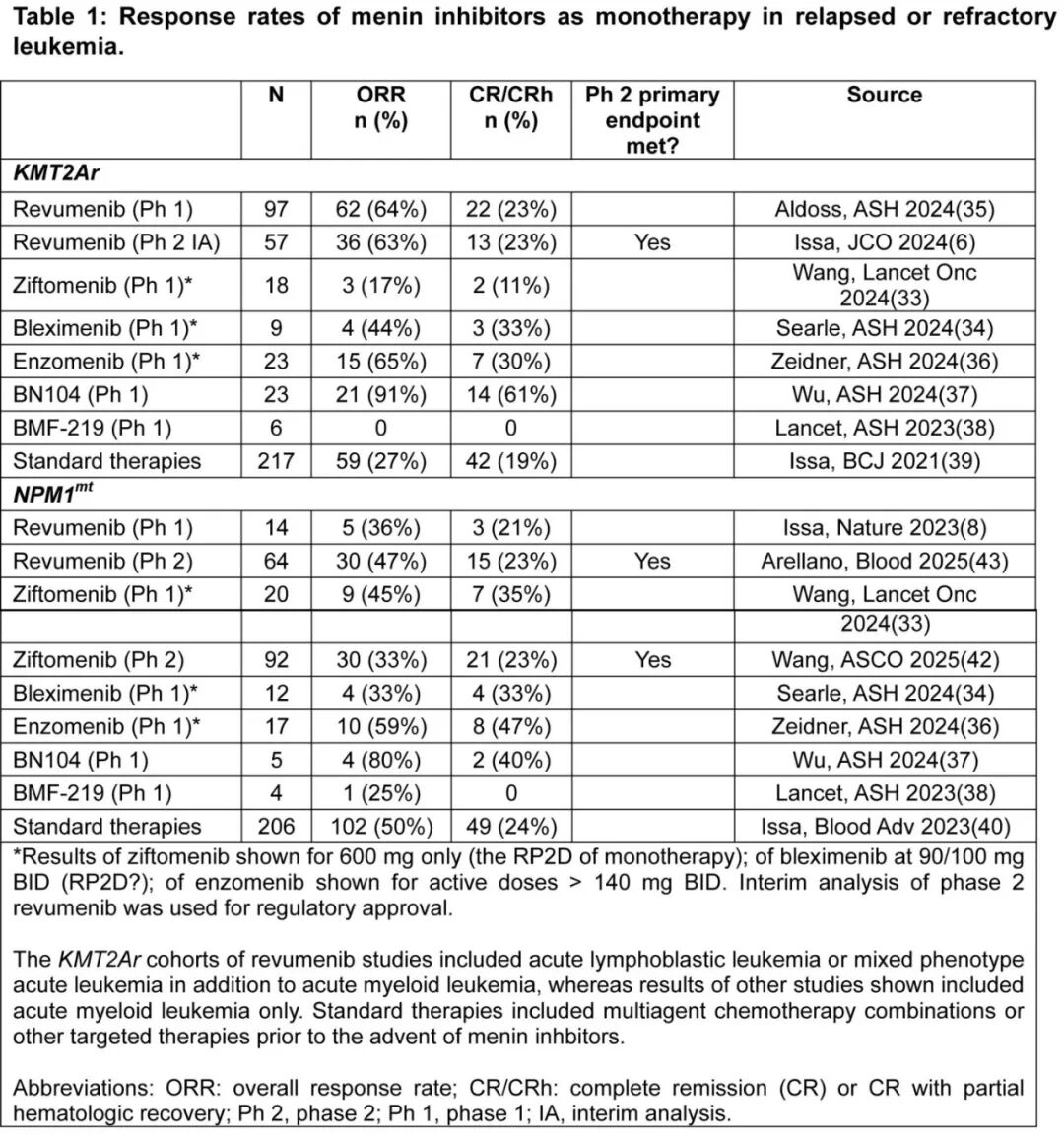
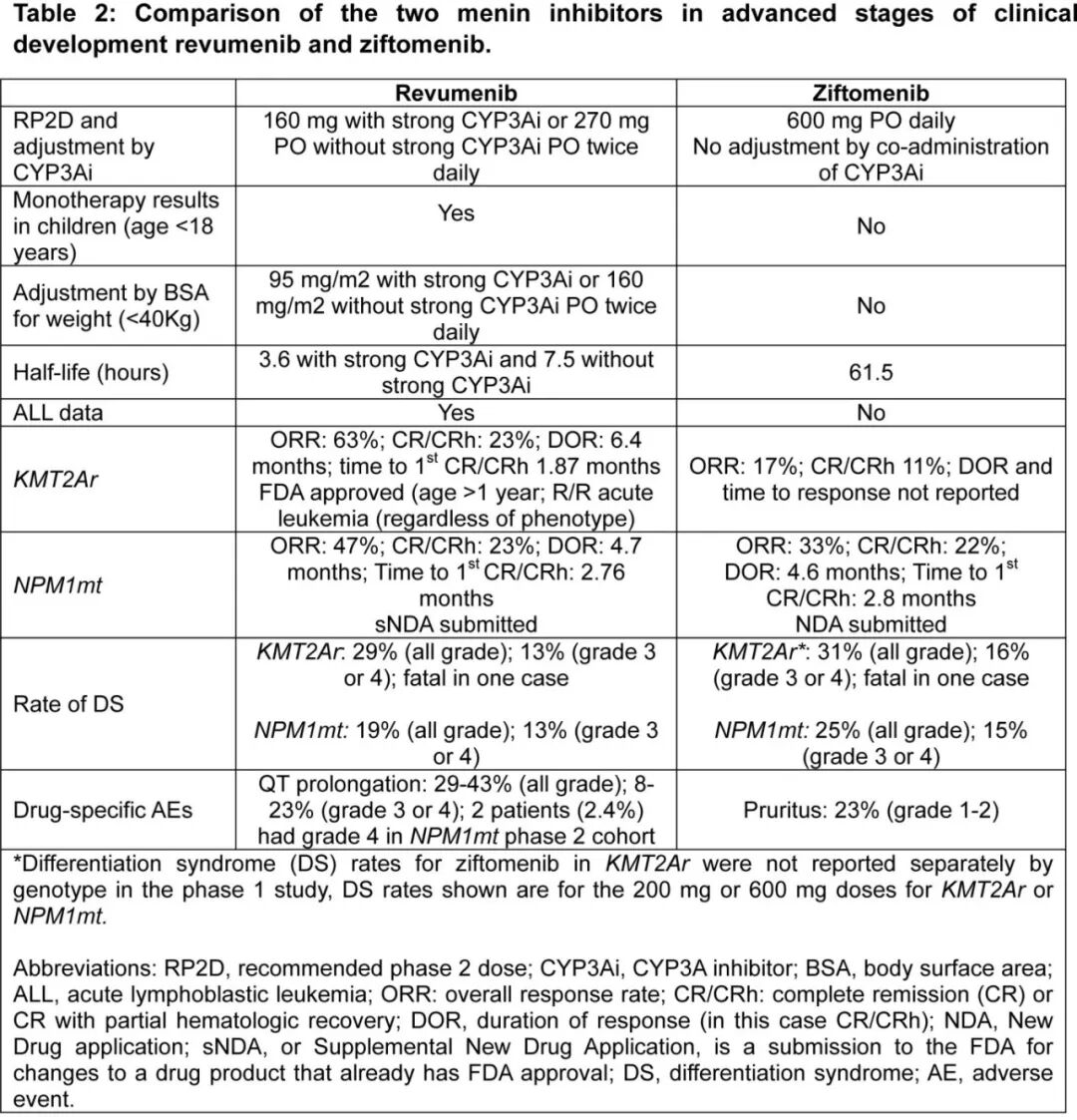
在R/R NPM1突变AML中,ziftomenib单药治疗在1期临床试验中的CR/CRh率为35%。最近,ziftomenib的2期临床试验达到了疗效主要终点,CR/CRh率为23%,超过了标准化疗12%的历史基准,R/R NPM1突变AML的中位缓解持续时间为3.7个月。这些结果已提交用于ziftomenib治疗R/R NPM1突变AML的监管批准。与之类似,revumenib治疗R/R NPM1突变AML的2期临床试验也达到主要疗效终点,CR/CRh率为23%,缓解持续时间为4.7个月。这些结果已提交用于revumenib该适应症的监管批准。其他Menin抑制剂在R/R NPM1突变AML中也显示出类似的结果,并总结在表1中,因此突出了各种小分子药物临床数据的稳健性。
NUP98重排(NUP98r)是儿童R/R AML中最常见的基因型(50%)。 然而,鉴于该基因位于11p15染色体末端,常规细胞遗传学检查经常漏检,并且在成人AML中,尤其是伴有FLT3、WT1或RAS共突变且核型正常的年轻成人中,该异常的发生率可能被低估。在一个队列中,成人AML中NUP98r的发生率估计为4.6%。患有这种罕见异常的患者接受Menin抑制剂治疗的数量较少,但早期临床结果已证实这些药物在该亚型中的疗效。在revumenib的1期剂量递增研究中,治疗5名R/R NUP98r AML患者,其中3名(60%)达到形态学缓解,包括分别有1名患者达到CRh、血小板计数不完全恢复的CR(CRp)和血细胞计数不完全恢复的CR(CRi)。
此外,Menin抑制剂enzomenib和BN104分别在1名携带CALM::AF10融合[t(10;11)(p13;q14-21)]的患者中诱导CR,这是另一种同样以HOX基因上调为特征的罕见变异。然而根据临床经验,接受Menin抑制剂治疗的NUP98r AML患者往往需要更长时间才能缓解,并且残留病率更高。作者推测,对HOX基因和menin-KMT2A相互作用的依赖程度因基因型而异。NPM1突变或KMT2Ar AML比NUP98r更容易被Menin抑制剂推向边缘,因此作者假设,NUP98r白血病(以及可能其他伴有HOX上调的白血病)需要更高浓度的药物才能达到依赖阈值(图1C)。然而,白血病的基因组和功能异质性(在NPM1突变 R/R疾病中可能更明显)可能会影响对Menin抑制剂单药治疗的缓解率。虽然更高的浓度可能覆盖所有易感基因型,但它们也可能导致更多的靶向毒性,如骨髓抑制。这个模型,加上每种药物的药代动力学特性,或每种药物在染色质水平上的直接靶点结合,可以解释不同Menin抑制剂临床结果的变异性,并可能有助于未来按基因型开发此类药物。值得注意的是,分化综合征不一定与疗效相关,正如IDH抑制剂所证明的那样,对于Menin抑制剂而言,这一点也仍有待确定。抗白血病作用或疗效的最佳衡量标准是临床反应及其持久性,这是FDA用于监管批准的参数,除非开发出可靠的药效学标记物用于剂量优化。
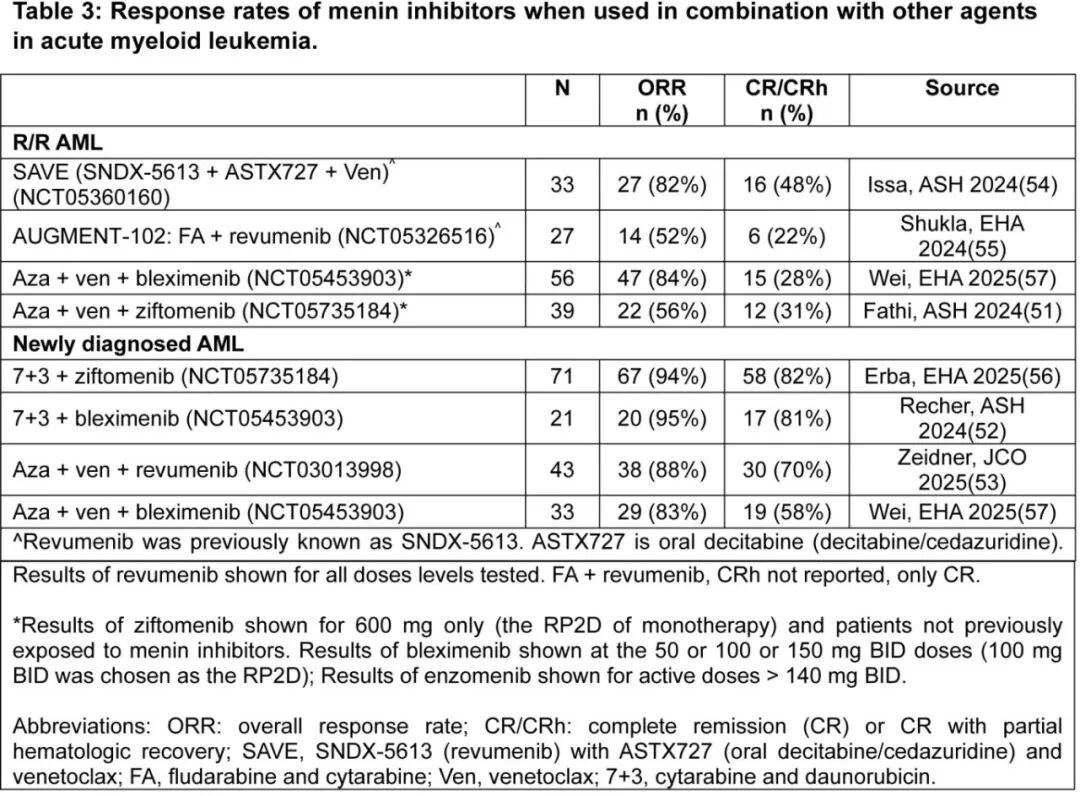
包括将Menin抑制剂加入标准化疗方案在内的联合治疗的早期结果很有希望,总结在表3,结果显示,与单药治疗相比的缓解率更高,且安全性可接受。然而,需要更长时间随访的完整结果来评估缓解深度及其持续时间。
不良事件
与Menin抑制相关的不良事件(AEs)可分为靶向(on-target;menin相关)或脱靶(off-target;小分子抑制剂相关)效应。总体而言,Menin抑制剂作为单药治疗导致严重AE的发生率相对较低。与现有的多药化疗相比,这些口服药物的耐受性大多更好。然而,值得注意的靶向毒性包括分化综合征(DS)和骨髓抑制。DS是由Menin抑制解除分化阻滞以及白血病细胞分化为正常造血细胞相关的细胞因子改变引起的,常见表现包括发热、关节痛、白细胞增多、体重增加、水肿、胸腔或心包积液,严重病例可出现呼吸或肾功能衰竭。在一些与Menin抑制相关的严重DS病例中,表现类似于高炎症状态或毛细血管渗漏综合征。各种Menin抑制剂的DS发生率在10%至30%之间,严重或≥3级事件发生率为12%至13%,DS相关死亡发生率低于1%。这导致FDA暂停了部分Menin抑制剂的临床试验,并修订了剂量递增方案或DS缓解策略。鉴于Menin抑制剂DS相关的潜在发病率和死亡率,需要早期识别并及时启动类固醇治疗。标准化疗与Menin抑制剂联合研究的早期结果显示,DS的发生率和严重程度有所降低,这可能是通过细胞减灭和杀死负责细胞因子失衡的分化细胞介导的,类似于在白血病联合治疗中观察到的其他分化剂的情况。在R/R急性白血病背景下,由于低血细胞计数可能与残留疾病或多线治疗后造血恢复缺陷有关,Menin抑制剂引起的骨髓抑制在1期临床试验中并未立即显现。发热性中性粒细胞减少的发生率在13%至64%之间,无论研究者是否将其归因于Menin抑制剂,≥3级血小板减少的发生率在21%至68%之间。这种变异性可能是由于研究中AE收集和记录方法不同所致,并且与AML R/R背景下其他药物研究中观察到的发生率并无不同,在这些研究中很难区分与潜在白血病相关的低计数还是治疗引起的骨髓抑制。基于小鼠模型的临床前研究,Menin缺失在稳态造血期间对外周血细胞计数的影响不大。然而,在该模型中,Menin在干细胞移植或化疗消融后的造血恢复过程中尤为重要。这可能表明,如果作为移植后维持治疗使用,或与化疗联合使用时,Menin抑制可能会影响血细胞计数恢复。因此,正在进行的Menin抑制剂联合研究应仔细选择剂量和时间表,以成功实施预期的治疗。
当前药物的脱靶不良事件包括revumenib引起的QT间期延长(≥3级:10%)和ziftomenib引起的瘙痒(1-2级:13%),这些均可控。因此,应按照revumenib说明书的指示监测心电图和电解质。其他可能发生但尚未在临床研究中证实的不良事件包括诱发多发性内分泌腺瘤病1型(MEN1)综合征的可能性,其中Menin起到肿瘤抑制作用,但可能需要更长的随访时间和更长的治疗持续时间,并且可能需要在内分泌腺发生第二次打击才能导致肿瘤形成。
耐药机制
尽管Menin抑制剂在KMT2Ar和NPM1突变急性白血病中显示出有希望的临床活性,但并非所有接受这类表观遗传疗法治疗的患者都能获得持久缓解。这部分归因于外在因素,例如急性白血病固有的克隆和突变异质性,但最近研究㛑强调了在治疗选择压力下出现的其他耐药机制。Perner等人确定了在AUGMENT-101试验中接受治疗、对revumenib单药治疗失去反应并获得了新型MEN1错义突变的患者,这些突变通过临床级靶向测序平台检测到(图2 A,B)。巧合的是,用于这些检测的MSK-IMPACT靶向测序 panel包含MEN1基因,因为已知其与遗传性癌症易感综合征(MEN1综合征)相关,从而能够无偏倚地发现该基因中的多种变异,这些变异不同于已知与MEN1综合征典型相关的突变。这些突变发生在残基M327、T349、G331和S160(图2B)。与此同时,采用了一种旨在对整个MEN1编码区引入C-to-T编辑的CRISPR碱基编辑器筛选,以鉴定对Menin抑制剂治疗敏感性和耐药性的遗传决定因素。引人注目的是,在用Menin抑制剂VTP-50469(revumenib的临床前类似物)处理的细胞中进行碱基编辑时富集的氨基酸残基,与在revumenib治疗患者中发现的大多数突变残基重叠。在细胞和生化测定中(最终在menin与药物复合的晶体结构中)对这些突变体的进一步表征证实,这些突变赋予了对整个Menin抑制剂类别的耐药性。耐药性是由menin蛋白药物结合口袋的扰动介导的,这种扰动仍然允许与KMT2A有额外的接触点,从而保留建立促白血病基因表达程序的致癌性menin-KMT2A相互作用(图2B)。
除了靶向测序 panel,Perner等人还采用了超灵敏数字PCR(ddPCR)检测来检测Menin抑制剂暴露前患者样本中的这些突变。值得注意的是,通过ddPCR在任何预处理样本中均未检测到这些耐药突变。虽然这些发现表明不存在预先存在的突变,但仍然有可能低频突变以低于检测灵敏度(可达10^-5)的频率发生。检测此类罕见突变等位基因的限制是由技术约束定义的,并可能随着未来开发出更强大和灵敏的测序平台而得到迭代解决。对在AUGMENT-101试验中接受至少两个周期revumenib治疗的患者样本进行了这些ddPCR检测,使得能够鉴定出31名患者中的12名(39%)存在获得性MEN1突变。然而,并非所有患者在检测到这些突变时都处于明显复发状态,这是由于该检测方法的高灵敏度。在用revumenib单药治疗的这一小部分患者中观察到的相对较高的突变频率,确实提供了关于该疗法的一些重要临床和生物学见解。白血病细胞在选择压力下必须突变MEN1的必要性验证了Menin作为一个真正的治疗机会,类似于针对EGFR、IDH1/2、BRAF和BTK等数十种其他FDA批准疗法所观察到的情况。然而,这些突变发展的相对迅速性表明,长期单药治疗在这种情况下可能并非可行的治疗方法。达到足够深度缓解的患者在可行时需要接受异基因干细胞移植巩固。或者,包含Menin抑制与其他方式(强化疗、去甲基化药物、靶向治疗等)联合的治疗方案可能足以预防或克服这些MEN1耐药突变的影响。新兴数据表明,可能存在其他MEN1突变,这些突变根据哪些氨基酸对它们与每种化学结构的相互作用最关键,而赋予对每种Menin抑制剂的耐药性(图2B)。因此,未来治疗获得性耐药患者时,Menin抑制剂的选择可以根据鉴定出的MEN1突变类型以及每种抑制剂相应的预测敏感性进行个体化治疗。
除了显著减弱药物-靶点结合亲和力的遗传性耐药机制外,还存在Menin抑制的非遗传性耐药(图2A)。Soto-Feliciano等人使用经Menin抑制剂处理或未处理的小鼠MLL-AF9白血病细胞进行了大规模CRISPR筛选,示了靶向KMT2C/D复合物成员(以前称为MLL3/4)的向导RNA富集,包括赖氨酸去甲基化酶UTX(也称为KDM6A)。Menin抑制导致KMT2C/D-UTX复合物重新分布到具有肿瘤抑制特性的基因上,导致这些基因去抑制。由于KMT2C/D-UTX失活而未能诱导这组基因与Menin抑制剂耐药相关,这种耐药可能通过CDK4/6抑制剂(如palbociclib)逆转。最近,Zhou, Zhang及其同事进行了更多以染色质为中心的CRISPR筛选,以描绘在很大程度上独立于典型KMT2A-menin靶基因的耐药通路。相反,他们发现一组非经典menin靶基因被活性和抑制性组蛋白修饰双重标记。Menin从这些区域的驱逐导致抑制性染色质调节因子(如Polycomb抑制复合物1(PRC1))的丢失,引起诸如MYC等基因的重新表达,从而驱动对Menin抑制的耐药性。
总而言之,这些研究强调了具有高HOX表达的急性白血病对menin-KMT2A复合物维持其分化阻滞和增殖潜力的强烈依赖性。这些白血病可以在选择压力下利用多种遗传和非遗传耐药机制来调节基因表达。虽然Menin抑制剂单药治疗已在复发/难治性环境中展示了临床获益的潜力,但联合治疗对于增强这些反应的深度和持久性至关重要,特别是对于不适合移植的患者。
将Menin抑制剂纳入标准治疗
来自Menin抑制剂用作单药的临床试验的累积证据证明了其稳健性,以及menin-KMT2A相互作用在多种白血病基因型中的关键作用。然而,如前所述,在R/R环境中对Menin抑制剂单药治疗的反应是短暂的,中位缓解持续时间约为6个月。与其他靶向药物一样,在更早的治疗线中使用Menin抑制剂可能携带较低的克隆演变机会,并可能改善结局,但最终目标是治愈,而将Menin抑制剂纳入联合方案是未来的方向。
Menin抑制剂靶向的主要AML基因型是NPM1突变或KMT2Ar急性白血病。鉴于KMT2Ar的较低发病率(估计占新诊断AML的5%),以及NPM1突变和KMT2Ar在标准治疗后结局的差异(NPM1突变预后良好,而KMT2Ar则不然),设计随机临床试验来测试加入Menin抑制剂可能具有挑战性。采用高强度治疗的NPM1突变AML结局相对较好,5年总生存率约为60%。因此,设计临床试验来测试在标准高强度化疗中加入Menin抑制剂,并以总生存期为主要终点,将需要大量患者并需要很长时间才能得出结果。最能说明这个问题的最佳研究是AMLSG 09–09随机研究,该研究评估了在新诊断NPM1突变AML中将抗体-药物偶联物gemtuzumab ozogamicin加入强化疗的效果。GIA研究招募了600名参与者,耗时7年完成招募,并耗时13年解释总生存期的主要终点。该研究的治疗组之间没有差异,标准组的2年总生存率为69%(范围63-74),gemtuzumab ozogamicin组为73%(范围68-78)(P=0.43)。
使用替代的早期终点可能有助于设计类似的Menin抑制剂试验。并且与其他AML亚型不同,NPM1突变亚型有充分的证据表明分子MRD检测的重要性及其对长期生存的影响。NPM1突变是白血病的起始事件,与疾病同义,而非白血病前期状态,在整个疾病过程中保持稳定(除了5-10%的病例在复发时丢失NPM1突变)。经过两个疗程的强化疗后,通过逆转录定量聚合酶链反应(RT-PCR)在外周血中测量NPM1突变(灵敏度为10^-5)的MRD阴性是OS的主要决定因素,独立于所有其他辅助因素。因此,目前的证据支持在NPM1突变AML中使用分子MRD作为OS的替代标记物。
然而,从AMLSG 09–09研究中可以学到的另一个教训是,添加gemtuzumab ozogamicin降低了复发风险,然而在老年患者中未观察到该获益,反而毒性增加。者得出结论,重复给予gemtuzumab ozogamicin可能过于强化。因此,未来研究调查添加Menin抑制剂应依赖于替代的早期终点,但也应仔细选择剂量和方案,以防止过度毒性,从而抵消MRD清除对OS的影响。
研究在高强度或低强度化疗中添加Menin抑制剂的1期联合临床试验的新兴结果看起来很有希望(表3)。值得注意的是,BCL2抑制剂维奈克拉与Menin抑制剂之间的高度协同作用在多项研究中都很明显,并得到联合指数和强大临床前数据的支持。例如,对于R/R AML,revumenib联合口服地西他滨和维奈克拉(SAVE研究)的总缓解率(ORR)为82%,而revumenib联合氟达拉滨和阿糖胞苷(AUGMENT-102)的ORR为52%。重要的是要注意,在AUGMENT-102上治疗的大多数患者曾在基于阿糖胞苷的化疗后失败,这可以解释这一发现,并且这种推测受到单臂跨试验比较中许多混杂因素的限制。
在更早的治疗线中评估Menin抑制剂的一个特殊机会可以通过干预MRD和预防复发来实现,这可以最小化需要治疗的患者数量(图3A)。然而,这些研究面临一些挑战,与NPM1突变或KMT2Ar AML中MRD可能短暂存在有关,除非使用敏感的分子方法进行检测,否则明显复发的时间可能很快。除了降低复发风险外,在异基因干细胞移植后添加Menin抑制剂作为维持治疗可能很有前景,并且值得临床研究,因为Menin抑制剂除了直接靶向残留疾病外,还可能通过上调MHC I类和II类表达从而逆转免疫逃逸来增强移植物抗白血病效应(图3A)。
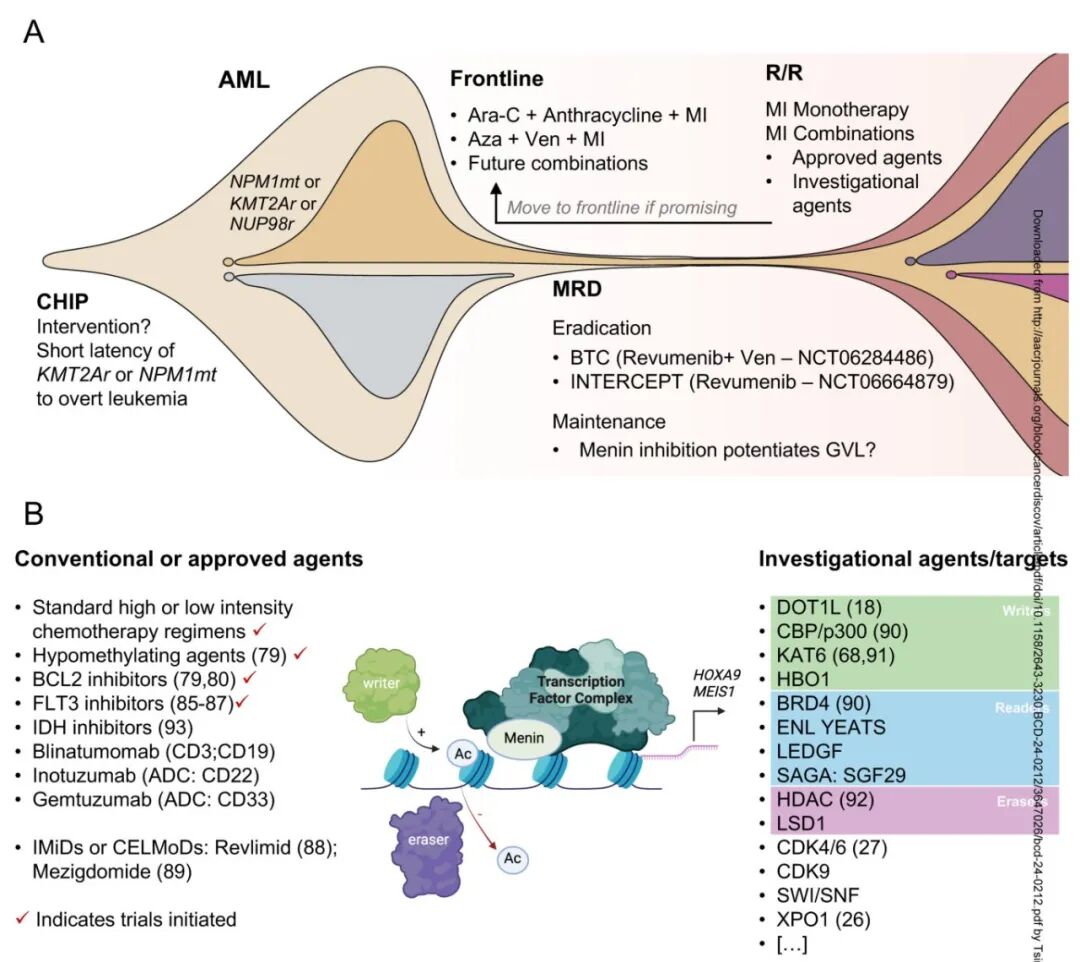
图3:Menin抑制剂联合策略。
A.急性髓性白血病患者疾病背景下 menin 抑制剂的实施。虽然在复发/难治性背景下开始了 menin 抑制剂单药治疗的初步临床研究,但在克隆异质性或可塑性较低的病程早期移动该靶向治疗,联合治疗可能使临床获益最大化。
B.具有 menin 抑制的潜在联合策略列表。
如前所述,Menin抑制剂靶向由KMT2Ar或NPM1突变引起的急性白血病中HOX基因的异常表达。然而,这种异常基因表达也越来越多地被其他罕见基因型所共享,包括急性髓系或淋巴系白血病,这些基因型总共占AML的60%,包括具有核孔蛋白98基因(NUP98)重排、脑膜瘤1基因(MN1)融合或上游结合转录因子(UBTF)串联重复(TD)的白血病。其中许多异常,如NUP98r或CALM::AF10,在急性淋巴细胞白血病(ALL)中虽然较少见,但也有发现,并且与对当前可用疗法的耐药性相关。识别共同的靶向机会可以扩大靶向治疗(如Menin抑制剂)的应用范围,基于基因表达的研究可以被设计来测试Menin抑制剂在更大急性白血病亚组中的益处。一项评估revumenib在具有这些与HOX上调相关的各种基因型的R/R急性白血病中的研究目前正在进行中(NCT06229912)。
联合策略
大多数成功从临床前环境转化并随后改善结局的癌症治疗联合策略具有以下共同特征:(1)单药活性;(2)非重叠的作用机制、毒性和耐药性;(3)药物相加性或协同性,但可能存在争议,因为患者对单一药物的反应存在变异性,而联合治疗主要给每个患者提供更多一种药物可能有效的机会; (4)明确阐明的作用机制;(5)联合方案克服耐药机制的能力;(6)可接受的治疗窗,允许在减轻毒性的同时进行有效的剂量调整;(7)靶向癌症起始克隆以及亚克隆,而非仅对亚克隆群体有效的疗法;(8)适应性疗法,更能抵抗克隆演变,例如可能导致抗原扩散和产生有效记忆免疫细胞的免疫疗法。因此,有前景的临床前联合研究结果应通过这些原则的视角来看待。此外,稳健且可重复的数据为成功的临床转化提供了更多信心。无论耐药机制如何,联合策略可以通过靶向对不同联合组分敏感的各种克隆来进一步减少白血病负荷,从而减少经历Menin抑制(或任何疗法)选择压力的残留细胞池,从而降低耐药风险。许多在临床前与Menin抑制剂联合测试的药物已经用于标准临床实践,而一些与新型研究性药物的联合基于临床前证据也显得有前景(图3B)。
Menin和BCL2抑制的联合符合许多这些原则。KMT2Ar或NPM1突变白血病通过BCL2抑制高度易感于诱导凋亡。双重BCL2和Menin抑制在这些白血病亚型的临床前模型中导致协同活性。在一个NPM1突变模型中,revumenib和维奈克拉对白血病亚群发挥不同的作用,其中BCL2抑制剂维奈克拉优先靶向干细胞和祖细胞亚群,而Menin抑制剂revumenib优先靶向 common 髓系祖细胞亚群,双重BCL2和Menin抑制清除了 bulk 以及干细胞或祖细胞,从而显著改善了这些临床前模型的生存期。来自多项使用多种Menin抑制剂与去甲基化剂和维奈克拉联合研究的新兴临床数据显示出高缓解率(表1)。
Fms相关酪氨酸激酶3基因(FLT3)的突变通常与这些对Menin抑制敏感的基因型共存。FLT3是一种3型受体酪氨酸激酶,在多能造血祖细胞的扩增中起重要作用。FLT3配体与该受体结合导致受体同源二聚化、自身磷酸化,并通过RAS/MAPK、JAK/STAT5和PI3K/AKT通路转导促生存和增殖信号。FLT3突变产生自发二聚化(绕过配体介导的激活)的蛋白质,导致白血病细胞的因子非依赖性生长和增殖。LT3抑制剂现已成为AML治疗的标准方案,可改善反应和生存。然而,单药FLT3抑制无法获得长期缓解,表明需要与这些药物联合的策略。FLT3是HOX基因的DNA结合辅因子MEIS1的一个推定的转录靶点,而MEIS1的表达依赖于menin-KMT2A相互作用,Menin抑制导科致FLT3的转录抑制。在具有FLT3共突变的KMT2Ar、NPM1突变或NUP98r白血病模型中的临床前数据显示了联合Menin和FLT3抑制的协同作用,导致深远的抗白血病效应(图3B)。这些发现已得到多项独立研究的证实,使用了各种小分子抑制剂或这些基因的基因敲低,在细胞系、人类白血病样本和患者来源异种移植(PDX)中均如此,因此证明了这些数据的稳健性和转化为临床成功的高可能性。
在联合FLT3和Menin抑制的基础上添加BCL2抑制在PDX模型中进一步改善了这种抗白血病效应并提高了生存期。因此,包含FLT3和Menin抑制的联合策略可能非常有前景,并且许多测试该联合方案的临床试验已经启动。
Menin抑制剂作为表观遗传疗法的成功可能归因于将染色质复合物从关键致白血病基因驱逐出去,从而导致相对快速的反应,这与例如依赖酶抑制且需要更长时间反应的DOT1L抑制剂等其他表观遗传疗法不同。然而,在临床中观察到的适度活性可能与DOT1L抑制剂Pinometostat(EPZ-5676)特定的不利药代动力学特性有关,而针对DOT1L的新型改进抑制剂已被确定。鉴于表观遗传可塑性和白血病对其他关键表观遗传因素的依赖性,与其他表观遗传药物的联合策略可能是一个有吸引力的策略。多项临床前研究证明了Menin与DOT1L抑制剂或CBP/p300抑制剂之间的协同作用。最后,使用基因组规模的功能性遗传筛选,转录因子IKAROS被确定为KMT2Ar AML中的一个必需转录因子,它维持致白血病基因表达,同时抑制肿瘤抑制、免疫调节和细胞分化的通路。在临床前模型中,Menin抑制剂与cereblon E3连接酶调节剂(CELMoD)mezigdomide(可有效导致IKAROS蛋白降解)的联合,预防并克服了MEN1突变异种移植瘤中的耐药性,因此可能是另一个值得临床研究的有吸引力的策略。
总结
总之,详细的机制研究为Menin抑制剂进入标准临床实践铺平了道路,新兴的可靠临床数据显示了多种小分子抑制剂在多个急性白血病亚组中的疗效。除了这些药物的临床疗效外,靶向耐药的出现凸显了menin-KMT2A相互作用在该疾病最大部分的白血病发展中的关键作用。,从而支持在临床环境中继续靶向这种相互作用,以及需要策略来降低耐药风险。在疾病进程早期、在无约束的克隆演变和可塑性发展之前纳入Menin抑制剂,可能会提高缓解率及其持久性。未来的Menin抑制剂可以合理设计以绕过常见的药物结合位点突变,并进一步提高结合亲和力和效力。
分化综合征是Menin抑制剂单药治疗发生的主要靶向不良事件。虽然大多可管理,但需要更好的临床工具来监测和治疗严重的分化综合征病例。然而,来自Menin抑制剂联合治疗的新兴数据表明,伴随的细胞毒性治疗降低了分化综合征的发生率和严重程度。目前正在计划多种与Menin抑制剂的联合策略,结果备受期待。最终,成功实施这些联合方案需要仔细选择所涉及药物的剂量和时间表,以转变当前的治疗模式,并为急性白血病提供更安全、更有效的治疗方案。
参考文献
Blood Cancer Discov . 2025 Sep 3. doi: 10.1158/2643-3230.BCD-24-0212.


