MYB/MYBL1融合阴性头颈腺样囊性癌检出ERCC2胚系突变和BRCA2体系突变,潜在获益精准治疗
时间:2025-08-27 12:09:40 热度:37.1℃ 作者:网络
腺样囊性癌(AdCC)是一种侵袭性头颈部恶性肿瘤,其特征为生长不可预测、广泛的神经周围浸润、高转移率和低生存率。目前已发现的遗传改变包括MYB-NFIB和MYBL1-NFIB融合,以及Notch信号通路和DNA损伤修复通路内的突变。一名 58 岁女性在体检时发现前颅窝底占位性病变,并于 2022 年 7 月寻求进一步诊治。在本病例中,该 58 岁女性在常规体检时偶然发现前颅窝病变,术后经免疫组织化学检查确诊为AdCC。结合影像学和组织病理学检查结果,确诊为AdCC。整合基因检测结果后,该病例被诊断为MYB或MYBL1融合阴性AdCC。本病例报告强调了在缺乏MYB或MYBL1融合的情况下,AdCC中ERCC2和BRCA2失活这一罕见分子特征。患者在术后约 2.5 个月接受了原发部位的术后放疗(RT)。ERCC2胚系突变和BRCA2体细胞突变的同时存在为这种罕见恶性肿瘤的潜在治疗策略提供了新见解。截至目前,随访期间未观察到复发。本文在一名AdCC患者中发现了新的ERCC2胚系突变和BRCA2体细胞突变。研究结果扩展了罕见MYB或MYBL1融合阴性AdCC患者的分子图谱,并为这种罕见头颈部肿瘤提供了潜在的治疗策略。

背 景
腺样囊性癌(AdCC)是一种发生于头颈部的侵袭性癌,其特征为生长不可预测、广泛的神经周围浸润、高转移率,以及由此导致的低生存率。手术干预和放疗是AdCC的主要治疗策略,化疗、靶向治疗和免疫治疗也被用于提高患者生存率。在遗传学上,MYB-NFIB和MYBL1-NFIB改变是AdCC中常见的分子事件,在 16%-100% 的病例中被发现,针对这些改变的临床前研究显示出良好前景。此外,随着全外显子测序的广泛应用,Notch信号通路和DNA损伤修复(DDR)通路的分子突变已被发现。AdCC尚未发现明确的遗传易感基因。然而,BRCA1/2胚系突变和参与DNA双链修复的基因可能增加AdCC的发病风险。癌症风险基因突变与AdCC之间的关联值得进一步研究。在个性化医疗时代,确定能够指导治疗决策的综合分子图谱至关重要。本文报告了 1 例AdCC患者中存在新的ERCC2胚系突变和BRCA2体细胞突变,丰富了AdCC的突变图谱,并为精准治疗提供了见解。
病 例
患者女,58 岁,在体检时发现前颅窝底占位性病变(图1A),并于 2022 年 7 月寻求进一步诊治。随后,她在全身麻醉下接受了颅内手术(图1B)。术后免疫组织化学检查显示,肿瘤组织中CK5/6、CK7、CD117、P63、S-100、CKpan和SMA标志物呈阳性,Syn和GFAP呈阴性。此外,肿瘤细胞的Ki-67标记指数为 5%。基于这些影像学和组织病理学检查结果,确诊为腺样囊性癌(AdCC)(图1C)。患者在术后约 2.5 个月接受了原发部位的术后放疗(RT)。截至目前,随访期间未观察到复发。
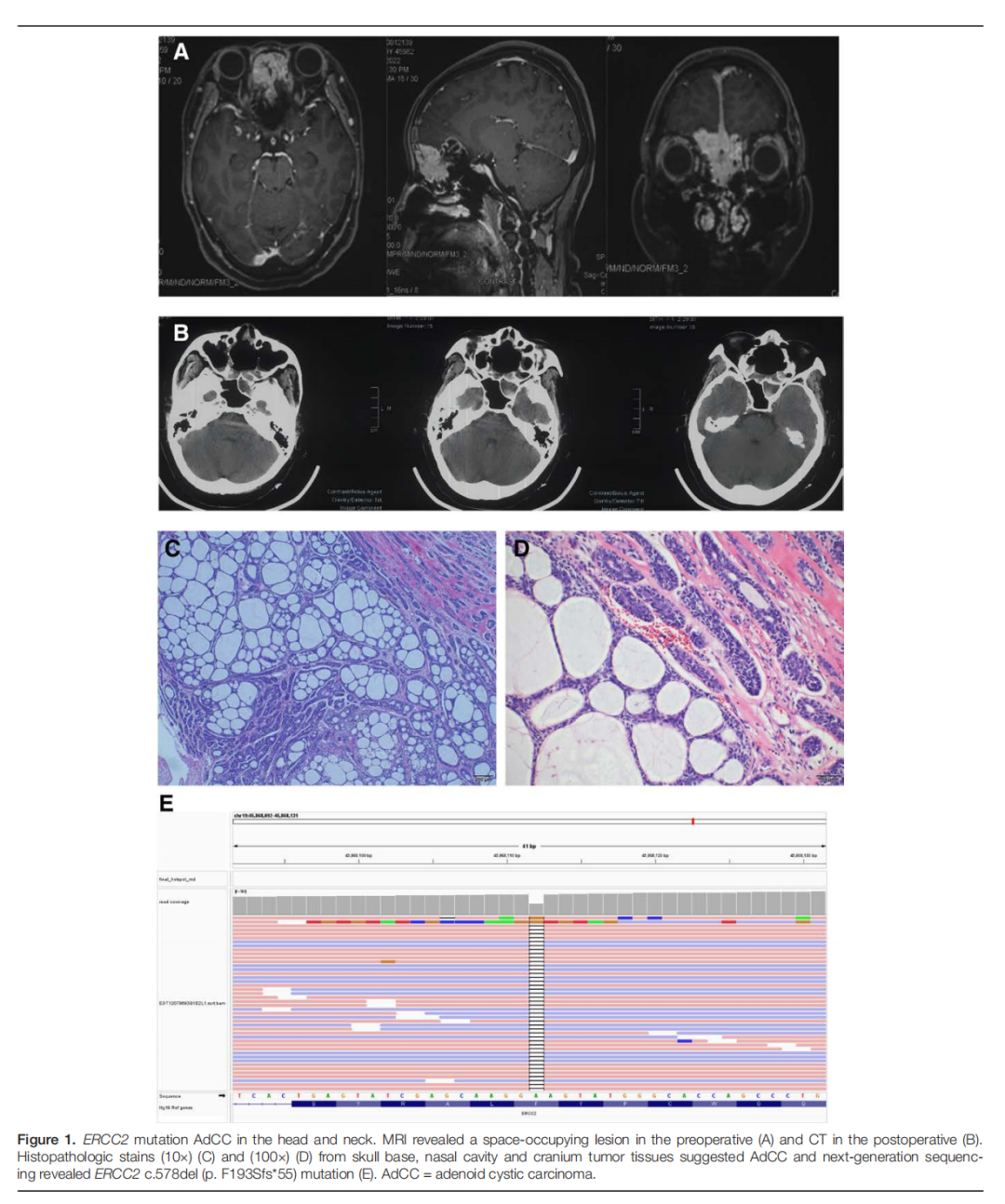
▲图1 头颈部ERCC2突变AdCC
为确定降低术后高复发率的潜在治疗靶点,患者接受了肿瘤样本和配对血液样本的全外显子测序。基因组分析发现了潜在的致癌基因突变,包括BRCA2基因c.9097del(p.T3033Lfs29)体细胞突变(等位基因频率2.37%)、ERCC2基因c.578del(p.F193Sfs55)胚系突变(等位基因频率48.3%),以及肿瘤样本中MYC(拷贝数:3.27)、CDK4(拷贝数:3.03)的基因扩增。在配对血液样本中,ERCC2基因c.578del(p.F193Sfs*55)被确定为胚系可能致病性变异(图1D)。ERCC2基因c.578del突变发生在7号外显子,位于解旋酶ATP结合域内。该突变可能导致193位编码氨基酸发生移码,从而影响蛋白质功能(UniProt.org)。该变异在gnomAD等人群数据库中不存在,也未在文献中报道。然而,其他移码突变如NM_000400.4(ERCC2):c.2006_2007insA(p.Lys671fs;图1E)在Clinvar中被记录为致病性变异(变异ID:1028729),且ERCC2基因的功能缺失变异被认为具有致病性。此外,未检测到MYB或MYBL1融合。本病例揭示了AdCC中ERCC2失活与BRCA2失活共存的罕见分子特征。
讨 论
腺样囊性癌(AdCC)是一种罕见、隐匿且高度复发性的头颈部恶性肿瘤,目前尚未发现有效的系统治疗方法。AdCC的致癌机制已逐渐阐明,主要涉及MYB家族基因的易位[3]。尽管临床研究显示,有无MYB或MYBL1融合的AdCC患者总生存期(OS)无显著差异,但基因组分析有助于探索AdCC诊断和潜在治疗中通路与靶基因之间的联系。我们报告了一例罕见的AdCC病例,该病例同时存在胚系ERCC2突变和体细胞BRCA2突变,且与MYB或MYBL1融合互斥。
ERCC家族包含4个核心肿瘤相关基因(ERCC2、ERCC3、ERCC4、ERCC5),ERCC2编码的XPD蛋白作为转录因子IIH(TFIIH)复合物的解旋酶亚基,是DNA损伤验证所必需的。ERCC2作为核苷酸切除修复(NER)通路的调控因子,负责修复由环境诱变剂、紫外线照射和某些化疗药物引起的大块DNA损伤。ERCC2作为ATP依赖的5’至3’解旋酶,可解开受损DNA,以利于其他参与后续修复的NER因子接近。ERCC2的杂合胚系突变已在肺腺癌和隆突性皮肤纤维肉瘤中被报道。本文病例是AdCC中ERCC2胚系变异的首次报道,目前尚不确定该突变是否直接与AdCC的遗传易感性相关,这需要更多的临床和基础研究支持,但本病例为MYB或MYBL1融合阴性AdCC提供了全面的分子特征分析。
BRCA2在同源重组介导的DNA修复中具有特别重要的功能。尽管已有相关病例报道,但ERCC2功能缺失突变与AdCC的风险关联尚不明确。临床前和临床研究已将ERCC2功能缺失与顺铂敏感性相关联。研究报道,具有BRCA1/2或ERCC突变等DNA损伤修复(DDR)功能障碍的泛癌种患者在接受免疫检查点抑制剂治疗后总生存期更好。对于DDR相关突变,PARP抑制剂可能对AdCC有效,但目前尚无相关报道。因此,研究人员有理由认为ERCC2可能是AdCC的潜在治疗靶点。
本文在 1 例腺样囊性癌(AdCC)患者中发现了新的胚系ERCC2突变和体细胞BRCA2突变。本研究结果扩展了罕见的MYB或MYBL1融合阴性AdCC患者的分子图谱,并为此类罕见头颈部肿瘤提供了潜在的治疗策略。
实体瘤全外显子组基因检测、实体瘤1299基因检测项目(NGS方法学),均覆盖了ERCC2基因全编码区(CDS),辅助临床精准诊疗。实体瘤1560基因融合RNA检测(NGS方法学)可检测MYB/MYBL1融合在内超过1560种已知和未知融合变异,能够满足患者的基因融合变异检测需求,辅助临床精准诊疗。
参考文献:
Liu, Yuanhao MSa; Han, Tiantian MSb; Guo, Didi MSc; Chen, Dongsheng PhDb; Li, Yunqian MDa,*. Exploring potential treatment opportunities in a head and neck tumor patient with AdCC: A novel germline ERCC2 mutation case report. Medicine 104(1):p e41233, January 03, 2025. | DOI: 10.1097/MD.0000000000041233


