Frontiers in Immunology:局部晚期鼻咽癌有新招?特瑞普利单抗联合方案II期试验,聚焦3年无进展生存
时间:2025-09-08 12:15:50 热度:37.1℃ 作者:网络
鼻咽癌是一种起源于鼻咽部上皮细胞的恶性肿瘤,尤其常见于罗森穆勒窝,其地理分布特征显著,与EB病毒(EBV)感染密切相关,且对放射治疗高度敏感。2022年全球新发鼻咽癌病例约12万例,高发地区主要集中在华南、东南亚和北非。超过70%的患者在初诊时已处于局部晚期阶段(LANPC),其标准治疗为同步放化疗(CCRT)。近年来多项大规模随机临床试验表明,诱导化疗联合同步放化疗(IC+CCRT)可显著提高肿瘤缓解率和长期生存率,因此被多个临床指南推荐为局部晚期鼻咽癌的标准治疗方案。其中,吉西他滨联合顺铂(GP方案)作为诱导化疗方案显示出良好的疗效和耐受性。然而,即便采用IC+CCRT策略,仍有部分患者出现复发或转移,因此亟需探索新的治疗模式以进一步提升疗效。

免疫治疗因其独特的病原学和免疫学背景,在鼻咽癌治疗中展现出显著潜力。非角化性鼻咽癌与EBV感染密切相关,病毒编码的潜伏蛋白和抗原表达增强了肿瘤的免疫原性,为免疫治疗提供了理论依据。此外,鼻咽癌肿瘤微环境中程序性死亡配体1(PD-L1)表达水平较高,尤其在浸润免疫细胞中,这使得PD-1/PD-L1阻断成为一种合理的治疗策略。肿瘤浸润淋巴细胞(TILs),尤其是CD8+ T细胞的高密度浸润,进一步支持了免疫激活的可能性。多项临床试验已探索了PD-1抑制剂与放化疗的不同组合模式,包括辅助免疫治疗、“夹心式”治疗(诱导+辅助免疫治疗)以及全程免疫治疗,部分研究显示出良好的疗效,但最佳联合方案尚未明确。
特瑞普利单抗是一种人源化抗PD-1单克隆抗体,已于2021年11月在中国获批用于复发或转移性鼻咽癌的一线治疗,其疗效基于III期JUPITER-02试验的结果。本研究旨在探索在诱导化疗和同步放化疗阶段加入特瑞普利单抗是否能够进一步提高局部晚期鼻咽癌患者的疗效,并评估其安全性。该联合模式在既往随机试验中尚未被系统评估。
本研究是一项单盲、多中心、随机、II期临床试验,旨在评估特瑞普利单抗联合诱导化疗及同步放化疗,并在放疗后追加两个周期免疫治疗的疗效与安全性。研究采用分层区组随机化方法,按年龄(≤60岁 vs. >60岁)、性别(男 vs. 女)和AJCC分期(III期 vs. IVa期)进行分层。患者对治疗分组设盲,研究者非盲以便进行安全性管理和方案调整。为控制偏倚,设立独立的终点评审委员会(IERC)对影像学终点进行盲态评估,数据与安全监查委员会(DSMB)由肿瘤内科、放射肿瘤科、免疫学和生物统计学专家组成,定期审查安全性数据,特别是免疫相关不良事件(irAEs),并有权根据预设安全规则建议试验修改或终止。该研究经四川省肿瘤医院伦理委员会批准(批件号:KY-2021-113),并在中国临床试验注册中心注册(注册号:ChiCTR2200055494),于2023年1月在16个医疗中心启动。
入选标准包括经组织学确认的III–IVa期鼻咽癌(AJCC第8版)、年龄18–70岁、Karnofsky功能状态评分(KPS)≥70、未接受过免疫治疗、无活动性自身免疫病、器官功能良好。排除标准包括既往头颈部癌症治疗史、活动性感染或严重系统性疾病、妊娠或哺乳等。筛选阶段在入组前0–14天进行,包括签署知情同意书、收集病史、体格检查、影像学评估(鼻咽颈部MRI、胸部CT、腹部超声、全身骨显像或替代性PET/CT)、实验室检测(EBV DNA、血常规、生化、凝血功能等)及肿瘤组织PD-L1表达检测。
患者按1:1随机分入实验组或对照组。两组均接受诱导化疗(吉西他滨1000 mg/m² d1,8 + 顺铂80 mg/m² d1,每3周一次,共2周期)和同步放化疗(顺铂100 mg/m² 每3周一次,共3周期;放疗总剂量≥70 Gy,分7周完成)。实验组在诱导和同步阶段加用特瑞普利单抗(240 mg,每3周一次),放疗后再追加2周期,总计7周期;对照组则使用安慰剂替代。治疗结束后,患者在第一年每12周(±7天)进行一次肿瘤评估,之后2年每3个月一次,第3至5年每6个月一次,之后每年一次。评估内容包括鼻咽颈部增强MRI、胸部CT、腹部超声、鼻咽镜、EBV DNA检测、外周血淋巴细胞亚群分析、生存状态、后续治疗及生活质量记录。
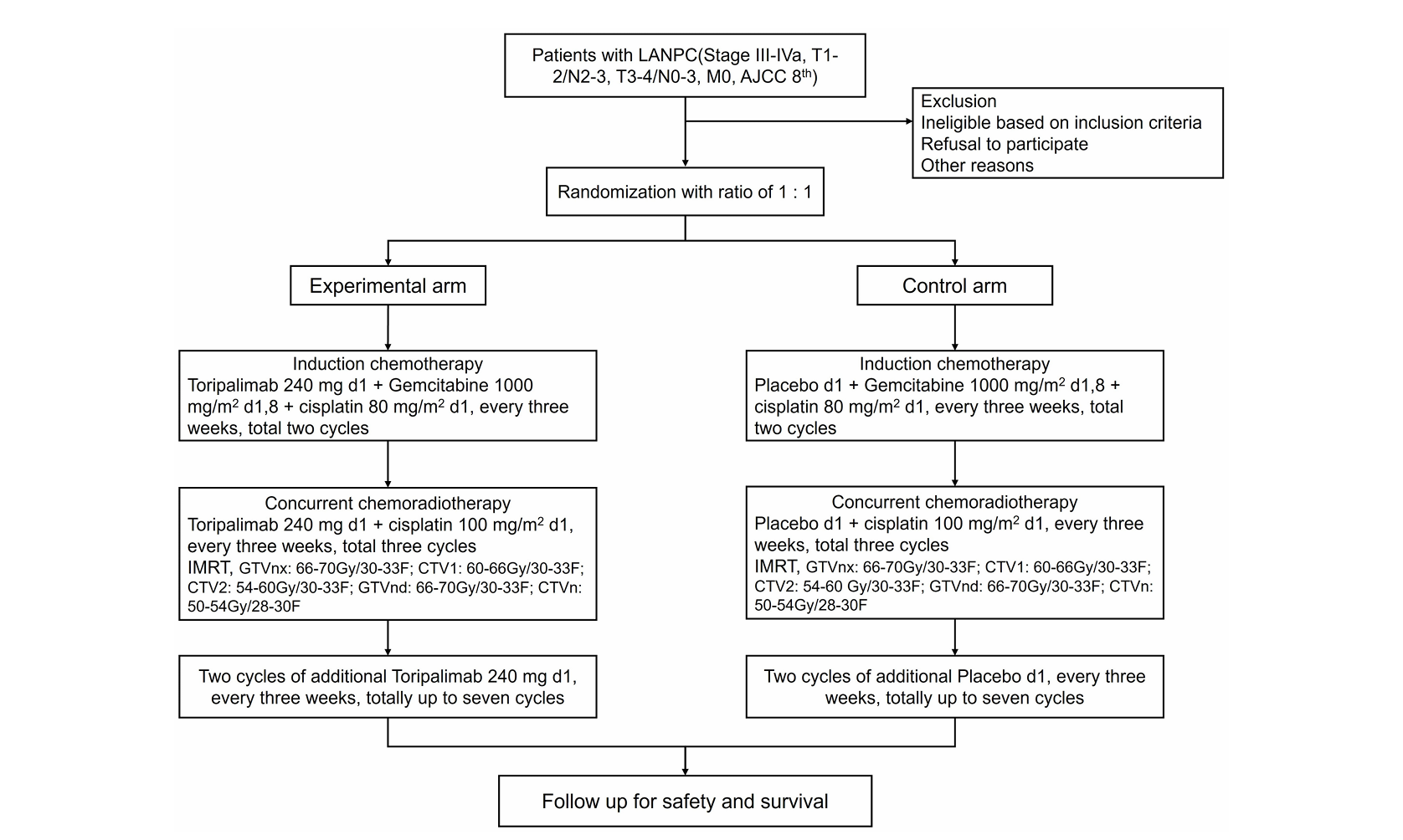
图1 研究流程图
主要终点为3年无进展生存期(PFS),定义为从随机化至疾病进展(RECIST 1.1)或任何原因死亡的时间。次要终点包括总生存期(OS)、客观缓解率(ORR)、EBV DNA动态变化、淋巴细胞亚群变化及安全性。安全性评估依据CTCAE v5.0标准,特别关注irAEs如肺炎、肝炎和结肠炎。鉴于EBV感染与鼻咽癌的关联,研究还加强了EBV DNA拷贝数监测(每2周期一次)、基线自身抗体检测(如ANA、抗dsDNA、抗甲状腺球蛋白)以及发生≥3级irAEs时的炎症细胞因子谱分析(如IL-6、IFN-γ、TNF-α)。irAEs管理遵循NCCN指南:1级密切观察,继续免疫治疗;2级暂停免疫治疗直至降级并给予对症药物;3–4级永久停用免疫治疗,采用大剂量静脉皮质类固醇并逐渐减量,危及生命时及时重症监护。若任一治疗组3–4级irAEs发生率超过30%或危及生命的irAEs超过5%,DSMB将立即审查并可能建议中止试验。
样本量计算基于文献数据,对照组3年PFS率约为80%,实验组预期为90%。设入组期24个月、随访36个月、年脱落率5%,需招募154例患者(每组77例),以单侧显著性水平0.025、检验效能90%进行优效性检验。统计分析采用全分析集(FAS)、符合方案集(PPS)和安全集(SS)。连续变量以均值±标准差描述,组内比较用配对t检验,组间比较用ANOVA(调整中心效应);分类变量以频数描述,组间比较用卡方检验。生存分析采用Kaplan-Meier法和log-rank检验,若发生≥30起事件则用Cox比例风险模型估计风险比(HR),ORR比较采用卡方检验,若存在协变量不平衡则采用精确逻辑回归。所有分析使用SPSS软件,双侧检验,P<0.05为显著。
数据通过电子病例报告表(eCRF)收集,源文件(影像报告、实验室结果)上传并中央核验。参与者分配唯一编码标识,个人信息匿名化处理。研究人员完成CRF填写,经培训后授权访问数据库。数据监查委员会(DMC)审核eCRF完整性与一致性,发现缺失或不一致数据时发出电子查询,研究人员需在限期内通过源数据验证、修正或说明解决。未解决的查询上报主要研究者(PI)和中央管理团队,最终数据库在所有查询解决后锁定。
该研究是首项评估特瑞普利单抗在诱导和同步放化疗阶段联合应用疗效与安全性的随机对照试验。相较于既往研究,本方案免疫治疗周期数最少(仅7周期),主要集中在诱导和同步阶段,放疗后仅追加2周期单药免疫,既提高了治疗可及性,也降低了患者的 logistical 和经济负担。类似设计的研究如NCT04446663和NCT03619824样本量较小、非安慰剂对照、且主要终点为安全性,其结果尚未公布。本研究结果将为局部晚期鼻咽癌的免疫联合放化疗策略提供重要证据,尤其关注EBV相关免疫失调可能带来的非典型irAEs,并通过强化监测和管理措施确保安全性。然而,作为II期研究,样本量可能不足以检测OS或罕见不良事件的差异;单盲设计可能引入性能偏倚;结果在中国高EBV感染人群中的推广性也需进一步验证。未来需开展更大规模、多族群的III期试验以确认临床获益。
原始出处:
Jia H, Wang J, Zhang L, Li H, Du Y, Luo W, Wei Z, Wang X and Wang W (2025) Short-course PD-1 blockade in locally advanced nasopharyngeal carcinoma: a phase II randomized trial protocol (Tori-013). Front. Immunol. 16:1633243. doi: 10.3389/fimmu.2025.1633243
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。


