单克隆抗体分析工具:色谱法
时间:2025-09-08 12:16:40 热度:37.1℃ 作者:网络
引言
在单克隆抗体药物开发过程中,会经历各种各样的降解和修饰途径,比如氧化、聚集、脱酰胺化等等,需要我们时刻关注。每个抗体都有自己的目标产品概况,也就是它最终要达到的那个理想状态。而我们的制剂开发,就是要找到一个合适的配方,让这个抗体能够稳稳地达到并保持这个目标状态。怎么知道稳不稳定呢?这就得靠各种分析方法来评估它的稳定性,然后才能给它定个保质期。
说到单克隆抗体的分析工具,色谱法绝对最常用的工具之一,特别是HPLC和升级版的UHPLC。它们就是精密的蛋白质探测器,可以发现那些化学上的小变化,比如哪里被氧化了,哪里脱酰胺化了,或者电荷发生了什么变化。这些变化通常会影响蛋白质的极性或电荷,可以被HPLC检测到。那如果蛋白质不是自己发生变化,而是跟别人抱团,形成了聚集物呢?这时候就得靠另一种色谱技术,尺寸排阻色谱SEC来分析了。它能根据分子的大小把它们分开,告诉我们样品里到底有多少单体、二聚体、三聚体,甚至更大的团块。接下来,我们就具体看看这些色谱方法是怎么工作的。
尺寸排阻色谱
尺寸排阻色谱,简称SEC。它的主要任务是给蛋白质测尺寸。想象一下,柱子里填满了带孔的小珠子,就像一个筛子。蛋白质分子进来后,如果个头太大,钻不进孔里,就只能在表面溜达,跑得快;如果个头小,能钻进孔里,甚至钻得越深,被卡住的时间就越长,跑得就慢。通过比较不同已知大小的标准品跑多快,我们就能估算出样品中蛋白质的表观分子量。但是要注意,SEC认的是蛋白质的流体力学体积,也就是它在水里时占的空间大小,而不是它真实的分子量。如果你用一堆标准的球形蛋白来校准,去测量一个长得像麻花一样的蛋白质,那结果肯定不准。所以,用SEC测分子量,尤其是对于那些长得不规则的蛋白,得打个问号。
为了解决SEC测分子量不准的问题,科学家们想了个办法,给它装上眼睛,光散射检测器。它能在蛋白质跑出来的时候直接测量它的实际分子量,不再依赖于那些球形标准品,算是对形状依赖性的一个重大改进。但是,在使用SEC这种方法分析的时候,还是会遇到一些挑战。比如蛋白质有时候不太听话,喜欢粘在柱子上,这就叫非特异性吸附,导致结果偏低。虽然可以用一些小技巧比如加点异丙醇或者盐来减少粘连,但这又可能影响蛋白质在水溶液里的真实行为。还有,不同的抗体在低盐环境下表现还不一样,有的会跑歪,有的峰形会变得很难看。另外,蛋白质在柱子里被稀释了,如果它本身在不同浓度下会抱团或散开,那测出来的结果就可能不是原始高浓度样品的真实情况了。更别提,有些特别大的聚集物可能在过滤样品时就被拦在外面了,导致我们少算了聚集物的比例。所以,光看SEC还不够,还得用别的方法比如生物物理方法来交叉验证,确保SEC测量的准确性。
离子交换色谱
离子交换色谱,简称IEX。它是专门根据蛋白质表面带的净电荷多少来进行分离。在特定的pH环境下,蛋白质上的氨基酸残基会带上正电荷比如赖氨酸、精氨酸、组氨酸或者负电荷比如天冬氨酸、谷氨酸。IEX柱子内部预先固定了带相反电荷的基团,比如阳离子交换柱CEX带负电,阴离子交换柱AEX带正电。当样品流过时,带电荷的蛋白质就会被吸附在柱子上。我们通常在低盐条件下进行,让蛋白质尽可能多地结合。然后,通过改变流动相的pH值或者逐渐增加盐浓度,就可以把它们洗脱下来。理论上很简单,在同一个pH下,带更多正电荷的蛋白质在CEX上会结合得更紧,需要更高的pH或盐浓度才能洗下来;带更多负电荷的蛋白质在AEX上结合得更紧,同样需要更强的洗脱条件。所以,IEX非常适合用来追踪那些改变蛋白质净电荷的修饰,比如脱酰胺化或者琥珀酰亚胺形成,这些都会改变蛋白质的总电荷。
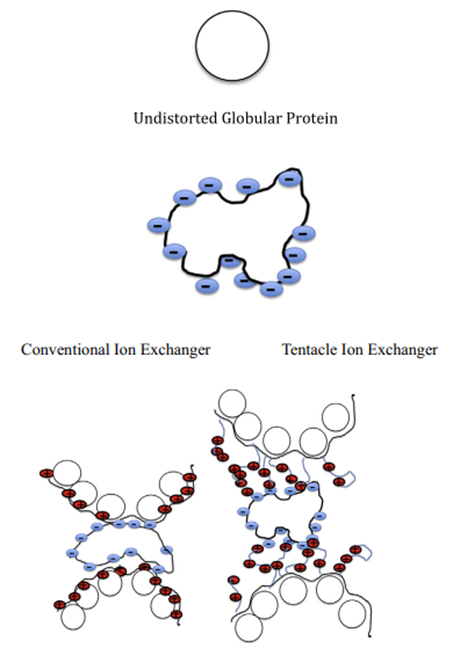
不过,蛋白质并不是简单的带电,它们表面坑坑洼洼,有的地方电荷密集,有的地方稀疏。而且,蛋白质还具有柔性。为了最大限度地与柱子上的固定电荷结合,它可能需要扭动身体,调整自己的姿势。但这需要付出能量代价,有时候蛋白质宁愿不结合,也不愿意扭曲自己。这就导致实际的洗脱顺序可能跟我们简单计算的净电荷顺序不太一样。为了解决这个问题,科学家们发明了一种新奇的柱子,叫做触手离子交换色谱。传统的柱子就像一个个小球表面带电荷,而触手柱呢,是在基质上伸出长长的连接臂,把电荷挂在这个臂膀末端。这样做的好处是,蛋白质可以像握手一样,轻松地与这些末端的电荷相互作用,而不需要把自己整个身体都塞到柱子表面去。这大大减少了蛋白质构象调整的需求,提高了结合效率和分辨率。
疏水作用色谱
疏水作用色谱,简称HIC。蛋白质表面有些区域不喜欢水,也就是疏水区。在高盐浓度下,水分子会倾向于围绕这些疏水区形成有序的结构,这其实降低了系统的整体熵,蛋白质为了增加熵,就会倾向于把这些疏水区藏起来,减少与水的接触。HIC柱子上固定了一些小的疏水基团,比如苯基或者丙基。在高盐条件下,蛋白质会被这些疏水基团吸引并结合到柱子上。当我们逐渐降低盐浓度时,水分子重新占据主导地位,疏水相互作用减弱,蛋白质就被洗脱下来。一般来说,那些疏水性更强的蛋白质,需要更低的盐浓度才能被洗脱下来,所以它们在柱子上停留的时间更长。HIC特别擅长处理那些因为氧化比如色氨酸或蛋氨酸被氧化,或者天冬氨酸异构化而改变了表面疏水性的蛋白质。
反相色谱
反相色谱,简称RP-HPLC。它跟HIC有点像,也是利用疏水性,但具体方法不太一样。HIC是靠降低盐浓度来减弱疏水作用,而RP-HPLC则是靠往流动相里加有机溶剂,比如乙腈或丙醇。这些有机溶剂会取代一部分水,使得蛋白质与柱子上疏水基团之间的疏水相互作用变得不稳定。疏水性强的蛋白需要更高浓度的有机溶剂才能被洗脱。RP-HPLC最早是用来分离小分子的,后来发现它对肽段特别有效,特别是结合质谱做肽图分析,能精确找到蛋白质上哪个氨基酸被修饰了。但是对于完整的大分子抗体来说,它的分辨率有限。因为一个化学修饰对整个大分子的疏水性影响可能没那么显著。但是通过优化,比如选择合适的柱子、流动相和梯度,它还是可以用来研究某些特点的化学变化,比如色氨酸的氧化。


