PNAS 暨南大学刘志平团队等合作揭示SNX3通过介导髓系细胞坏死性凋亡和线粒体分裂促进病理性视网膜血管新生的新机制
时间:2025-09-12 12:13:26 热度:37.1℃ 作者:网络
缺血性视网膜病变(如早产儿视网膜病变、糖尿病视网膜病变和视网膜静脉阻塞等)是导致视力下降甚至不可逆失明的主要原因之一。病理性新生血管的形成是其主要的病理特征,而缺氧应激是其关键的病理基础。尽管抗血管内皮生长因子(VEGF)疗法取得了一定进展,但其疗效有限、存在耐药性且无法惠及所有患者,凸显了深入探索疾病新机制和寻找新治疗靶点的迫切需求。刘志平教授及其合作者长期以来聚焦病理性视网膜血管新生的免疫代谢调控机制开展系统研究,2017年在Nature Communication上发表文章[1],揭示腺苷受体ADORA2A通过HIF1α-PFKFB3轴激活内皮细胞糖酵解驱动病理性血管新生;并且2020年在Science Translational Medicine发表文章[2],证明PFKFB3驱动的糖酵解是髓系细胞(巨噬细胞/小胶质细胞)与血管内皮细胞在视网膜血管病变中双向激活的分子枢纽;2022年在JCI Insight上发表文章[3],利用单细胞测序结合功能验证在单细胞精度上系统描绘了视网膜血管新生相关免疫细胞的转录和代谢特征,提出高度激活的视网膜髓系细胞亚群(包括小胶质细胞和巨噬细胞)在病理性新生血管形成中扮演关键角色,但其具体的调控机制,尤其是功能蛋白的分选转运、细胞程序性死亡方式以及线粒体稳态失衡在其中的作用,仍未完全阐明。
2025年9月9日,暨南大学药学院刘志平教授团队联合中山大学刘培庆教授和路静教授团队,在Proceedings of the National Academy of Sciences of the United States of America (PNAS)杂志上在线发表了题为“Sorting nexin 3 promotes ischemic retinopathy through RIP1- and RIP3-mediated myeloid cell necroptosis and mitochondrial fission”的研究论文[4]。该研究通过单细胞测序、条件性基因敲除动物模型、基于靶点结构的虚拟筛选等前沿的技术手段,首次揭示了分选连接蛋白3 (SNX3)通过促进髓系细胞坏死性凋亡(necroptosis)和线粒体分裂(mitochondrial fission),驱动缺血性视网膜病变发生发展的新机制,并鉴定出一种SNX3小分子抑制剂W1122,为相关疾病的治疗提供了新策略和潜在靶点。

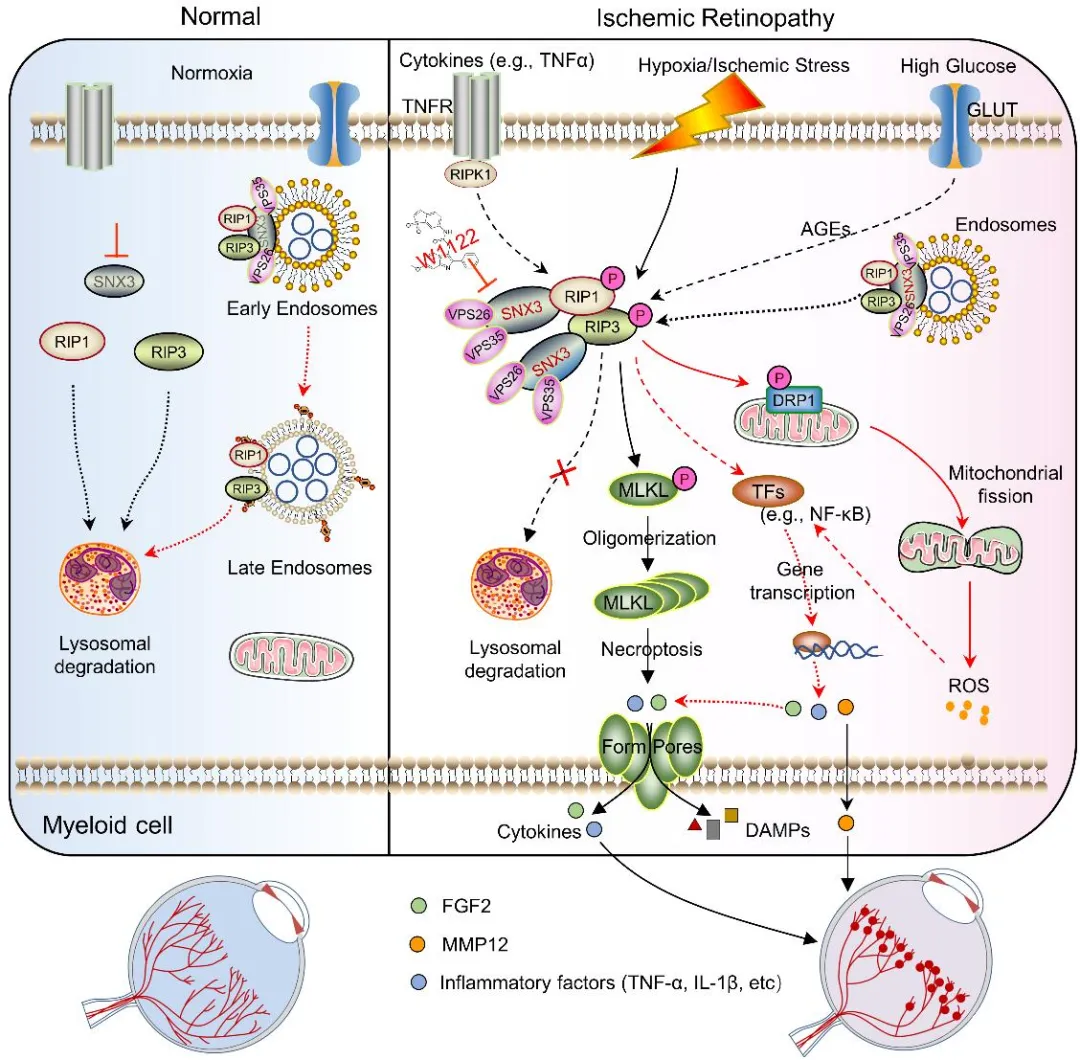
研究团队首先利用单细胞RNA测序技术(scRNA-seq)分析了氧诱导视网膜病变(OIR)模型小鼠视网膜细胞的转录组特征。分析结果显示,分选连接(sorting nexin, SNX)蛋白家族相关通路在OIR视网膜的髓系细胞亚群中显著富集,其中SNX3在视网膜小胶质细胞/巨噬细胞中的表达水平尤为突出。通过挖掘和分析GEO公共数据库微阵列数据集(GSE60436)和RNA测序数据集(GSE102485),结果揭示患有增殖性糖尿病视网膜病变(PDR)患者的视网膜新生血管膜中的SNX3以及髓系细胞标志物的表达水平明显高于正常视网膜和非PDR视网膜。利用激光捕获显微切割技术从OIR小鼠视网膜中分离出了富含髓系细胞的新生血管簇,基因表达分析的结果表明SNX3的表达水平高于对照组小鼠正常视网膜血管。免疫荧光染色进一步证实,SNX3在OIR小鼠视网膜的病变区域(尤其是新生血管簇内部及周围)的髓系细胞中表达显著升高,提示其可能参与病理过程。
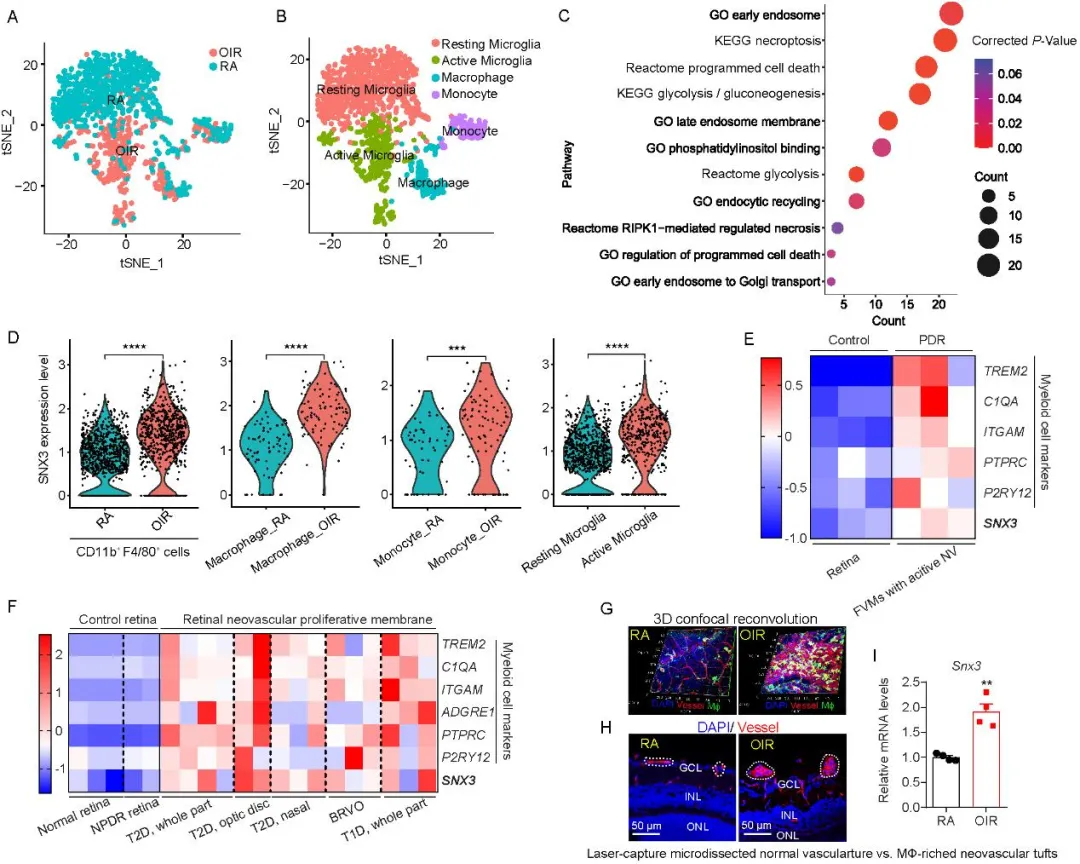
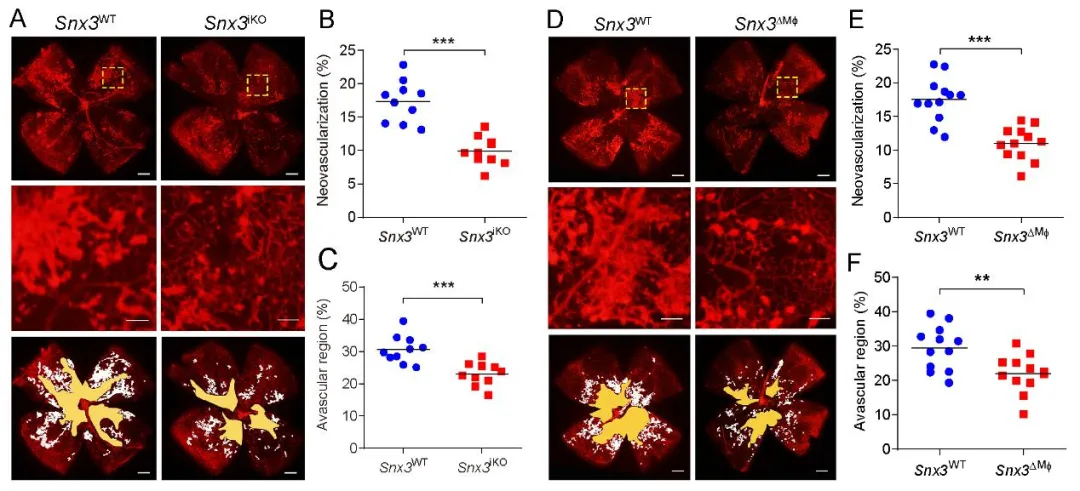
为了明确SNX3在视网膜病变中的功能,研究人员构建了全身及髓系细胞特异性敲除Snx3基因的小鼠。令人振奋的是,髓系细胞中SNX3的缺失显著抑制了OIR小鼠视网膜的病理性新生血管形成,改善了视网膜血管的异常渗漏,并有效保护了视觉功能。这一结果直接证明了髓系细胞来源的SNX3是驱动缺血性视网膜病变的关键因子。
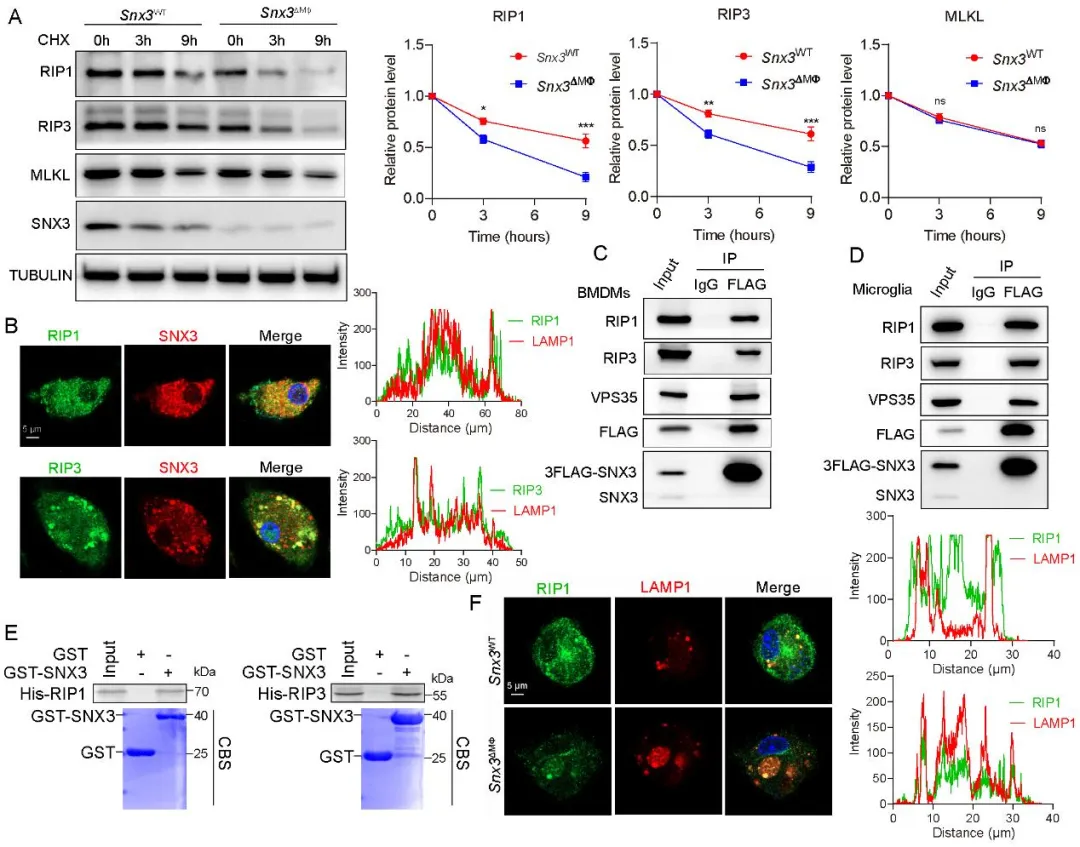
机制层面的深入探索揭示了SNX3发挥作用的关键途径。通过免疫共沉淀质谱联用(IP-MS)、GST pull-down、免疫共沉淀(Co-IP)及免疫荧光共定位等实验,研究人员发现SNX3能够直接与受体相互作用蛋白1和3 (RIP1和RIP3)发生相互作用。进一步的机制研究发现SNX3与RIP1/3互作促使后者在细胞内的循环运输,进而防止它们被溶酶体降解。在缺氧刺激下,髓系细胞中SNX3的缺失加速了RIP1/RIP3蛋白的降解,从而有效抑制了由缺氧触发的髓系细胞坏死性凋亡过程以及伴随的线粒体过度分裂。众所周知,坏死性凋亡会释放大量损伤相关分子模式(DAMPs)和促炎因子。本研究进一步证明,抑制SNX3-RIP1/RIP3信号介导的死亡途径和线粒体分裂,显著减少了髓系细胞产生促炎因子(如TNF-α、IL-1β)和关键促血管生成因子(如成纤维细胞生长因子2—FGF2、基质金属蛋白酶12—MMP12)的能力,最终遏制了病理性血管新生。
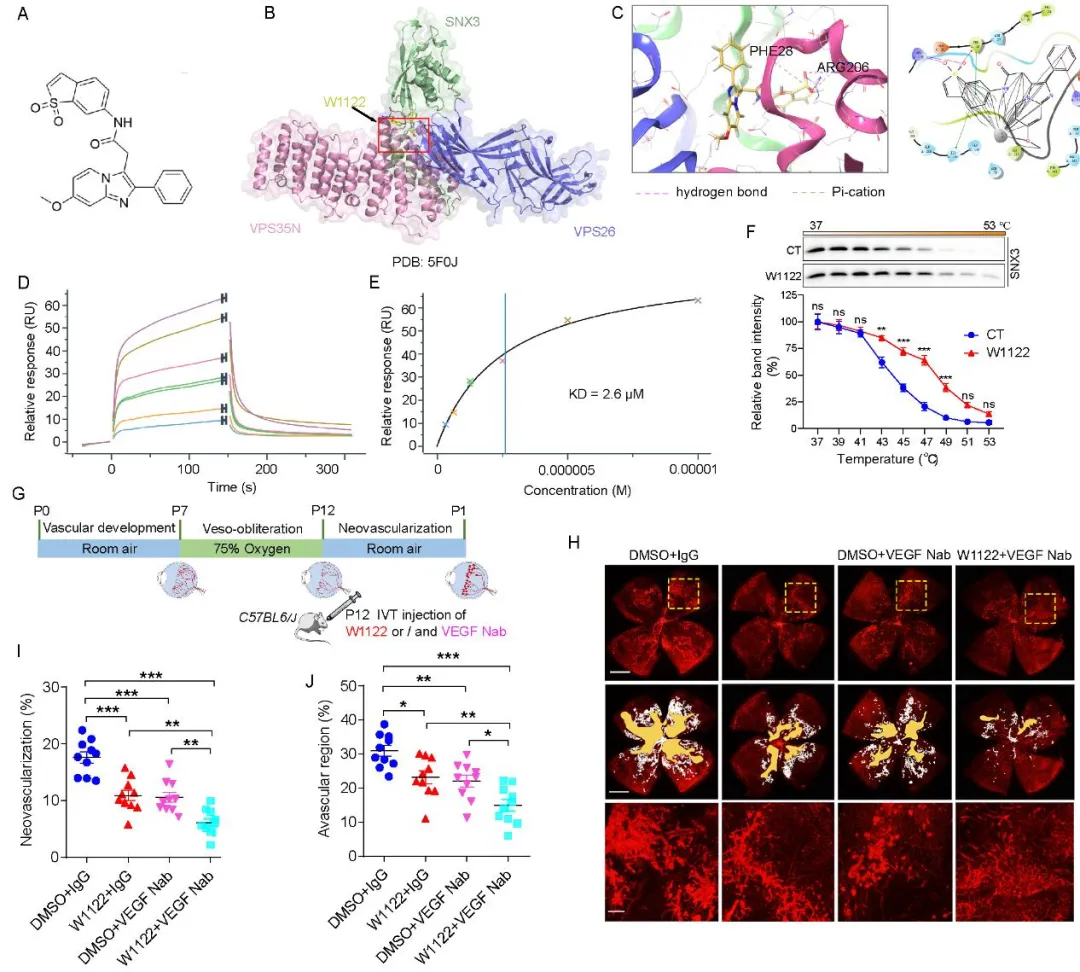
在临床转化研究方面,基于SNX3蛋白的结构特征,研究团队成功筛选并鉴定出一种小分子抑制剂W1122。在OIR小鼠模型中,玻璃体内注射W1122展现出显著的抑制视网膜新生血管形成的疗效。更令人鼓舞的是,W1122与临床常用的抗VEGF药物联合使用时,产生了优于单一治疗的协同抗血管生成效果,这为克服现有抗VEGF疗法的局限性提供了新思路。
综上所述,本研究首次建立了SNX3-RIP1/RIP3信号轴在髓系细胞介导的视网膜病理性血管生成中的关键角色。该信号轴通过调控髓系细胞的坏死性凋亡命运和线粒体动力学,深刻影响了视网膜的炎症微环境和血管新生进程。发现的SNX3抑制剂W1122及其与抗VEGF的协同效应,为开发治疗缺血性视网膜病变的新型药物奠定了坚实的基础,具有重要的科学意义和广阔的临床应用前景。
机制示意图
暨南大学生物活性分子与成药性全国重点实验室刘志平教授、中山大学药学院刘培庆教授和路静教授为本文的共同通讯作者。暨南大学王娇娇博士、周春红博士、邹佳蜜硕士以及广东医科大学庄楷本科生为本文的共同第一作者。该研究得到了国家自然科学基金、广东省基础与应用基础研究基金等项目的资助。同时得到美国贝勒医学院霍玉庆教授、中山大学王元相教授、广东医科大学黄遵楠教授等团队的帮助与支持。
参考文献:
1. Liu Z, Yan S, Wang J, Xu Y, Wang Y, Zhang S, Xu X, Yang Q, Zeng X, Zhou Y, Gu X, Lu S, Fu Z, Fulton DJ, Weintraub NL, Caldwell RB, Zhang W, Wu C, Liu XL, Chen JF, Ahmad A, Ismail KD, Mohamed AS, Li Q, Jiang X, Sun Y, Sodhi A, Smith L, Hong M*, Huo Y*. Endothelial adenosine A2a receptor-mediated glycolysis is essential for pathological retinal angiogenesis. Nature Communications. 2017, 19;8(1):584.
2. Liu Z, Xu J, Ma Q, Zhang X, Yang Q, Wang L, Cao Y, Xu Z, Tawfik A, Sun Y, Weintraub NL, Fulton DJ, Hong M, Dong Z, Smith LEH, Caldwell RB, Sodhi A, Huo Y.* Glycolysis links reciprocal activation of myeloid cells and endothelial cells in the retinal angiogenic niche. Science Translational Medicine. 2020, 12(555):eaay1371.
3. Liu Z#*, Shi H#*, Xu J, Yang Q, Ma Q, Mao X, Xu Z, Zhou Y, Da Q, Cai Y, Fulton DJ, Dong Z, Sodhi A, Caldwell RB, Huo Y*. Single-cell transcriptome analyses reveal unique microglia types associated with proliferative retinopathy. JCI Insight, 2022, 7(23):e160940.
4. Wang J#, Zhou C#, Zhuang K#, Zou J#, Qiu W, Jin M, Ye W, Yang P, Zheng Z, Zhou C, Huang Z, Wang Y, Liu P*, Lu J*, Huo Y, Liu Z*. Sorting nexin 3 promotes ischemic retinopathy through RIP1- and RIP3-mediated myeloid cell necroptosis and mitochondrial fission. Proc Natl Acad Sci U S A. 2025, 122(37), e2426578122.
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2426578122


