复旦大学,最新Science大子刊,逆转T细胞衰老,增强免疫疗法!
时间:2025-09-15 12:12:51 热度:37.1℃ 作者:网络
三阴性乳腺癌(TNBC)是一种侵袭性强且预后差的乳腺癌亚型,其特征是缺乏雌激素受体、孕激素受体和人表皮生长因子受体2的表达。由于缺乏特定的治疗靶点,化疗一直是TNBC的主要治疗手段,但效果有限。近年来,免疫检查点阻断(ICB)治疗在TNBC中显示出一定的疗效,但响应率不一致,且缺乏可靠的预测生物标志物。因此,识别与免疫疗法疗效相关的生物标志物和探索新的治疗策略对于改善TNBC患者的预后至关重要。
复旦大学邵志敏、江一舟、金希、上海市第五人民医院刘荣花等人研究团队探讨了干扰素诱导的CD8+ T细胞衰老如何降低早期三阴性乳腺癌中抗PD-1免疫疗法的疗效,并提出了通过烟酰胺单核苷酸(NMN)治疗恢复CD8+ T细胞功能,增强免疫疗法效果的策略。相关内容以“Interferon-induced senescent CD8+ T cells reduce anti-PD1 immunotherapy efficacy in early triple-negative breast cancer”为题发表在《Science Translational Medicine》上。

【主要内容】
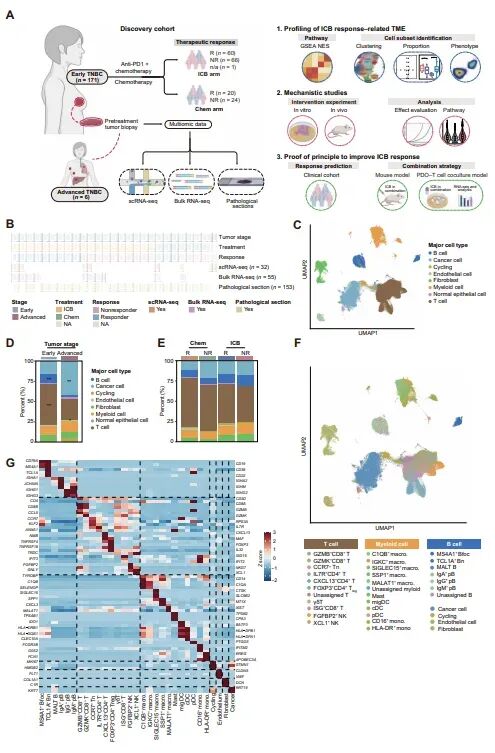
图1:单细胞转录组分析揭示早期和晚期TNBC的肿瘤微环境
研究者对早期和晚期TNBC患者的样本进行了单细胞RNA测序,揭示了不同治疗组(化疗和免疫疗法)的肿瘤微环境差异。早期TNBC样本中富集了T细胞和B细胞,且几乎所有细胞类型都表现出免疫激活相关通路的上调。相比之下,晚期TNBC样本中癌细胞和淋巴细胞表现出抑制白细胞迁移的通路上调,导致淋巴细胞耗竭的肿瘤微环境。此外,早期TNBC样本中的T细胞和B细胞还表现出细胞周期和氧化磷酸化通路的上调,表明其在增殖状态和代谢功能上也存在差异。这些发现提示早期TNBC的免疫活性肿瘤微环境可能与晚期TNBC不同,导致免疫检查点阻断治疗的响应机制和生物标志物也有所不同。
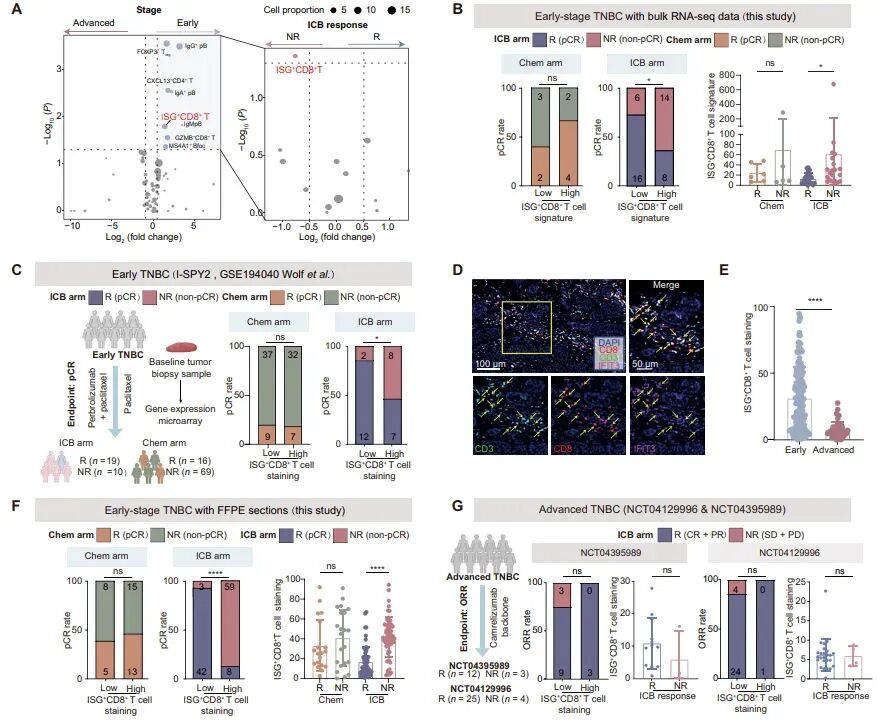
图2:鉴定早期TNBC中预测免疫疗法耐药的ISG+CD8+ T细胞
研究发现,与化疗组相比,接受免疫疗法的非响应者(NRs)中ISG+CD8+ T细胞的丰度更高。这些细胞表现出干扰素刺激基因(ISGs)的上调,如IFIT3、IFIT2和IFIT1。此外,ISG+CD8+ T细胞还表现出细胞衰老相关基因的高表达,如p16、p21等,以及细胞毒性、T细胞刺激、组织驻留、记忆和免疫检查点相关基因的低表达。通过流式细胞术分析,ISG+CD8+ T细胞在蛋白水平上也表现出ISGs和免疫衰老标记物(如CD57和KLRG1)的高表达,以及细胞毒性标记物GZMB的低表达。这些结果表明,ISG+CD8+ T细胞在早期TNBC中与免疫疗法耐药相关,并且具有独特的衰老表型。
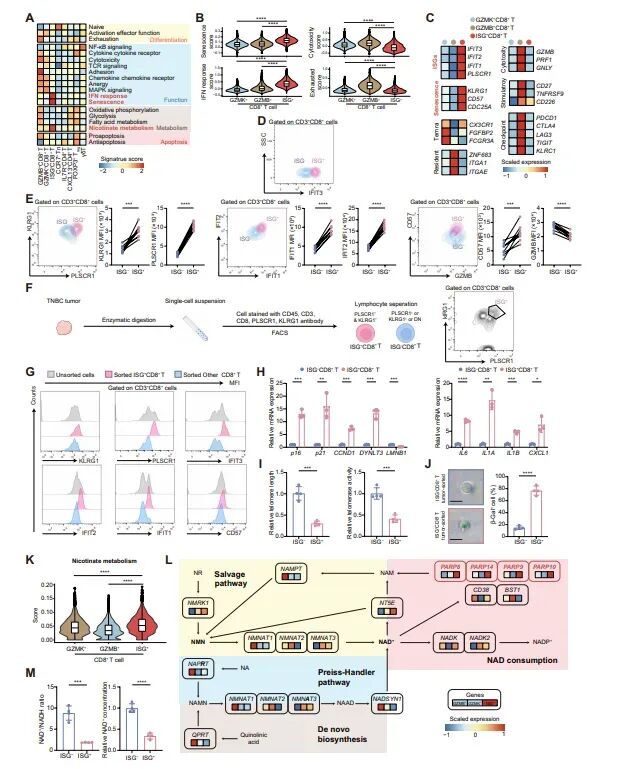
图3:ISG+CD8+ T细胞表现出衰老表型和受损的烟酰胺代谢
研究发现,ISG+CD8+ T细胞在单细胞转录组分析中显示出较高的细胞衰老、IFN-γ反应和烟酰胺代谢通路的评分。与ISG−CD8+ T细胞相比,ISG+CD8+ T细胞在蛋白水平上表现出更高的ISGs和免疫衰老标记物(如CD57和KLRG1)的表达,以及更低的细胞毒性标记物GZMB的表达。此外,ISG+CD8+ T细胞还表现出端粒缩短、端粒酶活性降低、衰老相关分泌表型(SASP)基因的高表达,以及NAD+/NADH比值和总NAD+浓度的降低。这些结果表明,ISG+CD8+ T细胞具有明显的衰老表型,并且NAD+代谢受损,这与它们的细胞毒性功能降低和免疫疗法耐药性有关。
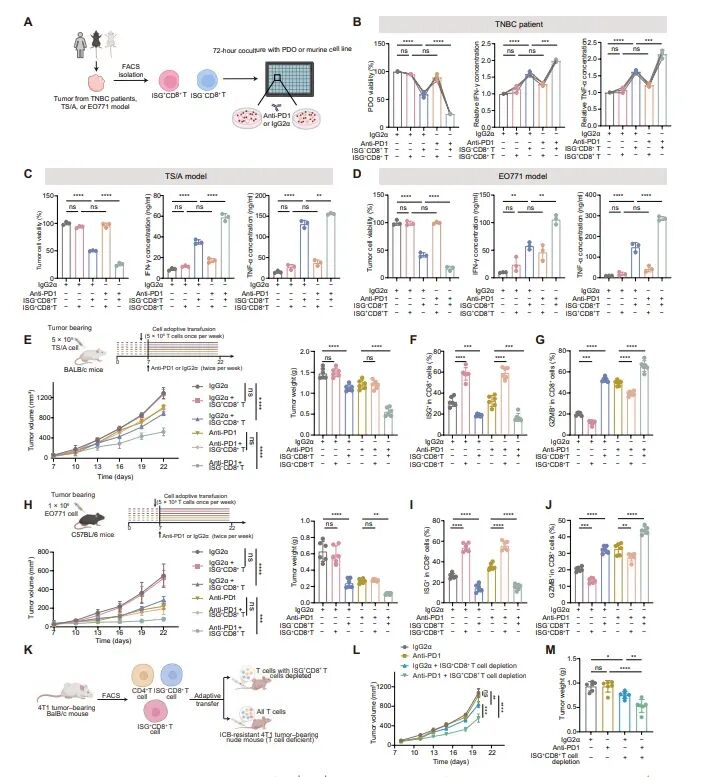
图4:ISG+CD8+ T细胞表现出受损的细胞毒性和对PD-1阻断的低反应性
研究者将从患者肿瘤中分离的ISG+CD8+ T细胞和ISG−CD8+ T细胞与患者来源的类器官(PDOs)或小鼠肿瘤细胞共培养,以评估其细胞毒性。结果显示,与ISG−CD8+ T细胞共培养的PDOs相比,与ISG+CD8+ T细胞共培养的PDOs存活率更高,且抗PD-1治疗进一步降低了与ISG−CD8+ T细胞共培养的PDOs的存活率,但对与ISG+CD8+ T细胞共培养的PDOs没有影响。此外,与ISG−CD8+ T细胞共培养相比,ISG+CD8+ T细胞共培养的培养基中IFN-γ和TNF-α的浓度较低,且抗PD-1治疗仅在ISG−CD8+ T细胞共培养中增加了这些细胞因子的浓度。这些结果表明,ISG+CD8+ T细胞在体外表现出较弱的肿瘤杀伤能力和对免疫检查点阻断治疗的低反应性。
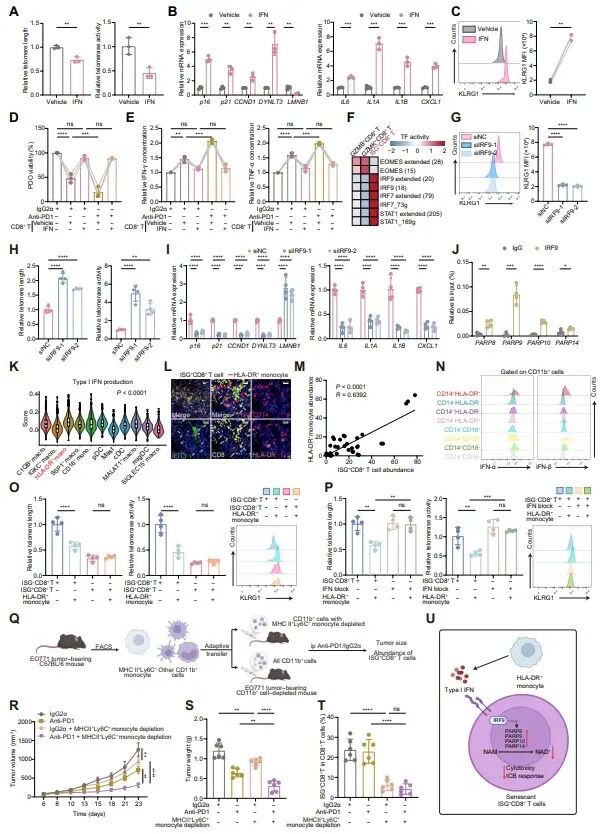
图5:IFN-IRF9-PARP轴在ISG+CD8+ T细胞的产生中起关键作用
研究发现,IFN处理的CD8+ T细胞表现出端粒缩短、端粒酶活性降低、衰老相关调节因子(如p16、p21)和SASP因子(如IL6、IL1A、IL1B和CXCL1)的高表达,以及细胞毒性相关基因(如GZMB和PRF1)的低表达。此外,IFN处理还显著降低了CD8+ T细胞的细胞毒性功能和对免疫检查点阻断治疗的反应性。通过单细胞调控网络推断和聚类(SCENIC)分析,发现IRF9在ISG+CD8+ T细胞中的活性上调。IRF9的敲低减少了ISG+CD8+ T细胞中ISGs的表达,降低了细胞的衰老表型,并上调了细胞毒性基因的表达。此外,IRF9的敲低还导致PARP8/9/10/14的下调,且染色质免疫沉淀-定量聚合酶链反应(ChIP-qPCR)分析显示IRF9能够结合到PARP8/9/10/14的启动子区域。这些结果表明,IFN-IRF9-PARP轴在ISG+CD8+ T细胞的产生中起关键作用,揭示了其背后的分子机制。
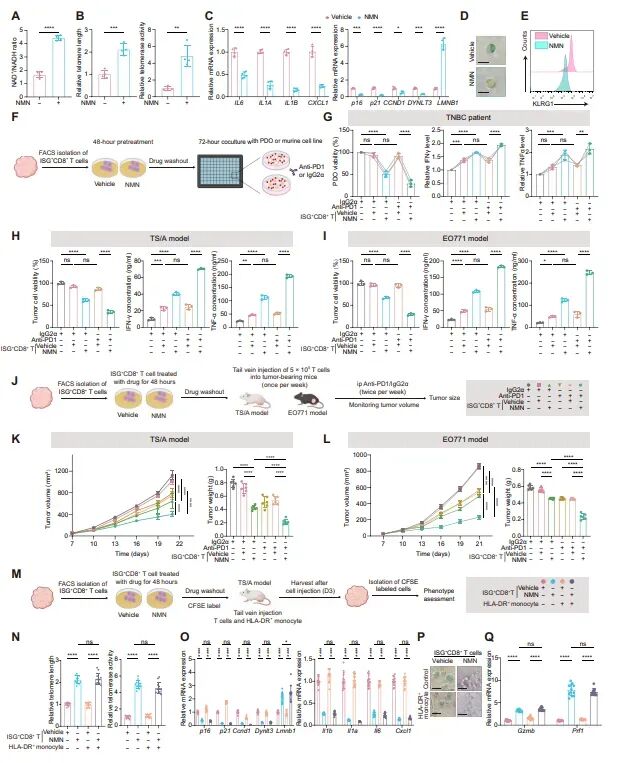
图6:NMN恢复衰老ISG+CD8+ T细胞的功能
研究发现,NMN补充能够增加患者和小鼠来源的ISG+CD8+ T细胞中的NAD+/NADH比值。NMN还逆转了ISG+CD8+ T细胞的衰老表型,包括端粒长度、端粒酶活性、衰老相关调节因子和SASP基因的表达、免疫衰老标记物的表达以及β-半乳糖苷酶的染色。此外,NMN预处理的ISG+CD8+ T细胞在与患者来源的类器官(PDOs)或小鼠肿瘤细胞共培养时,表现出更高的细胞毒性基因表达和更低的肿瘤细胞存活率。在小鼠模型中,NMN预处理的ISG+CD8+ T细胞能够显著减少肿瘤体积,并增强抗PD-1治疗的效果。这些结果表明,NMN能够通过逆转代谢缺陷来恢复ISG+CD8+ T细胞的细胞毒性和对免疫检查点阻断治疗的反应性。
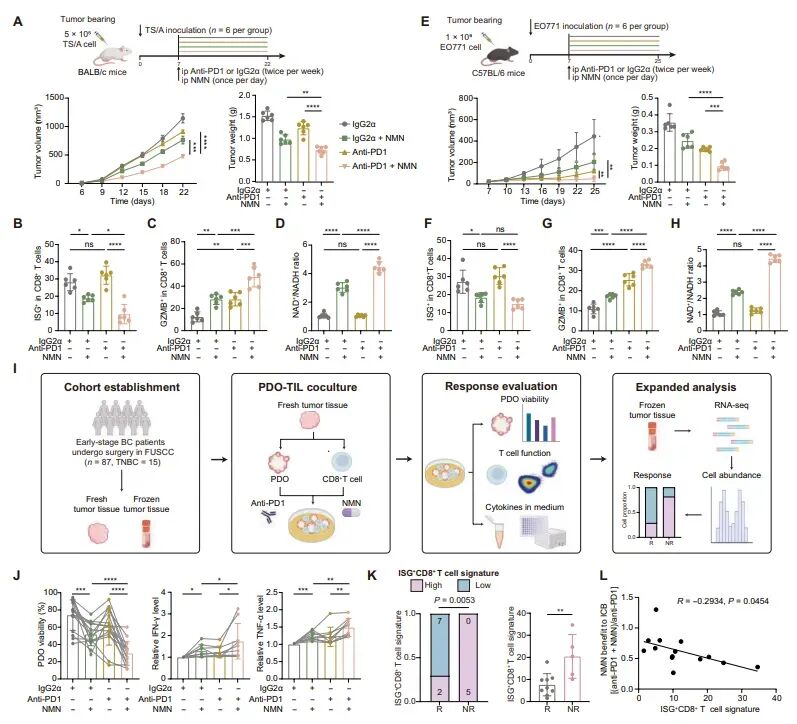
图7:NMN补充增强免疫检查点阻断治疗的反应
在TS/A和EO771小鼠模型中,NMN与抗PD-1治疗的联合应用显著减少了肿瘤体积,与单独接受抗PD-1治疗的小鼠相比。NMN还降低了ISG+CD8+ T细胞的丰度,并增加了细胞毒性GZMB+CD8+ T细胞的丰度。此外,NMN处理的小鼠中ISG+CD8+ T细胞的NAD+/NADH比值增加,表明NMN通过调节NAD+代谢来增强免疫治疗的效果。在免疫缺陷小鼠中,NMN补充并未抑制肿瘤生长,且在CD8+ T细胞耗竭后,NMN的治疗益处消失,表明NMN主要通过作用于CD8+ T细胞来增强免疫治疗的效果。此外,研究还建立了一个由87名早期乳腺癌患者组成的前瞻性队列,发现NMN补充能够显著降低与抗PD-1治疗的PDO共培养系统的活性,并提高培养基中IFN-γ和TNF-α的浓度。进一步分析显示,ISG+CD8+ T细胞丰度较高的样本对NMN补充的增强效果更为显著,这强调了ISG+CD8+ T细胞作为预测免疫治疗疗效的生物标志物和潜在增敏靶点的临床重要性。
【全文总结】
本研究通过对171名早期TNBC患者的样本进行单细胞RNA测序、批量转录组学和病理学检测,发现了一群干扰素(IFN)诱导的CD8+ T细胞,这些细胞表现出衰老特征,如NAD+代谢紊乱和细胞毒性降低,且与免疫疗法的非响应性相关。研究进一步揭示了由HLA-DR+单核细胞产生的IFN能够触发CD8+ T细胞的衰老。通过烟酰胺单核苷酸(NMN)治疗,能够恢复这些衰老CD8+ T细胞的功能,并在患者来源的类器官-T细胞共培养和小鼠模型中增强了免疫疗法的疗效。这项研究不仅揭示了早期TNBC中免疫疗法非响应性的细胞和分子机制,还为开发新的治疗策略提供了理论基础。
原文链接:
https://www.science.org/doi/10.1126/scitranslmed.adj7808


