局部进展期可切除食管癌的新辅助治疗进展
时间:2025-09-10 12:12:01 热度:37.1℃ 作者:网络
摘 要
新辅助治疗已成为局部进展期可切除食管癌的标准治疗,较单纯手术治疗显著改善患者长期生存。新辅助治疗模式已逐渐发展并衍生出多元化的策略体系,包括同步放化疗、单纯化疗、免疫或靶向联合治疗等。不仅丰富了临床治疗的选择,也为患者提供了更加个性化、科学化的治疗路径。本文旨在全面梳理并总结新近涌现的学术研究热点问题,回顾新辅助治疗的理由与评价指标,阐述新辅助治疗后再分期方法面临的挑战,辨析各新辅助治疗策略之优劣。
正 文
在全球范围内,食管癌作为一种恶性肿瘤,始终呈现高发病、高致死特征,严重威胁人类生命健康。根据2022年的全球癌症统计数据[1],食管癌新增病例数高达51.1万,其发病率在众多癌症中居第11位;同年约有44.5万人罹患食管癌离世。食管癌的死亡率位居全球癌症死亡率的第7位。我国是食管癌高发国,根据2022年的国内癌症统计数据[2],每年新发病例数约22.4万,约占全球的50%;同年约有18.8万人罹患食管癌离世,死亡率居我国癌症死亡率第5位。过去20年,我国在食管癌的预防、诊疗及研究方面均展现出显著的进步。这些进步不仅因为医学技术的日益成熟,更是人们对食管癌认知的深入与防治策略的不断完善[3]。尽管如此,据近期全国范围横断面调查结果显示,共计5 283例初次诊治的食管癌患者,确诊时为Ⅰ期及Ⅱ期者占比约为14.0%与26.8%,而Ⅲ期及Ⅳ期者占比约为25.0%与16.8%,这导致5年总生存率仅39.1%[4]。食管癌作为一种顽固的恶性肿瘤,其抗癌之路依然任重道远。
自CROSS研究模式引领的术前新辅助同步放化疗与根治性外科手术相结合的治疗方案,确立为局部进展期、具备根治性切除条件的食管癌患者的金标准治疗路径以来,已稳健走过10余年[5-6]。这一里程碑式的进步,不仅通过长期生存数据的严密追踪与评估,无可辩驳地彰显了其在提升患者肿瘤学预后方面的显著优势,较之于传统的单纯外科治疗手段,其成效斐然,为患者赢得了更宝贵的生存时间。然而,在肯定其辉煌成就的同时,临床医师亦需以冷静而敏锐的视角,审视其潜在的不足与挑战。随着时间推移,CROSS研究[6]揭示了一个不容忽视的现象:尽管该模式在食管癌原发肿瘤局部控制上展现了强大的威力,但是其在全身治疗层面的力度尚显不足,导致患者术后远隔器官转移累积风险逐年攀升,这一严峻挑战无疑为治疗策略提出了新的课题与更高的要求。
为面对这一挑战,近年来学者们不断探索优化新辅助治疗方案,强化全身治疗力度,力求在有效控制局部病灶的同时,也能有效遏制肿瘤细胞的远处播散,为患者带来更加全面、持久的生存获益。本文旨在全面梳理并总结新近涌现的学术研究热点问题,回顾新辅助治疗的理由与评价指标,阐述新辅助治疗后再分期方法面临的挑战,辨析各新辅助治疗策略之优劣。
1 新辅助治疗的理由与评价指标
新辅助治疗理念,其雏形可追溯至20世纪80年代,彼时即以术前化疗与根治性外科治疗相结合的新纪元,广泛应用于多种主要实体肿瘤的治疗领域。此理念的提出与实践,基于深远而周密的医学考量,其临床实施的策略依据详述如下:首先,新辅助治疗通过术前化疗手段,旨在预先减少肿瘤负荷,降期从而为后续的根治性外科切除术创造更为有利的条件。此举不仅提升手术切除率与R0根治率,而且还可降低因手术操作导致肿瘤播散风险,进而降低术后复发转移风险。其次,该理念强调治疗的综合性与序贯性,即化疗与外科治疗相辅相成,共同作用于恶性肿瘤TNM分期不同维度,尽早消灭隐匿微转移灶。这种精细化的治疗安排,旨在最大化地利用每种治疗手段的优势,同时避免其潜在的不足,从而达到更佳的治疗效果与预后改善。再者,新辅助治疗的应用,还基于对肿瘤生物学行为的深入理解与精准评估。通过术前化疗的反应性评估,医生能够更准确地判断恶性肿瘤对术前化疗药物的敏感性,进而为个体患者量身定制更为适宜的药物治疗方案,实现真正的个体化治疗。综上所述,新辅助治疗理念以其独特的优势与深刻的理论依据,在肿瘤治疗领域占据举足轻重的地位。其不仅拓宽了肿瘤治疗的手段与思路,更为广大患者带来了更为显著的生存获益与更高的生活质量[7]。
自1978年国际抗癌联盟(UICC)及1988年美国癌症联合委员会(AJCC)在其出版的第3版TNM分期系统中革新性地融入了新辅助治疗理念,更前瞻性地于分期评估体系中添加了“y”前缀,此举旨在精准区分未经新辅助治疗直接评估的临床分期与经过新辅助治疗后所呈现的不同临床场景[7]。这一变革不仅体现了医学界对肿瘤治疗策略深刻理解的进步,也标志着癌症分期与管理迈向更加精细化、个性化的新阶段。通过“y”前缀的巧妙运用,临床医生能够更加科学地评估治疗反应,制定更贴合患者实际情况的后续治疗方案,从而进一步提升了癌症治疗的有效性和患者的生存质量[8]。当前的TNM分期体系中,唯有第8版UICC/AJCC食管癌及胃癌TNM分期系统[7]引入了并成功验证了ypTNM分期方法。
在探讨新辅助治疗方案的合理性时,临床常用的具有说服力的评价指标包括:客观缓解率(objective response rate,ORR)、主要病理缓解(majorpathologicresponse,MPR)及病理完全缓解(pathologic complete response,pCR)。这些指标不仅构成了衡量疗效的坚实基石,更是引领新辅助治疗进步的风向标。其中,ORR作为首要考量,直观展现了治疗对患者病情的直接改善作用,是评估药物疗效以及外科可切除性两方面不可或缺的一环。而MPR则进一步关注的肿瘤组织在病理学层面的显著退化,为治疗有效性提供更精细的佐证。
尤为值得强调的是,pCR这一里程碑式的指标,不仅是治疗效果的巅峰体现,更是无数患者与医疗工作者共同追求的目标。pCR的实现,意味着在病理学的严苛审视下,肿瘤已近乎或完全消失,这无疑为患者带来了前所未有的生存希望与预后改善。已有多项研究[9-11]结果揭示pCR在诸多实体瘤治疗中的显著优势,明确指出其与患者远期预后改善显著相关。然而,不同新辅助治疗模式所获得pCR转换为术后长期生存获益的效能是迥异的,故不能仅依靠pCR作为唯一的新辅助治疗模式疗效评价指标。
2 新辅助治疗后再分期方法面临的挑战
2.1 影像学再分期方法
现代医学影像学技术,作为无创性医学评估工具中的翘楚,始终是局部进展期食管癌在初始阶段精准分期及新辅助治疗后全面再分期的核心手段。凭借其相对较高的像素精确度,为临床提供食管恶性肿瘤的大小、位置、与周边脏器组织的关系,区域及远隔淋巴结转移状态信息,其在治疗决策的制定中扮演了不可或缺的关键角色。近期一项Meta分析[12]结果显示,共计56项研究3 625例患者纳入分析,最终汇总的常用影像学技术CT、正电子发射断层摄影-计算机断层摄影(PET-CT)及磁共振成像(MRI)诊断pCR的敏感度分别为0.35、0.62及0.80;特异度分别为0.83、0.73及0.83;阳性预测值分别为0.47、0.41及0.61。临床亟需打破这一桎梏,因而实践中提倡多模态、多维度的影像学评估体系。通过融合不同成像技术的优势,如PET-CT、MRI的高级功能成像,运用人工智能算法对影像组学数据进行梳理,描绘肿瘤全貌,精准捕捉其动态变化,为再分期提供更可靠的依据,目前初步研究成果令人鼓舞[12-15]。
2.2 内镜学再分期方法
超声内镜(endoscopic ultrasound,EUS)对于包括食管在内的空腔脏器初始分期评估的临床价值毋庸置疑,然而其诊断pCR的敏感度仅为0.01,特异度为0.99[12],提示再分期评估需要EUS联合诊断模式。与此同时,重复内镜下活检诊断癌残留的敏感度与特异度分别为0.33及0.95[16]。为此,针对食管癌原发肿瘤内镜下深取活检(bite-on-bite)联合针对食管癌区域淋巴结行EUS引导下细针穿刺活检(fine-needle aspiration,FNA)模式应用而生。preSANO研究[17]是一项荷兰国内多中心、前瞻性、诊断队列研究,共入组219例接受新辅助同步放化疗治疗的局部进展期食管癌患者,最终207例纳入分析,结果显示常规内镜联合EUS-FNA模式诊断非MPR(TRG3级或4级)漏诊率为31%[95% CI(17,5)],bite-on-bite联合EUS-FNA模式漏诊率为10% [95%CI( 4,23)],仅凭EUS模式漏诊率为28% [95%CI (17,44)],仅凭PET-CT 模式漏诊率为15%[95%CI (7,28)],提示bite-on-bite联合EUS-FNA模式诊断新辅助同步放化疗后癌残留效能是足够的。进一步分析结果显示,bite-on-bite模式漏诊病例的残存肿瘤多位于黏膜层(18/27)[18],这提示今后改进方向应聚焦黏膜下层。
以PreSANO再分期评估模式为基础,SANO研究[19]采用非劣效性、阶梯式楔形分组随机试验设计,对198例局部进展期食管癌患者在新辅助同步放化疗后进行主动监测,期间总共69例(35%)始终保持临床完全缓解(cCR),96例(48%)发生局部复发,33例(17%)发展为远隔转移。主动监测组患者的中位无疾病生存期(DFS)为35个月[95%CI(31,41)],对照组(CROSS模式)中位DFS为49个月[95%CI(38,NA)],[HR=1.35,95%CI (0.89,2.03),P=0.15]。术前新辅助同步放化疗30个月后,主动监测组患者中43%出现远处转移,而对照组则有34%出现远处转移[OR=1.45,95%CI(0.85,2.48),P=0.18]。从统计学角度来看,主动监测患者在6个月(P=0.002)和9个月(P=0.007)时的健康相关生活质量(HRQOL)明显更好。正在进行中的SANO-2研究(NCT04886635)[20]及preSINO研究(NCT03937362)[21]将可能提供更多数据以揭示内镜学再分期评估方法的临床意义。
2.3 外科学再分期方法
相较于诊断性腹腔镜外科在胃癌领域的广泛应用及共识认同[22],诊断性胸/腹腔镜再分期评估方法在食管癌领域的开展则显得相对滞后。近年来,随着医疗技术不断革新,诊断性腹腔镜联合腹腔灌洗细胞学诊断模式在评估食管胃癌患者N及M分期方面展现出不可忽视的临床价值[23-24]。与此同时,诊断性胸腔镜再分期评估方法在食管癌,尤其是食管鳞癌诊疗中的应用正逐步深化,其主要聚焦于对原发肿瘤T分期的精准判定[25-26]。这一技术革新提升了食管癌的再分期诊断率。通过胸腔镜的直观探查与评估,辅助外科术中更加准确地判断新辅助治疗后原发肿瘤的累及范围、与周围组织的关系,从而制定更科学合理的治疗方案,最大限度地提高根治性切除率,避免姑息减瘤手术。
3 不同新辅助治疗模式优劣势比较
新辅助治疗作为当代食管癌多学科综合治疗模式中必要的组成部分,现已衍生出包括同步放化疗、单纯化疗、免疫治疗及免疫联合治疗等多种模式,其优劣势的深入分析与合理选择显得尤为重要。
3.1 新辅助同步放化疗与单纯化疗
以CROSS研究为代表的新辅助同步放化疗模式,使食管鳞癌术后pCR率达49%,全组患者(包括鳞癌及腺癌)的术后全病因死亡风险降低了40%[HR=0.60,95%CI(0.46,0.80)],10年总生存率(OS)率提高了13%[5-6,27]。然而,术后肿瘤复发转移模式分析却暴露了其不足之处。其术后血行转移率为28.6%,术后10年因食管癌导致的累计死亡风险为47%[6,28]。近期一项国际多中心队列研究[29]结果显示,我国鳞癌患者采用CROSS治疗方案的pCR率仅为27.8%,显著低于荷兰鳞癌患者的pCR率(43.6%),提示该治疗模式存在明显地域差异。我国NEOCRTEC5010研究[30-31]采用类似新辅助同步放化疗模式,结果显示食管鳞癌经术前新辅助同步放化疗后pCR率为43.2%,全病因死亡风险降低26%[HR=0.74,95%CI(0.57,0.97)],5年OS率提升10%。术后发生血行转移率为14.7%,5年累计总体复发转移率达32.2%,其中远隔转移率为24.3%[31-32]。上述研究结果明确指出了当前新辅助同步放化疗模式所面临的严峻挑战—其全身控制力度的显著不足,以及不容忽视的远隔转移风险隐患。该挑战提示在治疗策略制定上,必须果断实现从局部治疗向全身治疗的深刻转变。
以日本JCOG1109/NExT研究为代表的新辅助化疗模式,尽管DCF方案单纯化疗术后pCR率优于CF方案,但不及新辅助同步放化疗(CF-RT vs. DCF vs. CF=38.5% vs. 19.8% vs. 2.1%),但是DCF方案术后3年OS率显著优于CF方案[72.1% vs. 62.6%;HR=0.68,95%CI(0.50,0.92)],而新辅助同步放化疗与CF方案新辅助化疗术后3年OS差异却无统计学意义[68.3% vs. 62.6%;HR=0.84,95%CI(0.63,1.12)][33]。此外,我国CMISG1701研究[34]结果也同样表明,对于cT3~4aN0~1M0期食管鳞癌患者,新辅助同步放化疗模式相较于新辅助化疗模式并未显著改善术后远期生存[术后3年OS:64.1% vs. 54.9%,HR=0.82,95%CI(0.58,1.18)],尽管术后pCR率依然绝对占优(27.7% vs. 2.9%)[34]。欧洲Neo-AEGIS研究[35]则以非劣效性设计方法证实cT2~3N0~3M0期食管腺癌及食管胃交界部腺癌患者采用围术期ECF或FLOT化疗方案可获得相似于新辅助同步放化疗模式的术后3年OS率[55% vs. 57%;HR=1.03,95%CI( 0.77,1.38)],同步放化疗组pCR优于化疗组(12% vs. 4%)。欧洲ESOPEC研究[36]更是以优效性设计方法证实术前4周期FLOT化疗较同步放化疗可获得更高的pCR率(19.3% vs. 13.5%),并且围术期FLOT化疗组3年OS率更优[57.4% vs. 50.7%;HR=0.70,95%CI(0.53,0.92)]。表1列举的研究结果显示,改善术前新辅助全身治疗强度尽管对于短期肿瘤学指标贡献不及新辅助同步放化疗模式,但是可改善术后远期生存。如何兼顾“临床降期缩瘤”与“术后长期生存”已成为临床亟待解决的问题,笔者从肿瘤异质性角度分析,以TNM分期特征差异提出个体化新辅助治疗决策系统,即“大T小N型”推荐新辅助同步放化疗,而“小T大N型”则推荐新辅助化疗或免疫联合治疗,可能有助于指导临床[37]。
3.2 免疫治疗与靶向治疗
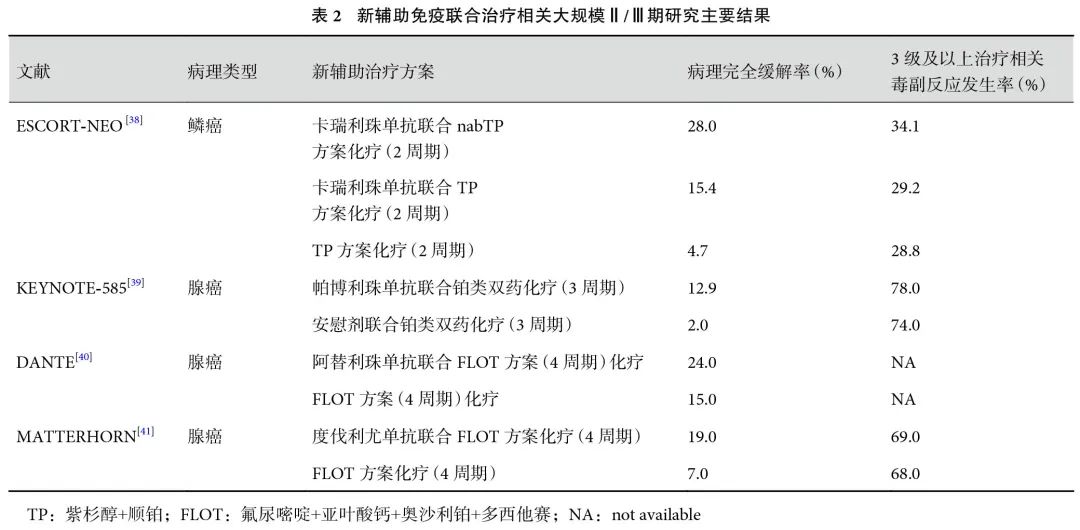
我国ESCORT-NEO研究[38]是全球首项比较新辅助免疫联合治疗与单纯化疗的Ⅲ期随机对照研究,共计391例cT1b~3N1~3M0或cT3N0M0期可切除的食管鳞癌患者随机分组,结果显示卡瑞利珠单抗联合白蛋白紫杉醇及顺铂组与卡瑞利珠单抗联合紫杉醇及顺铂组术后pCR率均显著高于紫杉醇及顺铂组(28.0% vs. 15.4% vs. 4.7%),到达预设主要研究终点之一。3级及以上治疗相关毒副反应发生率分别为34.1%、29.2%及28.8%;术后并发症发生率分别为34.2%、38.8%及32.0%(表2)。未来该研究长期生存数据结果公布有可能改变现有新辅助治疗临床实践。
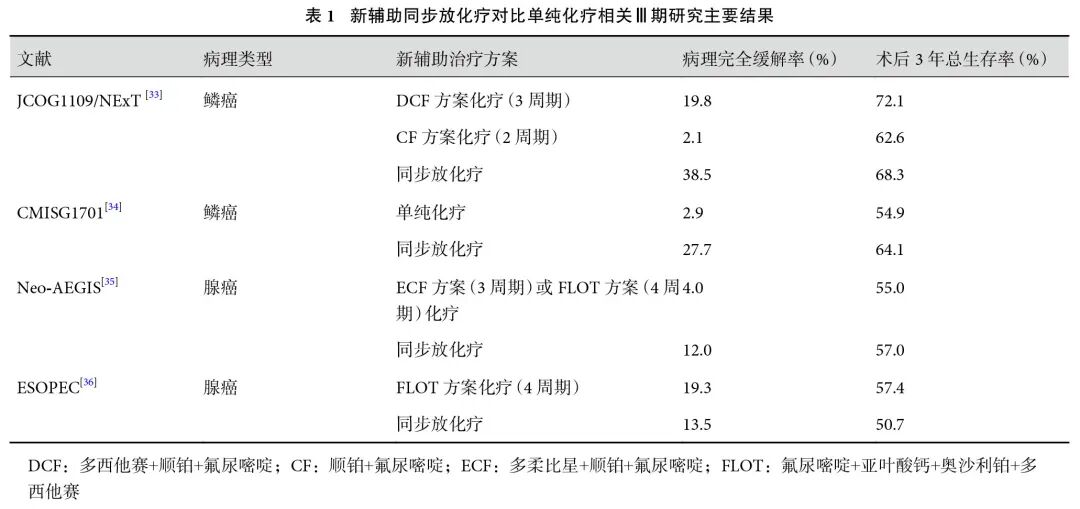
全球KEYNOTE-585研究[39](Ⅲ期)试图探究围术期免疫联合化疗模式对于可切除的食管胃交界部腺癌或胃癌患者的临床价值。共计804例患者纳入研究随机分组,该研究中期分析结果显示帕博利珠单抗联合化疗组术后pCR更优(12.9% vs. 2.0%);中位无事件生存(event free survival,EFS)倾向获益更多[44.4个月 vs. 25.3个月,HR=0.81, 95%CI(0.67,0.99)],而中位OS差异则无统计学意义[60.7个月 vs. 58.0个月,HR=0.90,95%CI (0.73,1.12)];3级及以上治疗相关毒副反应发生率相似(78.0% vs. 74.0%)。欧洲DANTE研究[40](Ⅱ/Ⅲ期)结果显示同单纯FLOT方案新辅助化疗相比较,应用阿替利珠单抗联合FLOT作为新型新辅助治疗方案术后pCR率显著提高(24.0% vs. 15.0%);严重治疗相关不良反应率相似。另一项类似的北美MATTERHORN研究[41](Ⅲ期)中期结果已公布,度伐利尤单抗联合FLOT方案化疗的术后pCR率显著优于单纯FLOT方案化疗(19.0% vs. 7.0%),两组R0切除率均为86.0%,3级及以上治疗相关毒副反应发生率相近(69.0% vs. 68.0%),长期生存数据尚未公布。
北美ECOG-ACRIN EA2174研究[42](Ⅱ/Ⅲ期)则试图揭示新辅助同步放化疗基础上添加免疫治疗所获得的肿瘤学疗效。共计275例cT1N1~3M0或T2~3N0~2M0期食管腺癌或食管胃交界部腺癌患者纳入第一阶段术前新辅助治疗阶段进行随机分组,新辅助同步放化疗联合纳武利尤单抗组与对照组(CROSS模式)术后pCR率分别为21.0% vs. 24.8%,差异无统计学意义;两组围术期并发症发生率相似(28.7% vs. 25.4%);3级及以上治疗相关毒副反应发生率相似。两组术后脱落率分别达42.5%及50.7%,难以再评估不同辅助免疫模式的优劣。
北美RTOG1010研究[43](Ⅲ期)采用曲妥珠单抗联合新辅助同步放化疗模式治疗HER2过表达的可切除食管腺癌。共计203例纳入研究随机分组,添加曲妥珠单抗组与对照组的中位DFS分别为19.6个月 vs. 14.2个月[HR=0.99,95%CI(0.71,1.39)];添加曲妥珠单抗组的治疗相关严重毒副反应率更高(36% vs. 28%)。上述结果提示添加曲妥珠单抗并未给HER2过表达的食管腺癌患者增添临床获益。
4 总结
尽管新辅助治疗模式显现出比较显著的短期肿瘤学疗效优势,然而pCR获益仍无法确保远期生存获益。未来探究联合所有可及手段的“全程新辅助治疗模式”可能为揭示最优新辅助治疗模式问题提供答案[44]。与此同时,根据新近制订的《食管癌及食管胃交界部癌外科持续质量改进目标中国专家共识(2024版)》[45],高质量食管外科治疗关乎患者生存,为此提出的“外科边界”概念涉及兼顾原发肿瘤边界(近、远端及环周切缘)与完全二野或三野区域淋巴结清扫。
尽管当前研究结果已初步揭示了各种新辅助治疗模式在局部进展期可切除食管癌治疗中的显著积极成效,但是临床医师仍须清醒地认识到,这一领域尚存诸多挑战与待解之谜。当前,将免疫疗法作为新辅助治疗的一部分,与化疗及放疗相结合的策略,仍正处于严谨设计的临床试验的关键探索期。这一过程虽充满希望,却也意味着当前正处于科学探索的前沿,每一步都需谨慎前行。将创新疗法从实验室成功转化为临床实践,需跨越重重障碍,包括但不限于肿瘤学疗效的最大化、毒副作用的有效管理,以及患者个性化治疗方案的精准制定。因此,尽管前景光明,临床医师仍应持以严谨的科学态度,不断积累数据,优化治疗策略,确保每例食管癌患者都能从这一前沿治疗中获益最大化。这不仅是对医学进步的执着追求,更是对患者生命质量与生存希望的深切关怀。通过不懈努力与持续创新,终将克服现有难题,为食管癌患者带来更加光明的治疗前景。
利益冲突:无。
作者贡献:康晓征负责综述撰写及格式内容调整、修改;张瑞祥、王镇、陈先凯、李勇、秦建军参与文献搜索及筛选;李印负责综述主题设计及审校。


