多发性骨髓瘤GPRC5D免疫治疗的进展、耐药和联合策略
时间:2025-09-13 12:13:57 热度:37.1℃ 作者:网络
多发性骨髓瘤(MM)是一种浆细胞克隆性恶性肿瘤,其特征为频繁复发和治疗耐药。靶向免疫疗法,如靶向BCMA和CD38的单克隆抗体、双特异性抗体(BsAbs)和CAR-T细胞,已显著改善了复发/难治性和高危MM患者的预后,但耐药性仍然是主要的临床挑战,迫切需要新的治疗靶点来克服耐药性并提高反应的持久性。
G蛋白偶联受体C类5组成员D(GPRC5D)因其在MM细胞中的高选择性表达和在正常组织中的极低表达,已成为一个有前景的免疫治疗靶点,有望成为继BCMA之后MM免疫治疗的下一代靶点。
河南省肿瘤医院房佰俊教授等于《British Journal of Haematology》发表综述,全面概述了GPRC5D在MM中的作用,包括其分子特征、表达模式、临床意义和治疗开发,还讨论了将GPRC5D靶向疗法整合到临床实践中的关键挑战和未来方向。

GPRC5D的生物学特性
生物结构
GPRC5D于2001年由Osborne等人首次在基因水平上鉴定和表征,它属于C类G蛋白偶联受体(GPCR)家族的第5组,其基因位于人类12号染色体p13区。该蛋白与其他视黄酸诱导基因(RAIG)家族成员,包括GPRC5A(RAIG1)、GPRC5B和GPRC5C,具有显著的同源性。作为一个七次跨膜的孤儿受体,GPRC5D缺乏已知的内源性配体,其下游信号通路仍不明确。
在结构上,GPRC5D表现出区别于传统C类GPCR的独特特征,其保持典型的七次跨膜结构域架构,但其胞外域相对较短,并且缺乏其他C类受体中常见的特征性 Venus flytrap (VFT) 结构域。相反,GPRC5D通过其第四跨膜结构域(TM4)形成稳定的同源二聚体,采用头对头的界面构型(图1)。这种独特的结构排列可能将抗原表位定位在靠近细胞膜的位置, 可以促进有效的免疫突触形成并增强T细胞介导的细胞毒性。此外,抗原的整合膜定位可能限制其脱落进入循环, 从而提高了GPRC5D导向免疫疗法的药理学稳定性和疗效。
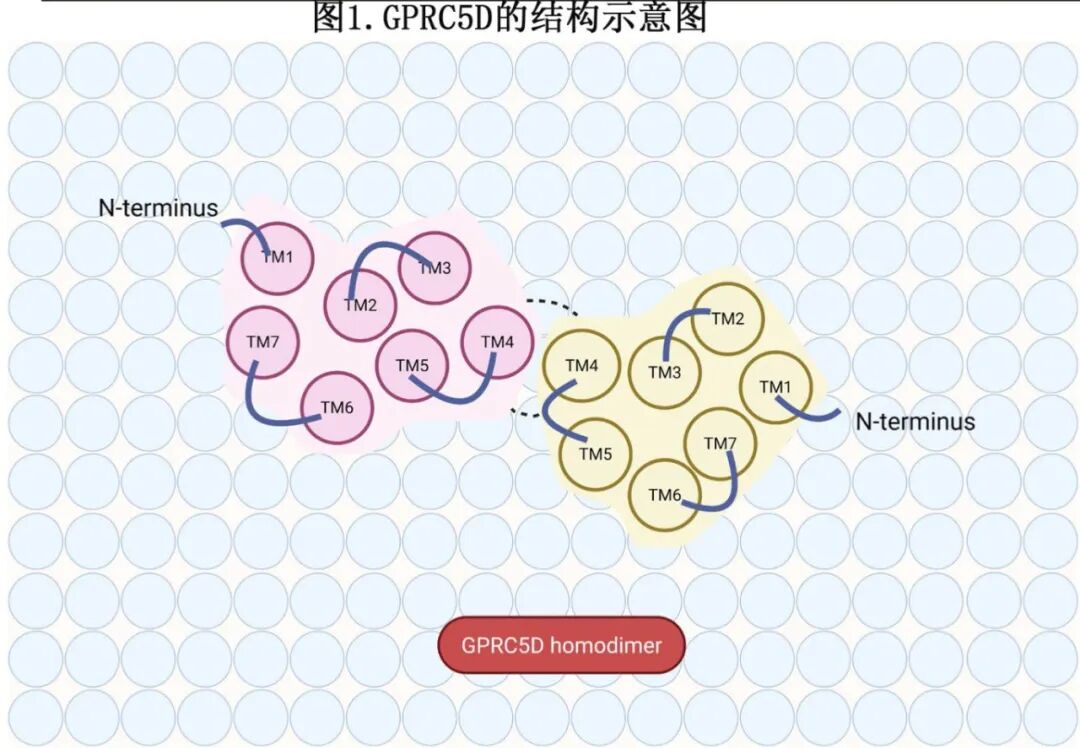
在正常组织中的表达
GPRC5D表现出高度组织限制性的表达特征,主要位于角化上皮结构,如毛囊、毛皮质、甲床和舌的丝状乳头,在大多数重要器官中观察到极低表达。这种选择性组织分布赋予了GPRC5D良好的治疗窗,使其成为免疫治疗的良好靶点,特别是在BCMA治疗后的背景下。
在皮肤中,GPRC5D特别富集于毛囊和产生角蛋白的细胞中,其表达可受外部刺激调节,例如全反式维甲酸可上调毛球细胞中的GPRC5D表达。
除了皮肤组织外,在睾丸、胰腺和延髓中也检测到低至中度表达。值得注意的是,其在延髓下橄榄核(一个涉及运动协调的区域)中的存在引起了对其潜在神经系统副作用的担忧。然而,与BCMA相比(在基底神经节中表达并可能导致神经毒性),GPRC5D的表达谱更为局限,可能具有更低的脱靶(off-target)效应风险。
GPRC5D在MM中的表达
与BCMA相比,GPRC5D在正常造血干细胞和祖细胞中的表达极微,而在恶性浆细胞中高表达,突出了其肿瘤特异性和免疫治疗潜力。与BCMA不同,GPRC5D通过不同的分子机制进行调控,并且可能在BCMA靶向抗原逃逸后仍保留表达,支持其作为序贯免疫治疗靶点的用途。
Smith等人报道,与正常浆细胞和外周B细胞相比,原代MM细胞中的GPRC5D信使RNA(mRNA)水平显著升高。其他研究也表明,从意义未明的单克隆丙种球蛋白病(MGUS)到冒烟型骨髓瘤(SMM)再到明显的症状性MM,GPRC5D表达呈逐步增加,表明其在疾病进展和克隆演变中可能发挥作用,这种差异表达谱支持了在复发或BCMA耐药的MM中靶向GPRC5D的基本原理。
尽管有这些发现,GPRC5D的生物学功能和调控通路仍知之甚少,需要进一步研究以阐明其在骨髓微环境中的作用,特别是在免疫逃避机制方面。未来的研究还应检验GPRC5D是否通过关键信号通路如核因子κB(NF-κB)或磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)通路促进骨髓瘤细胞增殖或耐药。
GPRC5D与MM的临床预后
多项研究探讨了GPRC5D表达在MM中的预后意义,但结果仍不一致。如表1总结,GPRC5D mRNA表达升高(高于中位标准化值288)与较短的总生存期(OS)以及高危细胞遗传学异常如t(4;14)和del(13q14)相关。Smith等人进一步证明,高GPRC5D表达与较短的无进展生存期(PFS)显著相关(p=0.0031),且独立于BCMA表达、国际分期系统(ISS)分期和细胞遗传学风险因素。

然而,Verkleij等人在一项大型队列研究(n=1421)中报告了相反的结果,该研究发现GPRC5D表达与PFS或OS均无显著关联,尽管在高表达组中t(4;14)和1q扩增富集。值得注意的是,目前尚无研究将GPRC5D确定为多变量Cox回归模型中的独立预后因素。
Jin等人通过流式细胞术量化了新诊断MM(NDMM)患者的GPRC5D蛋白水平。高蛋白表达与1q21获得、CD16⁺CD56⁺ NK细胞群减少和多克隆免疫球蛋白抑制更严重相关,表明存在更深层次的免疫功能障碍。临床上,这些患者表现出较低的非常好的部分缓解(VGPR)率和MRD阴性率,以及显著较短的PFS;而OS显示出下降的非显著数值趋势,可能归因于随访时间有限。
这些差异可能源于检测方法(mRNA vs. 蛋白)和患者群体(NDMM vs. RRMM)的异质性,表达cut-off值不一致,以及缺乏标准化多变量分析。虽然目前的证据支持GPRC5D作为预后生物标志物的潜力,但其独立预测价值尚未得到证实。
未来的研究应采用标准化的检测平台、稳健的多变量模型和前瞻性临床设计,以确定GPRC5D真正的预后意义及其在风险分层框架中的效用。
MM中的GPRC5D靶向治疗
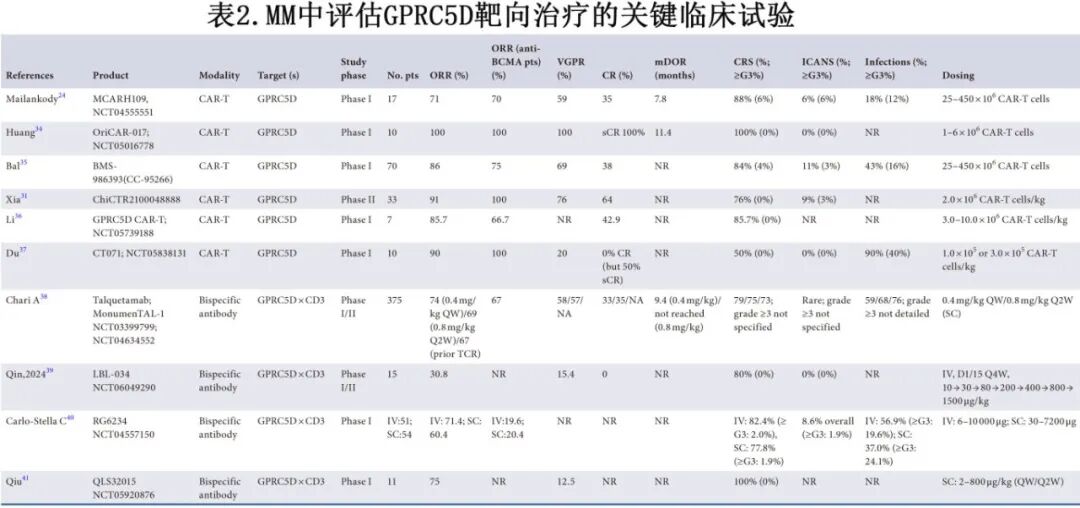
尽管GPRC5D在MM中的确切生物学功能尚待完全阐明,但其在恶性浆细胞中的高选择性表达已使其成为良好的免疫治疗靶点。多项早期临床试验在RRMM患者中显示了令人鼓舞的初步疗效和可控的安全性(表2)。
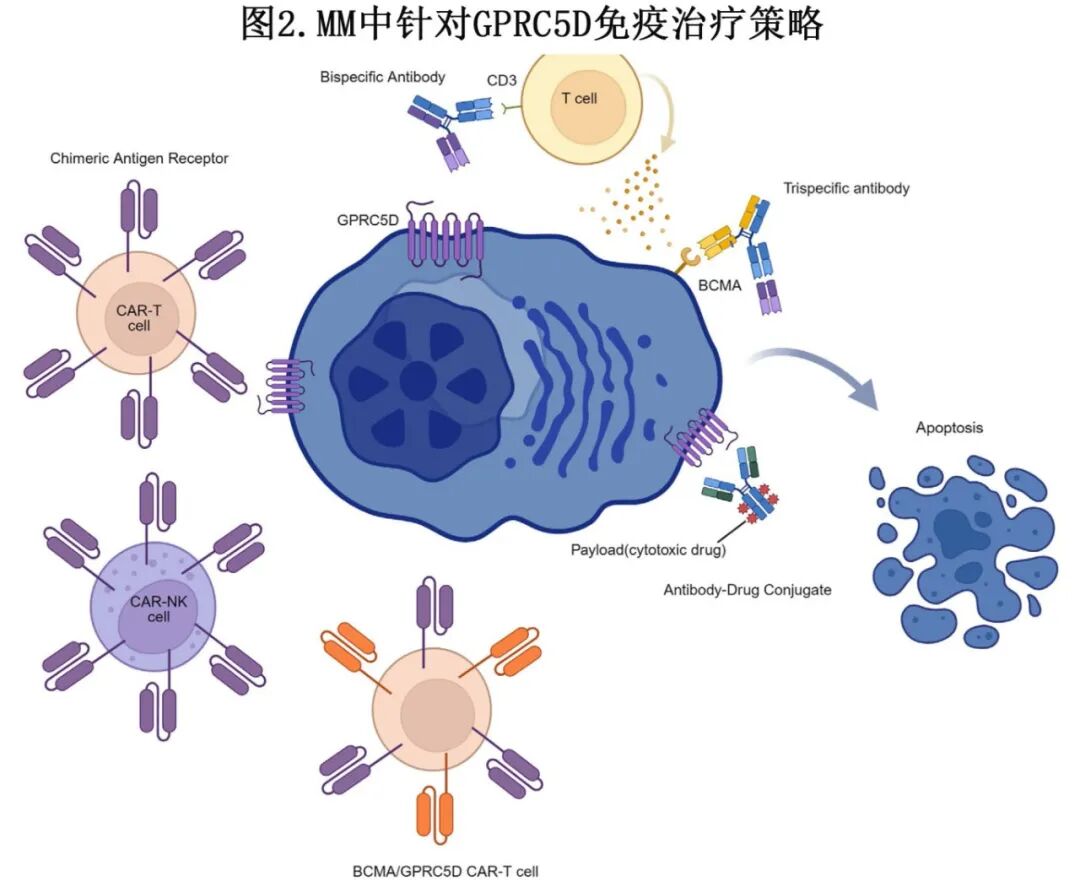
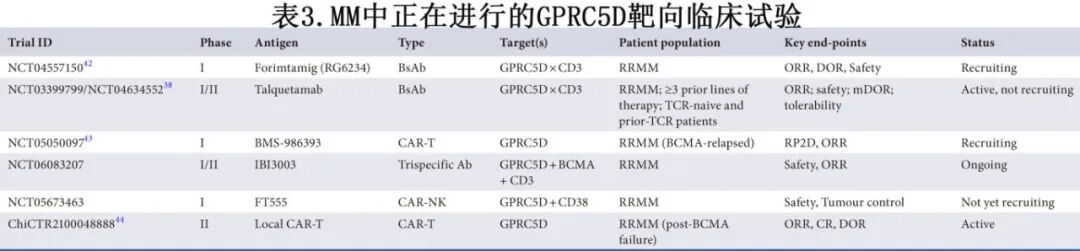
目前已开发出多种治疗方式来利用GPRC5D作为靶点,包括抗体药物偶联物(ADC)、双特异性和三特异性抗体、CAR-T细胞疗法和CAR-NK细胞(图2)。许多临床试验正在进行中,探索这些方法在不同MM人群中的临床潜力。表3提供了正在进行的研究摘要。
抗体药物偶联物(ADC)
ADC是一种靶向治疗方式,它将单克隆抗体的肿瘤特异性与化疗药物的细胞毒性效力相结合。在结构上,它们包含一个肿瘤选择性抗体、一个可切割的连接子和一个细胞毒性载荷。在GPRC5D靶向ADC中,这种策略能够选择性清除恶性浆细胞,同时保留正常组织。常用的载荷为单甲基澳瑞他汀E(MMAE),一种微管抑制剂,在ADC内化后通过溶酶体降解释放。缬氨酸-瓜氨酸(Val-Cit)连接子对溶酶体蛋白酶(如组织蛋白酶B)敏感,通常用于确保血浆稳定性和有效的细胞内释放。
然而,多种耐药机制可能会影响ADC的疗效,包括连接子过早切割、内化减少、细胞内运输受损或通过P-糖蛋白的药物外排。为了克服这些挑战,当前的努力方向是优化连接子化学、利用非多药耐药底物载荷以及设计双互补位或BsAbs以增强结合亲和力和内化。
AZD0305是首个进入I/II期临床评估的GPRC5D靶向ADC。除了通过细胞内释放其细胞毒性载荷诱导凋亡外,它还可能介导抗体依赖性细胞毒性(ADCC),从而放大其抗肿瘤活性。当前的试验正在评估其安全性、药代动力学、免疫原性和初步疗效。
LM-305是另一种研究中的GPRC5D导向ADC,由单克隆抗体、蛋白酶可切割连接子和MMAE载荷组成,已在中国和国际上获得临床试验的监管批准。正在等待进一步的结果以确定其在RRMM中的临床效用。
双特异性抗体
塔奎妥单抗
塔奎妥单抗是一种人源化免疫球蛋白G4(IgG4)亚型的双特异性T细胞衔接器抗体,同时靶向T细胞上的CD3和恶性浆细胞上的GPRC5D。这种双重结合可促进免疫突触的形成,导致T细胞活化并通过细胞因子释放和穿孔素/颗粒酶途径靶向裂解肿瘤细胞。塔奎妥单抗可招募患者自身的T细胞,是与传统单克隆抗体不同的免疫治疗方式。
2023年,塔奎妥单抗成为首个获得FDA和EMA批准用于治疗三药难治性RRMM的GPRC5D导向双特异性抗体,三药难治定义为对蛋白酶体制制剂、免疫调节剂和抗CD38单克隆抗体难治。临床前和临床研究表明,其疗效在具有高危细胞遗传学特征(包括del(13q14)和t(4;14))的患者中得以维持,支持其广泛的临床适用性。此外,其在BCMA靶向治疗后复发患者中具有活性,表明其有潜力解决抗原逃逸问题。
迄今为止最全面的临床证据来自I/II期MONUMENTAL-1试验,评估了塔奎妥单抗在重度经治RRMM患者中的效果,包括先前接受过T细胞重定向疗法的患者。探索了两种皮下给药方案:每周0.4 mg/kg和每两周0.8 mg/kg。在中位随访25.6和19.4个月时,总缓解率(ORR)分别为74%和69%。在先前接受过BCMA导向治疗的患者中,ORR仍然高达67%。常见不良事件包括细胞因子释放综合征(CRS)、味觉障碍和感染,大多为1级或2级。观察到3/4级血液学毒性,如中性粒细胞减少、贫血和淋巴细胞减少,但可控。
塔奎妥单抗表现出独特的毒性特征,主要归因于GPRC5D在角化组织中的表达,常见的皮肤和粘膜不良事件包括皮疹、甲沟炎和味觉障碍,通常为轻度至中度。CRS是最常见的免疫相关毒性,特征为发热、低血压和呼吸困难,通常是低级别的,可通过IL-6阻断剂管理。免疫效应细胞相关神经毒性综合征(ICANS)罕见,但需要密切监测神经系统症状,如意识模糊和癫痫发作。塔奎妥单抗也与感染风险增加有关,强调了免疫监测和预防的必要性。体重减轻(可能由粘膜炎症和口服摄入减少引起)则可能需要在治疗期间进行营养支持。
塔奎妥单抗目前正在III期MONUMENTAL-3试验中与达雷妥尤单抗、泊马度胺和地塞米松联合使用进行评估[61]。额外的I期研究正在探索其与免疫检查点抑制剂(包括程序性细胞死亡蛋白1(PD-1)阻断剂)的联合使用,以增强抗肿瘤免疫力。
Forimtamig (RG6234)
Forimtamig是一种GPRC5D×CD3双特异性抗体,采用1+2格式设计,以增强免疫突触稳定性和T细胞衔接,其修饰的Fc结构域延长了半衰期并最大限度地减少了脱靶免疫激活。在一项正在进行的I期试验(NCT04557110)中,静脉和皮下给药的ORR达到71.4%,VGPR达到59.2%,中位缓解持续时间长达12.5个月。1-2级CRS发生率超过75%。无论基线GPRC5D表达如何,都观察到了活性,支持其在低抗原环境中的潜在效用。
LBL-034
LBL-034是一种GPRC5D × CD3双特异性T细胞衔接器,采用1+2格式并减弱CD3亲和力,以减少非特异性激活和CRS风险。它在存在GPRC5D⁺肿瘤细胞的情况下选择性重定向T细胞,增强了特异性。目前正在进行I期评估,详细的疗效和安全性数据待公布。
三特异性抗体
三特异性抗体同时靶向BCMA、GPRC5D和CD3,旨在通过拓宽抗原覆盖范围来解决肿瘤异质性和抗原逃逸问题。CD3介导的T细胞激活促进了肿瘤微环境内的选择性细胞毒性,同时减少了脱靶效应。与双特异性形式相比,三特异性提供了增强的功能灵活性,但需要更复杂的结构工程。
JNJ-5322是一种下一代三特异性抗体,正在一项I期试验(NCT05652335)中进行研究。在接受推荐II期剂量(每4周100 mg)的患者中,ORR为100%,≥VGPR率达到89%;所有缓解在中位随访8.5个月时仍持续。治疗表现出良好的安全性,59%的患者出现1-2级CRS,神经毒性极小(2%,全部为1级)。这些结果表明,JNJ-5322可能提供类似CAR-T的疗效,同时保持现货型(off-the-shelf)的可及性。
其他正在临床评估中的三特异性候选药物包括IB13003、SIM0500和JNJ-79635322(I期)以及HPN-217和SAR445514(II期)。
单特异性GPRC5D CAR-T疗法
GPRC5D CAR-T细胞疗法为RRMM患者提供了一种有前景的方法,多种靶向GPRC5D的单特异性CAR-T细胞产品已进入早期临床试验,显示出良好疗效和可控的安全性。
MCARH109是首个进入临床测试的GPRC5D特异性CAR-T细胞产品,它使用第二代结构,包含一个GPRC5D靶向的单链可变片段(scFv)、4-1BB共刺激和CD3ζ信号结构域。在一项I期研究中,17名重度经治患者接受25至450 × 10⁶个CAR-T细胞的剂量。最大耐受剂量定义为150 × 10⁶个细胞。在最高剂量水平,观察到4级CRS、ICANS和3级小脑毒性,而在150 × 10⁶个细胞或更低剂量下未发生严重毒性。ORR为71%,在较低剂量队列中为58%。中位缓解持续时间为8.6个月。在60%的复发病例中注意到抗原丢失,GPRC5D表达减少或缺失,突显了一个关键的耐药机制。
OriCAR-017是一种基于纳米抗体的GPRC5D CAR-T结构,包含4-1BB和CD3ζ结构域,以改善持久性和抗肿瘤活性。在POLARIS试验中,10名可评估RRMM患者实现100%的ORR,包括60%的严格完全缓解(sCR)和40%的VGPR。不良事件主要是1-2级血液学毒性和低级别CRS,未观察到神经毒性。
BMS-986393是另一种自体GPRC5D CAR-T产品,目前正处于II期试验中。在一项I期研究中,选择150×10⁶个细胞作为推荐的II期剂量。在中位随访14.6个月时,ORR为87%,包括具有高危细胞遗传学、三药难治性疾病和先前BCMA靶向治疗的患者出现缓解。在达到完全缓解的患者中,88%为MRD阴性。大多数不良事件为低级别CRS和神经毒性。
在中国进行的一项II期研究(ChiCTR2100048888)进一步支持了GPRC5D CAR-T细胞在BCMA难治性RRMM中的临床效用。在37名接受治疗的患者中,ORR为84%,其中35%达到≥CR。
双靶点BCMA/GPRC5D CAR-T疗法
抗原逃逸由BCMA或GPRC5D等靶抗原的下调或丢失驱动,仍然是CAR-T细胞治疗后复发的主要原因。而双靶点CAR-T策略通过拓宽肿瘤抗原覆盖范围和减少逃逸潜力来解决这一局限性。
Fernández de Larrea等人评估了三种双靶点格式:(1) 混合输注单独的BCMA和GPRC5D CAR-T细胞;(2) 串联CAR(具有连续单链可变片段[scFvs]的单一结构);(3) 将两个scFv整合到一个多价结构域中的单体CAR。串联CAR在BCMA/GPRC5D共表达模型中表现出最强的疗效,并在BCMA阴性环境中保持活性,支持其在抗原异质性疾病中的应用。
在徐州医科大学附属医院进行的一项I期试验中,一种靶向BCMA和GPRC5D的双特异性CAR-T实现86%的ORR,其中81%的患者达到MRD阴性。在剂量扩展队列中,ORR达到92%,其中75%达到CR或更好。最大耐受剂量定义为2 × 10⁶个CAR-T细胞/kg,安全性可接受。
值得注意的是,即使在BCMA或GPRC5D丢失的患者中也观察到了缓解,表明其有潜力克服与单抗原靶向相关的耐药性。双靶点CAR-T细胞疗法可能代表着一种改善抗原多样性MM患者预后的有前景的策略。
CAR-NK疗法
与CAR-T细胞相比,GPRC5D靶向的CAR-NK疗法具有若干优势。同种异体CAR-NK细胞可以来源于健康供体、诱导多能干细胞(iPSCs)或外周血,作为现货型产品易于获得,且成本和制造时间减少。相比之下,自体CAR-NK疗法需要患者特定的细胞收集和扩增,限制了可扩展性。然而,由于免疫原性较低和扩增能力增强,自体产品可能提供更长的体内持久性。
Nahi等人报道,移植后输注自体NK细胞可导致持久性长达4周,颗粒酶B表达增加,并且在所有接受治疗的患者中观察到临床缓解。CAR-NK疗法也与较低的CRS和神经毒性风险相关,这是由于更有利的细胞因子释放特征。
临床前研究表明,针对BCMA和GPRC5D的双靶点CAR-NK细胞表现出强大的抗肿瘤活性。FT555是一种iPSC衍生的CAR-NK产品,共同靶向GPRC5D和CD38,在与达雷妥尤单抗联合使用时,在MM异种移植模型中显示出协同的肿瘤控制作用。
虽然早期数据表明其疗效和安全性良好,但GPRC5D CAR-NK疗法仍处于早期开发阶段。需要进一步的临床研究来评估其持久性、扩增以及与免疫抑制性骨髓微环境的相互作用。
联合治疗
GPRC5D靶向免疫疗法在MM中已显示出有前景的活性。将这些药物与IMiDs或单克隆抗体联合使用,可能通过互补的免疫机制进一步增强抗肿瘤疗效。
IMiDs(如来那度胺和泊马度胺)可增强T细胞和NK细胞功能,还可抑制调节性T细胞,从而促进免疫介导的细胞毒性。体外研究表明,将临床前GPRC5D × CD3双特异性抗体(BsAb5003)与IMiDs联合使用,显著增加了细胞因子产生和T细胞介导的对MM细胞的细胞毒性[。类似地,GPRC5D靶向双特异性抗体与抗CD38单克隆抗体达雷妥尤单抗的双重给药可增强T细胞扩增并耗竭免疫抑制性CD38⁺细胞。
在Ib期MajesTEC-2 (NCT04722146) 和TRIMM-2 (NCT0408195) 研究中,27名接受特立妥单抗(BCMAxCD3双抗)、达雷妥尤单抗和泊马度胺治疗的RRMM患者实现89%的ORR,其中≥VGPR为85%,≥CR为62%;中位PFS为26.5个月。然而高级别感染率较高。在另一项I期研究(NCT04586426)中,特立妥单抗联合塔奎妥单抗实现80%的ORR,包括61%的髓外疾病患者。与TRIMM-2一样,感染率显著升高。
在真实世界中,使用BsAbs进行CAR-T前的“桥接”治疗与改善总反应和增强T细胞克隆性相关,表明双特异性预处理可能改善CAR-T细胞的扩增和疗效,但还需要前瞻性验证。
GPRC5D抗原丢失与免疫逃逸
抗原下调或丢失已成为对GPRC5D靶向免疫疗法耐药的关键机制。Ma等人在复发患者中发现了GPRC5D基因调控区域内的双等位基因缺失或结构改变,而其他患者则表现出启动子超甲基化,但无编码突变。体外研究显示甲基化水平与GPRC5D表达呈负相关,并且用去甲基化剂治疗部分恢复了抗原表达。这些发现表明遗传和表观遗传过程都参与免疫逃逸。正如在BCMA中观察到的那样,GPRC5D表达在CAR-T或双特异性抗体治疗后可能下降,从而损害治疗效果(图3)。
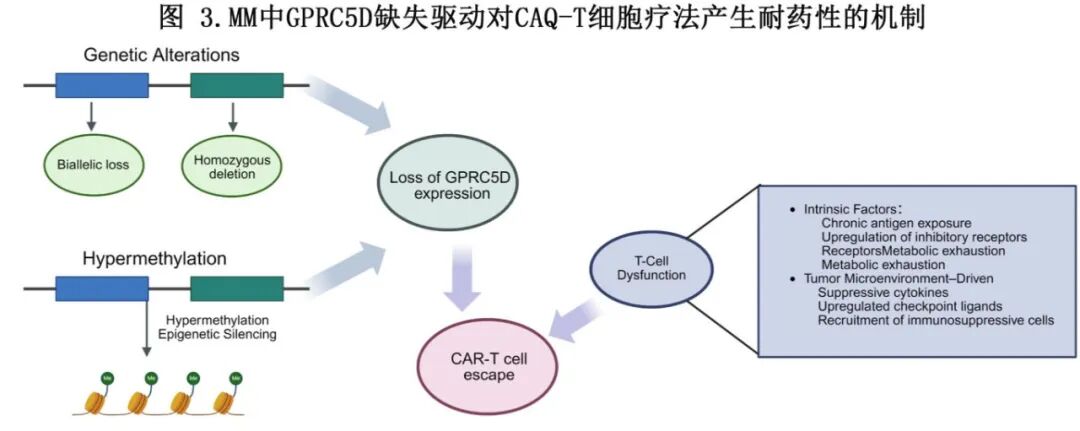
除了肿瘤内在机制外,T细胞内在功能障碍也在耐药性中起着核心作用。慢性抗原刺激、免疫抑制性肿瘤微环境以及抑制性受体(如 PD-1、淋巴细胞激活基因 3(LAG-3)和 T 细胞免疫球蛋白和黏蛋白域包含蛋白-3(TIM-3))的上调均会导致 T 细胞耗竭。对复发患者的单细胞分析显示,功能失调的CAR-T细胞克隆扩增,其特征是增殖能力降低、代谢耗竭和记忆表型丢失,这些表型通常与检查点配体表达升高、抑制性细胞因子和调节性免疫细胞浸润共存。最近的研究表明,受损的基线T细胞功能可能是对BsAbs原发性耐药的基础,而长期暴露可能进一步加剧T细胞功能障碍。
为了克服这些耐药机制,多种策略正在研究中。靶向GPRC5D与BCMA或CD38组合的双抗原或多抗原CAR-T结构旨在通过更广泛的靶点覆盖来防止抗原逃逸。表观遗传疗法,如地西他滨或阿扎胞苷,正在被探索用以逆转启动子甲基化并恢复抗原表达。 伴随使用检查点抑制可能使耗竭的T细胞恢复活力并提高治疗持久性。此外,正在开发使用逻辑门控、可切换或组合CAR设计的新方法,以增强肿瘤特异性,同时最小化off-tumour毒性。
结论与未来展望
GPRC5D靶向免疫疗法代表着RRMM患者(特别是那些在BCMA靶向治疗后进展的患者)的一个有前景的治疗途径。然而,大多数GPRC5D靶向药物仍处于早期临床评估阶段,突显了进行III期试验以确定长期疗效并促进其整合到标准临床实践的必要性。
目前的关键挑战包括异质性的临床反应、靶抗原丢失和免疫相关毒性。尽管GPRC5D靶向CAR-T细胞疗法已显示出良好的临床前安全性,但对于管理CRS和神经毒性,临床警惕仍然至关重要。此外,调控GPRC5D表达的转录和表观遗传机制尚未完全了解,该局限性阻碍了生物标志物的发现和治疗增敏策略的发展。
为了解决这些局限性,正在研究新兴平台,如基于纳米抗体的结构、逻辑门控或可切换的CAR设计以及合成Notch系统,以提高肿瘤选择性、减少毒性并克服抗原异质性。早期将GPRC5D靶向疗法整合到治疗过程中,特别是对于具有高危细胞遗传学的新诊断患者,可能有助于延迟复发和抑制克隆演变。将这些药物纳入MRD指导的治疗策略也可能增强反应深度和持久性。
涉及免疫检查点抑制剂、表观遗传调节剂或靶向肿瘤微环境的药物的联合方案可能会进一步增强抗肿瘤活性。GPRC5D靶向疗法成功的临床转化将取决于精心设计的前瞻性试验和支持性的真实世界证据,以确定其在MM精准治疗范式中的疗效、安全性和最佳作用。
参考文献
Wang X, Cui Y, Wang Y, Fang B. Emerging role of G protein-coupled receptor class C group 5 member D-directed immunotherapy in multiple myeloma: Advances, resistance and combination strategies. Br J Haematol. 2025;00:1–14. https://doi.org/10.1111/bjh.70116


