Chin Med:电针疗法缓解慢性炎症痛与焦虑的机制探明
时间:2025-09-10 12:13:14 热度:37.1℃ 作者:网络
慢性疼痛不仅令患者身心俱疲,而且常伴焦虑情绪,二者相互影响,给临床评估与治疗带来巨大挑战。尽管临床上痛苦和焦虑的共病现象日益被重视,但针对这类复杂状况的有效治疗手段仍十分有限。近期,电针疗法(EA)因其独特的神经调控作用,在缓解慢性疼痛及焦虑症状方面展现出潜力,成为研究焦点。

实验设计:解码电针疗法的神经机制
本研究采用了经典的炎症性疼痛动物模型——在小鼠的同侧后足注射完全弗氏佐剂(CFA),成功诱导出持续的炎症痛及焦虑样行为。通过机械感受性测试(von Frey)、开放场、提升十字迷宫和新奇抑制进食等行为学检测,系统评估小鼠的疼痛及焦虑表现。 在CFA注射后第12至17天,每日实施一次电针刺激。利用重组腺相关病毒(rAAV)及化学遗传学技术,精准调控前扣带皮层(ACC)内的钙结合蛋白PV阳性中间神经元及星形胶质细胞的活动。结合免疫荧光染色、形态学分析、膜片钳记录及体内纤维钙成像,揭示细胞层面的功能变化。 此外,针对腺苷A1受体(A1R)在调节神经胶质与神经元间信息传递中的作用,采用其拮抗剂EPCPX及化学遗传学激活星形胶质细胞,探索其对电针镇痛效果的影响。
关键发现:电针疗法调控神经元与胶质细胞,缓解痛焦共病
研究结果显示,电针治疗显著减轻了CFA小鼠的机械痛觉过敏及焦虑样行为。细胞水平上,电针激活了ACC中的PV中间神经元,同时有效抑制了星形胶质细胞的过度激活。 进一步实验发现,单独激活PV神经元或抑制星形胶质细胞,均能模拟电针的镇痛与抗焦虑效果。反之,通过化学遗传学方法激活ACC星形胶质细胞,不仅抵消了电针的治疗作用,还诱发出痛觉过敏及焦虑样行为。 这表明在ACC内,星形胶质细胞与PV神经元之间存在重要的调控网络,彼此相互制衡,决定着痛觉与情绪状态的平衡。
腺苷A1受体:连接星形胶质细胞与PV神经元的桥梁
研究还揭示,腺苷A1受体在星形胶质细胞与PV神经元之间发挥关键的传导作用。阻断A1受体的功能后,电针对痛觉和焦虑的改善作用明显减弱,显示A1受体介导的信号通路是电针疗效的重要机制之一。
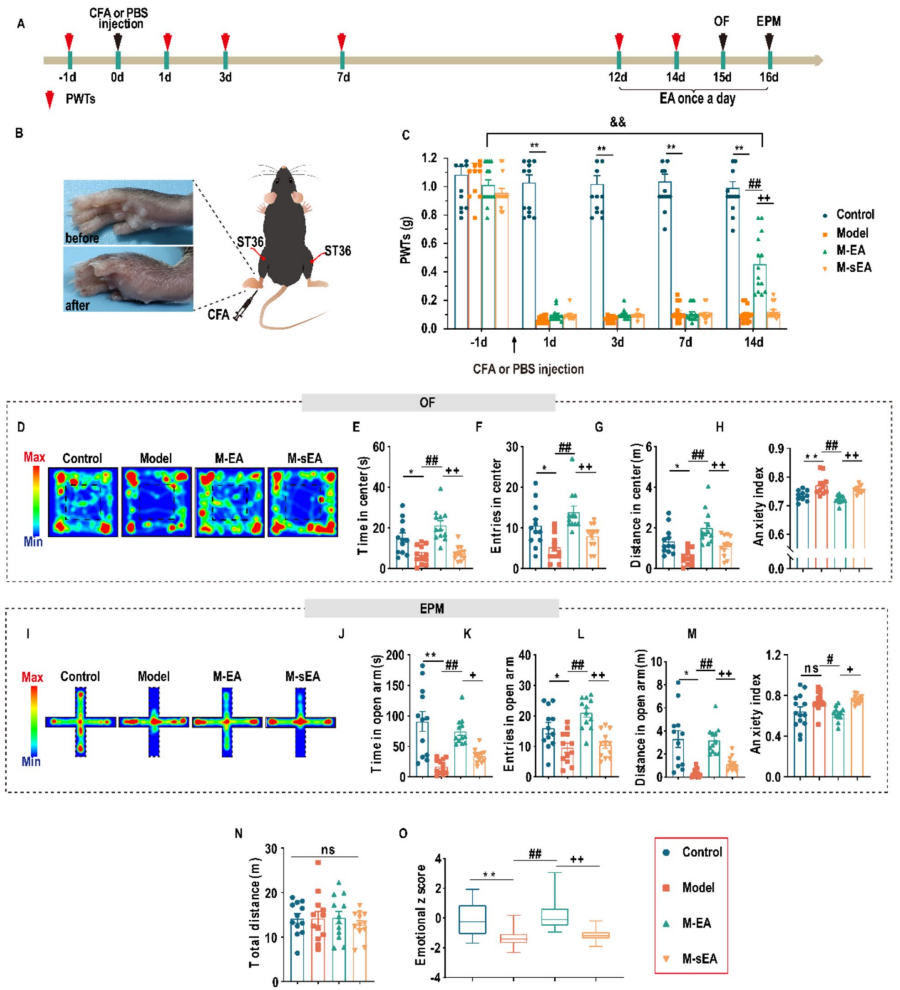
总之,本研究系统阐明了电针疗法通过调节ACC区域神经元和胶质细胞相互作用,缓解慢性炎症性疼痛及伴发焦虑的分子与细胞机制。这不仅丰富了我们对痛焦共病神经机制的认知,也为临床开发更精准、更有效的治疗策略提供了理论依据。 作为一种传统且安全的治疗手段,电针展现出的调控中枢神经系统复杂网络的能力,使其成为慢性疼痛及其情绪共病管理的重要补充方案。未来,结合分子靶点与神经调控技术的深入研究,有望推动个性化、精细化的临床应用。
原始出处
Fang, J., Xu, Y., Qiu, M. et al. Astrocyte inhibition and PV interneuron activation: key mechanisms in electroacupuncture's effect on pain-anxiety comorbidity. Chin Med 20, 143 (2025). https://doi.org/10.1186/s13020-025-01202-1
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。


