中西医融合视角下阿尔茨海默病研究新突破:植物化学物通过5大维度改善溶酶体障碍,关联 “虚瘀痰” 病机与分子机制
时间:2025-09-10 12:13:30 热度:37.1℃ 作者:网络
阿尔茨海默病(AD)是全球首要的痴呆病因,也是全球第五大死亡原因,目前全球约有4500万人受其影响,预计到2050年,欧洲AD发病率将接近翻倍,全球发病率将增至三倍。AD的核心风险因素包括年龄(65岁以上人群风险显著升高)和性别(80岁以上女性发病率高于男性),其主要危害在于进行性认知功能衰退和神经元损伤,严重影响患者生活质量并造成沉重的社会医疗负担。
当前获批的AD治疗药物仅针对临床痴呆阶段,通过调节神经化学系统改善症状,无法阻止疾病进展,且疗效短暂。现代病理模型认为,AD病理进程在临床症状出现前20-30年已启动:首先是脑内β淀粉样蛋白(Aβ)异常聚集形成斑块,随后出现tau蛋白过度磷酸化形成神经纤维缠结、神经元丢失,最终导致认知功能障碍。
近年来,研究焦点转向“疾病修饰策略”,其中溶酶体功能障碍被证实是AD病理的核心驱动因素:溶酶体作为细胞“垃圾处理站”,含约60种水解酶(最适pH4.5-5.0),负责降解错误折叠蛋白(如Aβ和tau);AD中,溶酶体酸化异常(v-ATP酶活性下降)、酶活性抑制(组织蛋白酶B/D/L功能减弱)、膜稳定性破坏(氧化应激或Aβ损伤)导致Aβ和tau清除受阻,形成“病理蛋白堆积→溶酶体功能恶化→更多病理蛋白堆积”的恶性循环。
此外,该研究创新性结合传统中医(TCM)理论:AD的“虚(肾虚、脾虚)、瘀(血瘀、气滞)、痰(痰浊)”病机与现代机制高度契合——肾虚脾虚导致神经元营养不足、溶酶体活性下调;血瘀气滞限制脑微循环、阻断类淋巴系统,加重Aβ潴留;痰浊沉积促进Aβ聚集、激活小胶质细胞,过载自噬-溶酶体轴,三者形成正反馈循环,加速神经退行性变。

-
系统梳理2015年以来的研究证据,明确植物化学物调节AD相关溶酶体功能障碍的核心机制;
-
建立“植物化学物-溶酶体功能-AD病理”的关联网络,筛选具有潜在治疗价值的关键化合物(如厚朴酚、海藻糖、红景天苷);
-
整合中医理论与现代分子机制,提出“多靶点协同调节”的AD治疗框架,克服现有单靶点药物(如仅靶向Aβ清除)的局限性;
-
指出当前研究缺口,为未来植物化学物的临床转化提供方向。
本研究为系统综述,严格遵循PRISMA(系统评价与荟萃分析优先报告条目)规范,设计思路如下:
-
研究类型:聚焦“植物化学物对AD中溶酶体功能、自噬、吞噬作用影响”的同行评审研究,排除会议摘要、非AD研究、无溶酶体机制的研究;
-
纳入标准:①2015年至今发表的英文文献;②至少2个独立研究验证化合物疗效;③提供体内(如APP/PS1转基因小鼠)+体外(如BV2小胶质细胞、SH-SY5Y神经细胞)机制证据;④明确化合物对溶酶体通路的剂量依赖性影响;
-
核心分析维度:①溶酶体功能障碍的病理驱动因素(Aβ/tau、炎症、氧化应激等);②植物化学物的作用途径(吞噬调节、自噬激活、溶酶体酶增强、抗炎抗氧化等);③中医“虚瘀痰”病机与分子机制的对应关系;④化合物-蛋白相互作用网络的拓扑分析。
-
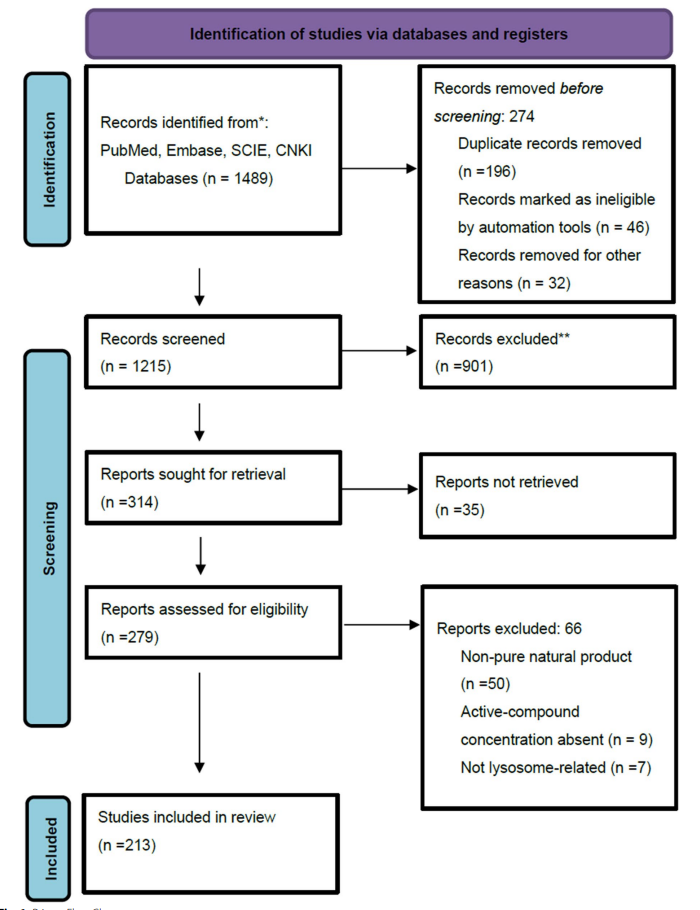
数据库:覆盖中英文核心数据库,包括GoogleScholar、PubMed、ScienceCitationIndexExpanded(SCIE)、中国知网(CNKI);
-
检索词:“Alzheimerdisease”“AlzheimerDementia”“lysosomaldysfunction”“autophagy”“phagocytosis”“naturalcompound”“phytochemicals”;
-
文献筛选流程:通过自动化工具初筛→人工排除重复/非相关文献→全文评估(符合纳入标准),最终纳入213项研究。
-
病理机制拆解:将溶酶体功能障碍分为“酸化异常、酶活性抑制、膜稳定性破坏、自噬-溶酶体融合受阻”4个亚型,分别匹配对应的植物化学物调节策略;
-
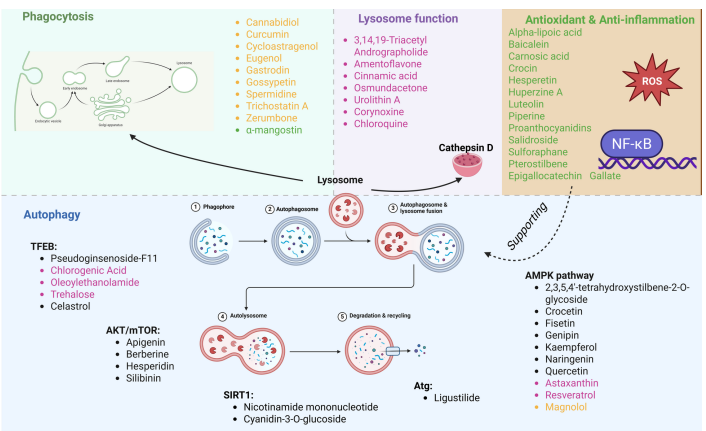
化合物分类:根据作用靶点将植物化学物分为“吞噬调节类、自噬激活类、溶酶体酶增强类、抗炎抗氧化类、AMPK能量调节类”5大类;
-
网络构建与分析:通过PubChem获取化合物结构,SwissTargetPrediction预测潜在靶点(概率得分>0),UniProt标准化靶点名称,GeneCards获取AD相关靶点;使用Cytoscape3.9.1构建“化合物-炎症/氧化应激介质-自噬-溶酶体蛋白”相互作用网络,分析节点度、中介中心性、紧密中心性,确定核心模块与关键靶点。
-
虚:肾虚导致的progranulin表达下降、脾虚导致的能量代谢不足,均下调溶酶体生物发生相关基因(如TFEB);
-
瘀:脑微循环障碍减少溶酶体所需营养(如氨基酸),且缺氧诱导ROS生成,破坏溶酶体膜;
-
痰:“痰浊”对应Aβ聚集和脂滴沉积,后者可堵塞自噬-溶酶体融合通道,导致自噬流停滞。
小胶质细胞通过吞噬作用清除胞外Aβ,是溶酶体依赖的核心Aβ清除途径,关键化合物包括:
-
姜黄素(Curcumin):通过上调TREM2(吞噬受体)、下调CD33(抑制性受体),增强小胶质细胞对Aβ的吞噬;同时聚集于溶酶体,调节膜通透性,激活酪氨酸激酶信号,促进Aβ降解;在Tg2576小鼠中,160-500ppm剂量可减少斑块负荷并改善认知;
-
花青素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside):激活PPARγ信号,促进小胶质细胞从促炎M1型极化为抗炎M2型,上调TREM2表达,在APP/PS1小鼠中,30mg/kg/d(16周)可降低脑内Aβ40/42水平,改善空间工作记忆;
-
丁香油酚(Eugenol):抑制坏死性凋亡(下调pMLKL/MLKL),保护神经元;同时促进小胶质细胞M2极化,上调MACRO(Aβ吞噬相关基因),在5×FAD小鼠中,10-30mg/kg/d可缩短Morris水迷宫逃避潜伏期,增加目标象限停留时间。
自噬是溶酶体降解胞内Aβ和tau的关键途径,核心化合物通过调控AMPK/mTOR、TFEB等通路发挥作用:
-
京尼平(Genipin):激活SIRT1/LKB1/AMPK信号级联,抑制mTOR/p70S6K轴,增强自噬流;在3×Tg-AD小鼠中,可降低tau过度磷酸化,增加LC3-II/LC3-I比值(自噬激活标志);
-
伪人参皂苷F11(PseudoginsenosideF11):通过钙调磷酸酶(calcineurin)介导TFEB去磷酸化,促进其入核,上调溶酶体相关基因(Lamp1、Ctsd、Map1lc3b);在SAMP8小鼠中,2-16mg/kg/d可恢复自噬-溶酶体流,改善认知;
-
藏红花酸(Crocetin):激活STK11/LKB1-AMPK通路,磷酸化ULK1(自噬起始激酶),抑制mTOR;在N9小胶质细胞中,25μM可降低Aβ42水平,在APP/PS1小鼠中,5-20mg/kg/d可增加海马LC3B-II表达,减少斑块。
溶酶体功能恢复可增强tau降解,关键化合物包括:
-
3,14,19-三乙酰穿心莲内酯(ADA):通过抑制Akt/mTOR通路,增加LC3(自噬标志)与LAMP1(溶酶体标志)的共定位,促进自噬体-溶酶体融合;在3×Tg-AD小鼠中,5mg/kg剂量可减少tau聚集,改善空间记忆;
-
肉桂酸(Cinnamicacid):结合PPARα核受体,促进其与TFEB启动子结合,激活溶酶体生物发生;在5×FAD小鼠中,100mg/kg/d(30天)可上调LAMP2和组织蛋白酶D表达,降低脑内Aβ负荷;
-
海藻糖(Trehalose):不依赖mTOR抑制,通过短暂增加溶酶体膜通透性释放Ca²+,激活钙调磷酸酶,促进TFEB去磷酸化;同时上调progranulin表达,维持溶酶体稳定性;在APP/PS1小鼠中,0.1-10mM剂量可减少Aβ生成,恢复学习记忆。
炎症和氧化应激是溶酶体膜损伤的主要诱因,核心化合物通过调控NF-κB、Nrf2等通路发挥作用:
-
红景天苷(Salidroside):结合Nrf2并阻断其与KEAP1的相互作用,促进Nrf2入核,上调SIRT3(线粒体抗氧化蛋白),减少ROS生成;在5×FAD小鼠中,1mg/kg/d(12周)可降低海马MDA(氧化应激标志)水平,改善空间记忆;
-
黄芩苷(Baicalein):非竞争性抑制BACE1(Aβ生成关键酶),同时激活Nrf2/HO-1通路,增强抗氧化能力;其血脑屏障穿透性良好,在3×Tg-AD小鼠中,20-40mg/kg/d可减少皮质Aβ斑块,降低IL-1β水平;
-
藏红花素(Crocin):抑制Aβ诱导的caspase-3激活(抗凋亡),同时上调SOD、GSH-Px活性,减少ROS;在BALB/c小鼠中,0.5-2μM可改善Y迷宫自发交替行为,减少神经元凋亡。
通过Cytoscape构建的网络包含两个核心模块:
-
模块1(植物化学物簇):含46种化合物,核心节点为厚朴酚(Magnolol)、海藻糖(Trehalose)、红景天苷(Salidroside),三者均具有“调节溶酶体+抗炎+抗氧化”的多靶点特性;
-
模块2(病理-信号簇):含112个溶酶体相关蛋白(如Beclin-1、LC3-II、mTOR、AMPK)和5个核心病理介质(Aβ、IL-6、IL-1β、TNF-α、ROS);
-
关键相互作用:模块1的化合物通过模块2的溶酶体蛋白间接调控病理介质(如厚朴酚通过PPARγ→LXR→ApoE通路促进Aβ吞噬),形成“化合物-溶酶体蛋白-病理改善”的调控轴。
-
模型异质性:不同AD模型(如APP/PS1、5×FAD、3×Tg-AD)对植物化学物的反应存在差异,例如α-倒捻子素(α-mangostin)在早期模型中有效,但在晚期tauopathy模型中无效;
-
临床转化缺口:多数研究为细胞或小鼠实验,缺乏III期临床数据;部分化合物(如白藜芦醇)虽能穿透血脑屏障,但生物利用度低(<1%),且高剂量可能引发肝毒性;
-
机制研究不完整:多数研究聚焦自噬,忽视溶酶体直接功能(如酶活性、膜稳定性)的检测;且“植物化学物-溶酶体pH-病理蛋白清除”的因果关系未完全明确;
-
联合用药证据不足:中医强调“复方协同”,但当前研究多关注单一化合物,缺乏多成分联合调节溶酶体的体内证据。
-
核心机制框架:植物化学物通过5个相互关联的维度改善AD溶酶体功能障碍——①增强小胶质细胞吞噬作用(清除胞外Aβ);②激活自噬-溶酶体流(清除胞内Aβ/tau);③恢复溶酶体酸化与酶活性(增强降解能力);④抗炎抗氧化(保护溶酶体膜);⑤调节AMPK信号(维持溶酶体能量供应);
-
关键化合物价值:厚朴酚、海藻糖、红景天苷为核心候选化合物,具有“多靶点、低毒性”优势,可作为AD疾病修饰治疗的潜在前体;
-
未来研究方向:①开发靶向溶酶体的药物递送系统(如纳米颗粒),提升脑内浓度;②探索植物化学物与现有AD药物(如胆碱酯酶抑制剂)的协同作用;③建立“溶酶体功能障碍”的早期生物标志物(如脑脊液组织蛋白酶D水平),指导精准干预;④基于中医“虚瘀痰”病机,设计复方植物提取物,实现多通路协同调节。
Yuan, M., Nguyen, T.T.T., Gibb, A.J. et al. Potential of phytochemicals in the treatment of Alzheimer disease by modulating lysosomal dysfunction: a systematic review. Chin Med 20, 138 (2025). https://doi.org/10.1186/s13020-025-01204-z
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。