皮肤基底细胞癌的治疗新进展
时间:2025-09-11 12:13:52 热度:37.1℃ 作者:网络
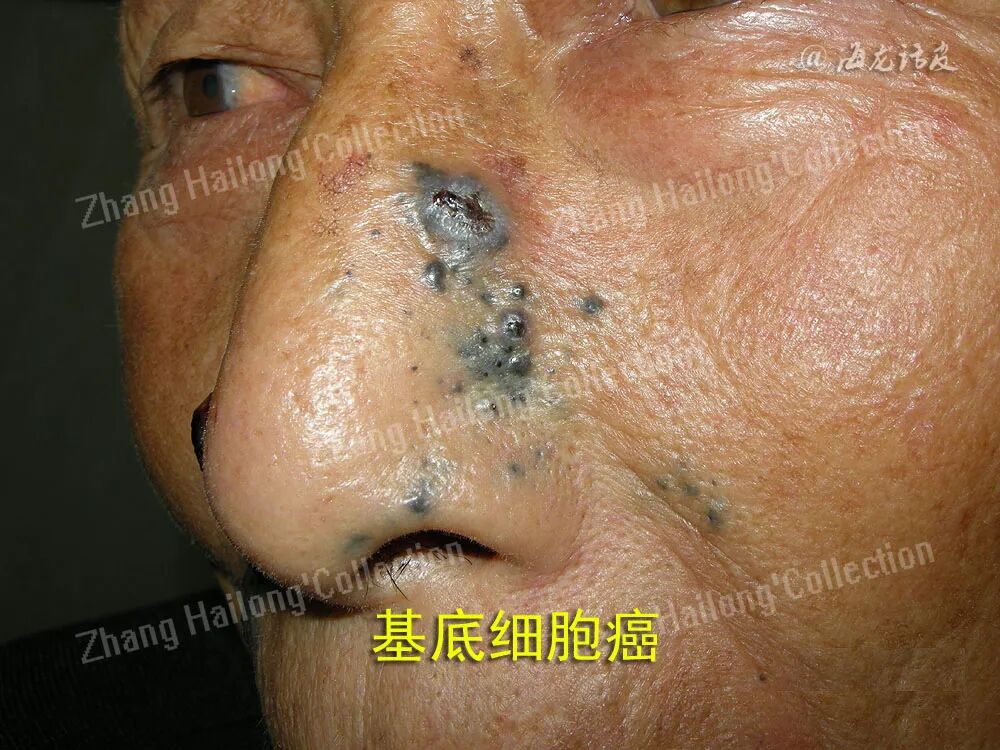
皮肤基底细胞癌(basal cell carcinoma,BCC)作为最常见的皮肤肿瘤,占所有非黑素瘤皮肤癌的85%以上。BCC的发病主要危险因素为紫外线暴露,可能还与家族肿瘤史、电离辐射、免疫抑制等因素相关。BCC在白种人中的发病率 明显高于黄种人,且有研究显示BCC的发病率在逐年升高,这可能与人口老龄化有一定的关系。BCC的组织发生学起源目前仍存在争议,但大多数研究认为肿瘤细胞起源于基底层细胞。BCC的发病机制复杂,是环境、表型与遗传因素互相作用的结果。近年来随着BCC发病机制的研究,BCC治疗的相关策略也在不断更新。
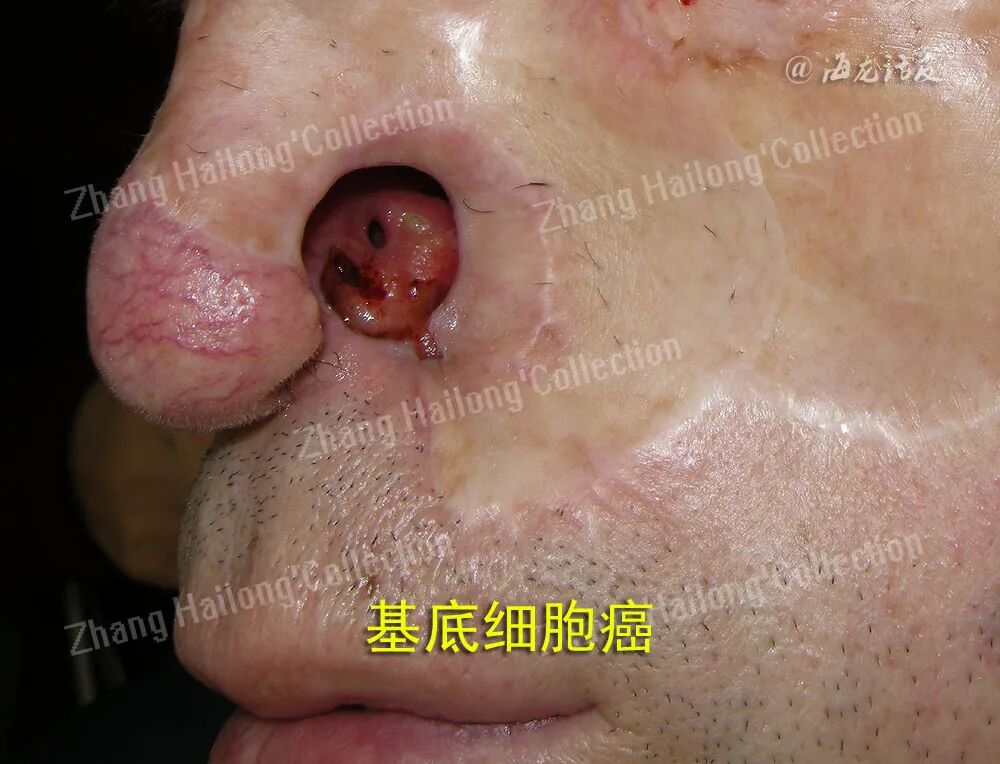
1.手术治疗
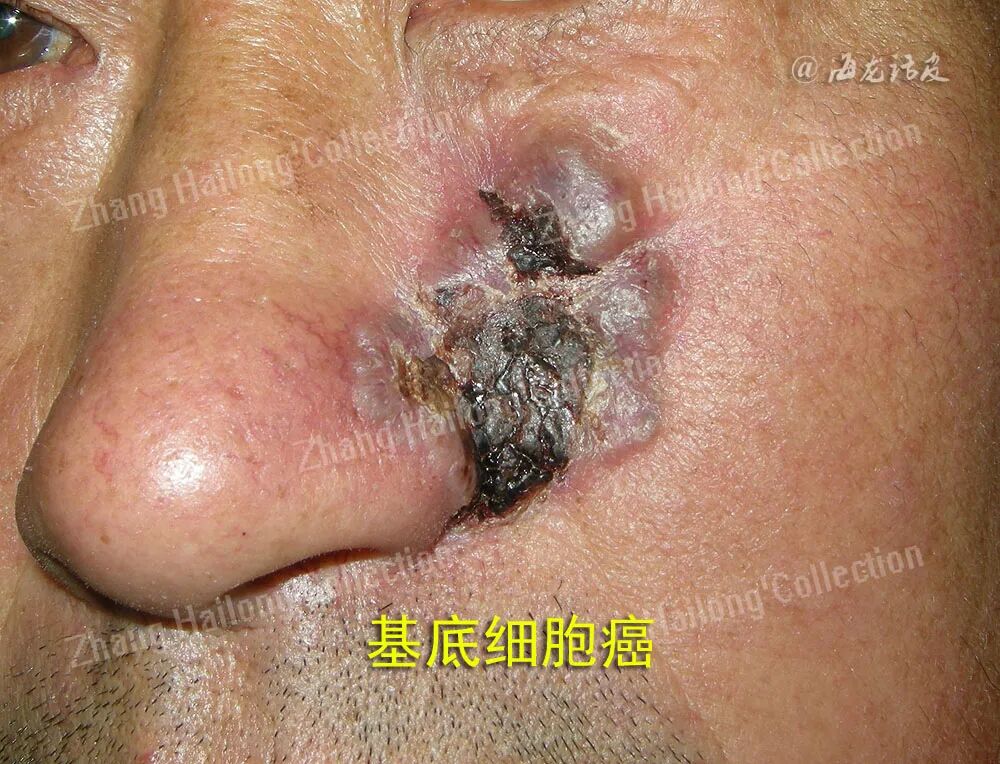
对临床高度怀疑皮肤肿瘤的病变,均应行组织病理活检。对于组织病理明确为BCC的皮损, 一线治疗手段推荐手术治疗,而与传统手术相比,尤其是在高危型BCC的治疗中,莫氏手术具有更高的安全性,在精准切除肿瘤的同时,能够保留更多的正常组织,因此,莫氏手术是BCC首选的治疗方案。相关研究表明,莫氏手术后是否存在肿瘤清除不彻底与性别、发病部位、病灶大小、活检取材、是否存在色素沉着相关,男性、高危部位、大病灶、小范围取材与非色素性BCC在接受莫氏手术时具有更高的残余肿瘤风险,而BCC的病理亚型并不影响手术效果。
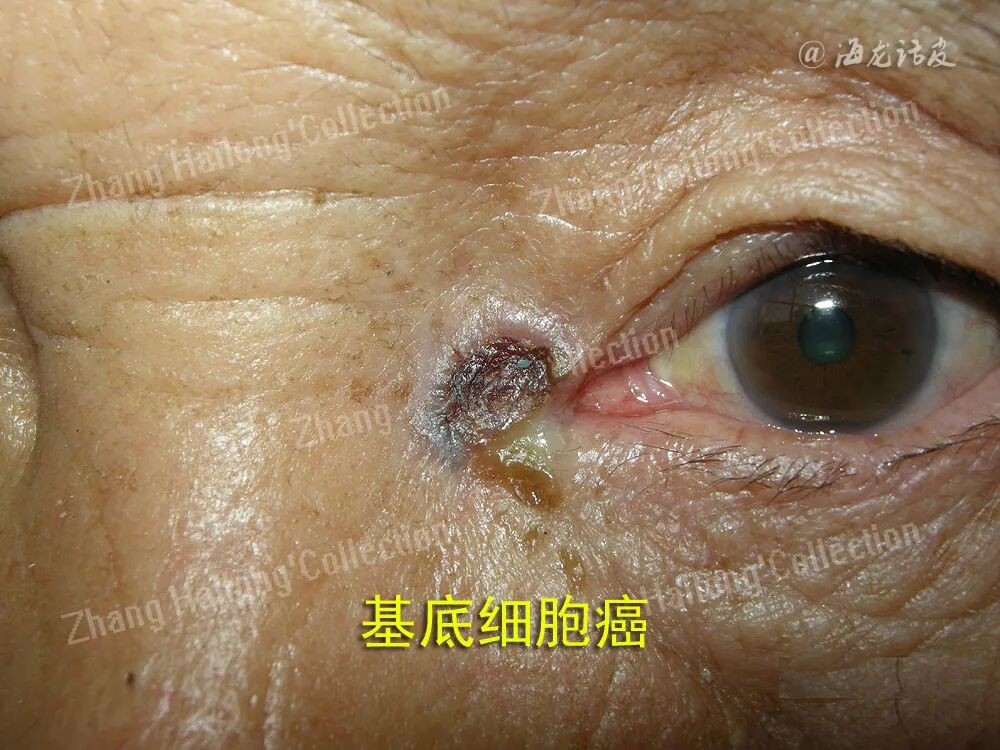
但莫氏手术也存在耗时、难度高、劳动量大的问题,基于此,低危型的BCC更倾向于标准手术切除治疗。有循证证据表明,标准手术切除的BCC五年复发率为5.2%, 而莫氏手术则为3.2%,差异并不显著。在选择标准手术切除时,应注意结合术前选择合适的手术切缘,术后应规范随访。此外,刮除术与电干燥术也被应用于局限性BCC的治疗中,但其有效性明显低于传统手术治疗,往往需结合切缘术后病理评估。
2.光动力治疗
对于低危型、大面积及手术禁忌的BCC来说,光动力疗法(photodynamic therapy,PDT)可作为一种治疗手段。目前PDT治疗BCC常用的光敏剂为原卟啉IX,临床上主要应用5-氨基酮戊酸及其甲基衍生物。相较于手术治疗,PDT可以达到更好的美容效果,但其肿瘤清除率与复发率均明显高于手术治疗。同时,也有研究表明,PDT通过免疫作用,可以增强治疗效果并增强BCC患者的抗肿瘤免疫力的能力。
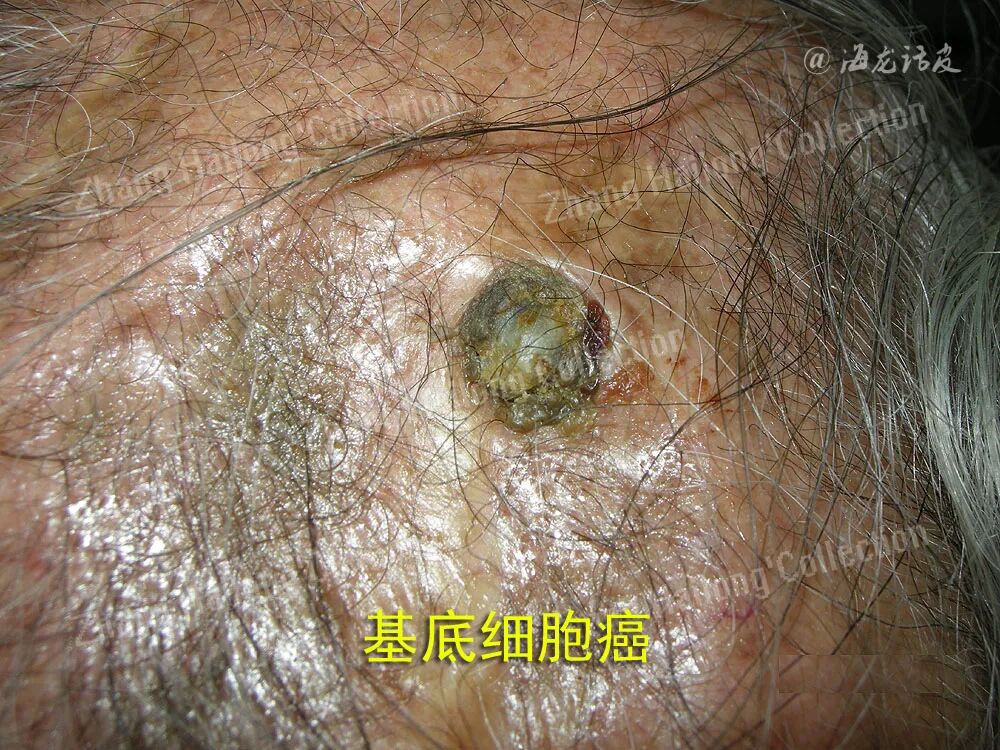
在一项关于PDT疗效的前瞻性观察性多中心研究中,发现肿瘤厚度是影响PDT治疗效果的关键因素,较厚的结节性BCC反应率较浅薄病灶低,研究认为PDT治疗BCC的肿瘤厚度阈值为2mm;同时证实肿瘤蛋白p53阳性患者疗效较好,而β-catenin蛋白和葡萄糖转运蛋白1(glucose transporter1,GLUT1)表达增加与耐药相关,GLUT1是一种广泛存在于人体细胞中的膜蛋白,主要负责葡萄糖的易化扩散。因此高糖酵解活性的肿瘤对PDT反应较差,二甲双胍作为糖酵解抑制剂,有望改善耐药性肿瘤的预后。PDT治疗BCC仍有巨大的研究前景。
3.冷冻治疗
尽管手术是BCC治疗的基石,在低危型的浅表BCC中,仍有其他治疗手段可供选择,其中包括冷冻治疗。冷冻治疗主要应用于边界清晰、没有深部浸润的BCC中。关于BCC冷冻治疗的研究中,肿瘤清除率与复发率有很大差异。目 前认为,冷冻治疗的有效性仍低于手术,但对比而言,冷冻治疗具有更好的美容效果与功能保全。
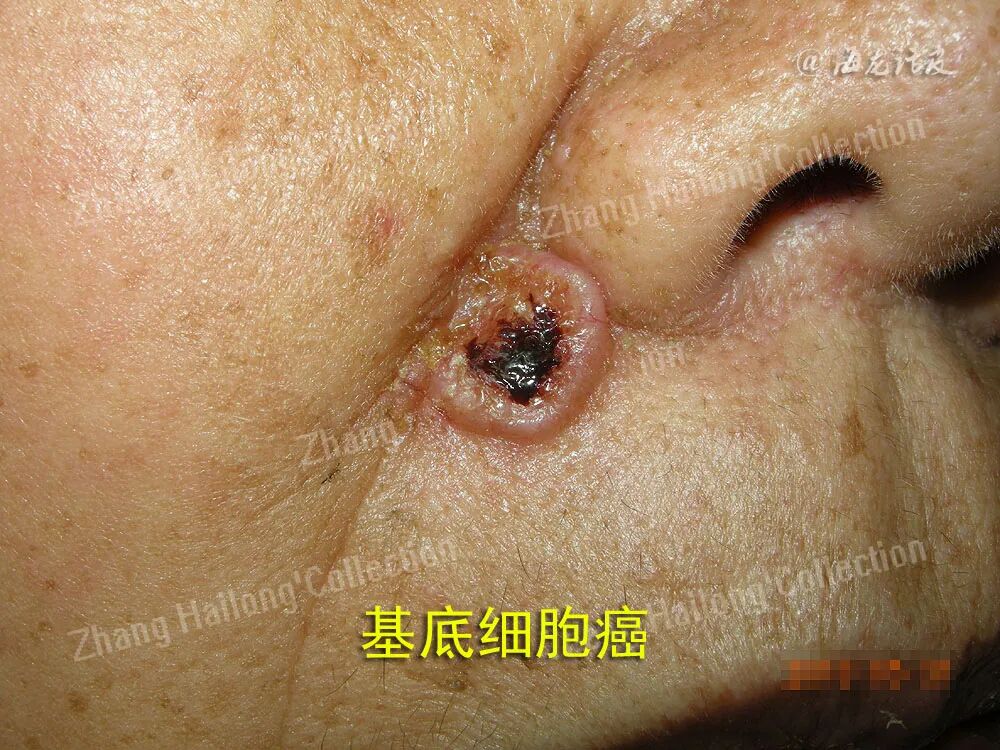
4.局部药物治疗
局部治疗药物包括5%咪喹莫特、5-氟尿嘧啶(5-Fluorouracil,5-FU)、巨大戟醇甲基丁烯酸酯(ingenolmebutate,IM)等。5%咪喹莫特作为免疫调节剂,可直接促肿瘤细胞凋亡,并被证明可以抑制Hedgehog信号通路(hedgehog signaling path-way,Hh通路)。一项系统性研究发现,咪喹莫特对结节型BCC的临床与组织学清除率高于70%,尽管远低于手术治疗,但在美观要求上,咪喹莫特仍有其优势。相对5%咪喹莫特而言,5-FU的相关研究较少。5-FU作为一种核苷类似物,可以影响肿瘤细胞中脱氧核糖核酸(deoxyri-bonucleic acid,DNA)的合成,从而清除病灶,其对浅表型BCC的作用明显优于非浅表型。IM是一种细胞死亡诱导剂,已被美国食品药品监督管 理局批准用于日光性角化的治疗。
一项小样本量的研究发现,局部应用IM治疗后,约有50%~62.5%的浅表型BCC得到了清除。尽管如此,IM治疗BCC的有效性与安全性仍需进一步的研究证实。其他局部外用药物也有少量研究报道显示对BCC的治疗有一定的作用。例如,他扎罗汀等维A酸类药物能够诱导线粒体功能障碍、 产生活性氧,并激活细胞凋亡通路,同时还可以抑制BCC中过度激活的PTCH1-Gli信号通路和PI3K-AKT-mTOR信号通路,以达到清除肿瘤的目的。茄属甾体糖苷生物碱也可通过诱导细胞凋亡和阻碍细胞生长、迁移和侵袭治疗皮肤肿瘤。但相关药物治疗BCC的安全性与有效性仍需进一步研究证实。
5.放射治疗
放射治疗可作为具有手术禁忌症、复发、大范围的BCC患者的治疗选择,可分为远程治疗和内部近距离治疗,远程治疗是指利用离体表有一定距离的射线装置或密封放射性核素源产生的外部粒子(如中子、质子或重离子)或辐射,对患者病灶进行照射治疗;内部近距离治疗则是一种将放射源直接放置在肿瘤内部或附近的放射治疗方法。两者各有优劣,经研究认为,远程放疗的控制率与复发率仅次于手术,但其穿透能力强,破坏范围大,所造成的毁容风险要高于手术;而内部近距离放疗精准,破坏面小,其保容效果尚可接受,但同时,其穿透力不强,辐射传递深度<2mm,因此深层的治疗是不现实的。
6.激光
激光消融术也可用于低危型BCC的治疗。 一项荟萃性分析提到,在低危型BCC的治疗中,钕掺杂的钇铝石榴石(neodymium-dopedytriuma-luminumgarnet,ND:YAG)激光治疗的复发率为3.1%(平均随访7.9年),且疤痕形成和色素沉着不良的发生率较低,CO2激光治疗的复发率为9.4%(平均随访2.1年),CO2激光治疗效果较Nd:YAG激光差。但由于激光治疗无法实现组织病理检查,因此使用受限,近年来随着反射式共聚焦显微镜(reflectance confocal microscopy,RCM)诊断技术水平的发展,激光治疗BCC清除率得以提升。
7.靶向药物治疗
近年来,靶向分子治疗是BCC治疗的热门议题。维莫德吉和索立德吉是已被FDA批准上市用于治疗转移性或手术及放疗禁忌的局部晚期BCC的口服Hh通路抑制剂(hedgehog pathway in-hibitors,HPI)。在约70%~90%的散发BCC 中可见PTCH基因突变,PTCH基因通过编码一种可以结合并抑制天然的Hh通路激活剂SMO蛋白的跨膜蛋白,从而抑制Hh通路的激活,而PTCH基因的突变则引起Hh通路的异 常激活。维莫德吉和索立德吉主要通过靶向SMO蛋白,从而抑制肿瘤。中外研究均发现,在使用Hh通路抑制剂治疗BCC的过程中,患者最常出现(≥20%)的不良反应包括肌肉无力、食欲下降、脱发、腹泻等,这被认为是Hh通路抑制的类效应,在后续的Hh通路抑制剂的研发中也很难避免。一项荟萃性分析显示维莫德吉治疗BCC的客观缓解率为68.5%,索立德吉的客观缓解率为50.1%,而在治疗中肌肉痛性痉挛是两种药物最常见的不良事件,且在维莫德吉治疗中发生率(70.5%)要高于索立德吉(61.0%)。
对于HPI不耐受的BCC患者,有报道显示可使用程序性死亡受体-1(programmed death-1,PD-1)抑制剂作为一线全身治疗替代药物。PD-1抑制剂帕博利珠单抗在治疗转移性 BCC时表现优秀,甚至Hh通路抑制剂治疗失败的患者也对帕博利珠单抗反应良好。NMSC对PD-1阻断反应良好,同时在运用PD-1抑制剂治疗的黑色素瘤患者中,BCC与鳞状细胞癌(squamous cell carcinoma,SCC)的发生率也可见降低。由于PD-1抑制剂的免疫抑制作用,其在发挥抗癌作用的同时,也可出现免疫相关不良反应。目前关于PD-1抑制剂治疗BCC的有效性研究仍处于探索阶段,需要进一步研究予以佐证。而化疗可作为HPI不耐受或耐药的转移性及局部晚期BCC患者二线治疗方案,但由于转移性及晚期BCC在临床上较为少见,因此化疗方案尚未得到完全验证,已有的研究中基于顺铂的化疗方案最为常见。Hh信号通路的传导最终能够激活GIL转录因子,进而调控一系列下游基因的表达。伊曲康唑作为唑类抗真菌药物,被发现同时具有GIL转录因子抑制剂的作用。其作用机制在于伊曲康唑能够与Hh信号通路中的关键受体SMO蛋白发生相互作用,从而有效抑制整个Hh信号通路的活性,进而间接抑制GLI转录因子的功能,阻断其对下游基因的调控作用;三氧化二砷也被认为可以靶向GLI转录因子(GLI1和GLI2)来拮抗 Hh通路,主要是降低GLI2的稳态水平。
干扰素具有抗病毒、抗增殖、免疫调节的作用,同时还被证明对细胞分化有作用。虽然干扰素被认为可作为BCC的非手术治疗选择,更具美容效果,但对比手术治疗,其有效性仍较低。近年来,免疫原性细胞死亡(immunogenic cell death,ICD)已成为抗瘤治疗新概念,溶瘤肽LTX-315 通过其膜溶解模式诱导ICD,在抗癌的同时,还被证明可重塑肿瘤微环境,这使得LTX-315成为其他免疫疗法的理想伴侣。关于LTX-315治疗BCC的相关文献较少,但已有医药公司关于LTX-315治疗BCC的临床试验进入II期阶段。RNA干扰(RNAinterfer-ence,RNAi)是一种自然存在的防御机制,可防止外源核算的入侵和基因表达的控制,小干扰RNA(small interfering RNA,siRNA)则是哺乳动物中RNAi的介质。近年来siRNA药物的研究为许多疾病尤其是肿瘤的治疗提供了创新思路。相关研究表明,转化生长因子β1(transforming growth factor-betal,TGF-β1)可以调节紫外线照射后人角质形成细胞中微小RNA(microRNA,miRNA)的表达水平,并诱导环氧化酶-2(cy-clooxygenase-2,COX-2)的表达增加。这可能与细胞增殖、炎症反应及抗凋亡相关,提示TGF-β1和COX-2在皮肤癌的发生和发展中具有重要作用。而TGF-β1/COX-2双靶点抑制剂,siRNA药物STP-705治疗BCC也已进入II期临床试验,为未来BCC的治疗提供了新思路。
8.结语及展望
对于BCC的治疗,根据其风险划分应制定不同的治疗方案,目前莫氏手术仍是最佳治疗方案。但BCC作为好发于头面部、老年人的皮肤肿瘤,患者的美容需求及功能保全要求不可忽视,非手术治疗方式相比手术治疗则更有优势,但由于非手术治疗方式无法直接提供病理检查,仍存在局限性,因此在治疗过程中及治疗后随访中结合RCM等影像学检查或可提高治疗方案的清除率、降低复发率,相关治疗方案仍需进一步验证。对于晚期及转移性BCC,手术难度大,Hh通路抑制剂提供了更好的选择,在HPI不耐受或耐药的患者中,可选择PD-1抑制剂、化疗等治疗方案,相关疗效及个体化选择仍需进一步研究。而新型溶瘤肽药物、siRNA药物的研发仍需更多临床试验数据的支持。综上所述,随着未来技术的创新和多学科领域的合作,BCC的治疗将更为个体化,患者的预后与生活质量均能得到提升。
参考文献:
1.张元林,孟秀梅,慈超.皮肤基底细胞癌的治疗新进展[J].皮肤性病诊疗学杂志,2025,32(8):613-618.
2.国家皮肤与免疫疾病临床医学研究中心,中国医师协会皮肤科分会.中国皮肤基底细胞癌诊疗指南(2023版)[J].中华医学杂志,2024,104(6):391-410.
3.贾子悦,庄哲,李欣辉等.索立德吉治疗基底细胞癌并文献复习[J].皮肤性病诊疗学杂志,2024,31(7):484-488.
4.其他文献略。


