Nature:破译人脑衰老机制!基于单细胞多组学技术构建人脑衰老图谱,揭示转录组及基因组动态变化
时间:2025-09-15 12:15:53 热度:37.1℃ 作者:网络
随着年龄增长,人类大脑及机体细胞会持续积累损伤,这是衰老过程的核心特征之一。在人脑中,前额叶皮层(PFC)作为调控认知功能的关键脑区,其年龄相关的分子变化直接影响晚年认知能力。传统批量(bulk)RNA测序技术难以捕获细胞类型特异性变化,而人脑细胞类型复杂且功能专一,这导致人们在理解人脑内分子异质性细胞的功能时存在重大知识缺口。
近年来,单细胞基因组技术的发展,如单细胞全基因组测序(scWGS)、单细胞RNA测序(scRNA-seq)和单核RNA测序(snRNA-seq)等,推动了脑细胞分类及年龄相关变化研究,但目前人们对健康衰老过程中脑内转录组与基因组变化的理解仍不完整,这些变化很可能为某些脑部疾病的发生奠定基础。
近日,美国马萨诸塞大学医学院的研究团队通过整合snRNA-seq、scWGS和空间转录组学MERFISH技术,系统揭示了从婴儿到百岁老人时期人类PFC的动态变化。结果显示,婴儿期存在特有的神经发育基因富集细胞簇,所有细胞类型中维持基本稳态的基因均随年龄增长普遍下调,但神经元特异性基因表达保持终身稳定。此外,还发现了两个年龄相关的体细胞突变特征,分别与基因转录激活和抑制相关;神经元体细胞突变率与基因长度、表达水平存在显著关联。总之,该研究为人脑发育与衰老机制提供了关键见解,清晰揭示了衰老人脑转录组与基因组的动态规律。

为捕捉人类大脑衰老动态,研究团队对19例神经正常捐赠者的新鲜冷冻PFC样本进行分析,年龄跨度从0.4岁婴儿至104岁老人,通过snRNA-seq解析转录组、scWGS分析基因组,并利用MERFISH验证snRNA-seq结果。经质控和过滤,共保留367,317个细胞核;通过降维聚类获得31个细胞簇,并注释出多种细胞类型,包括兴奋性神经元、抑制性神经元以及各种神经胶质细胞。
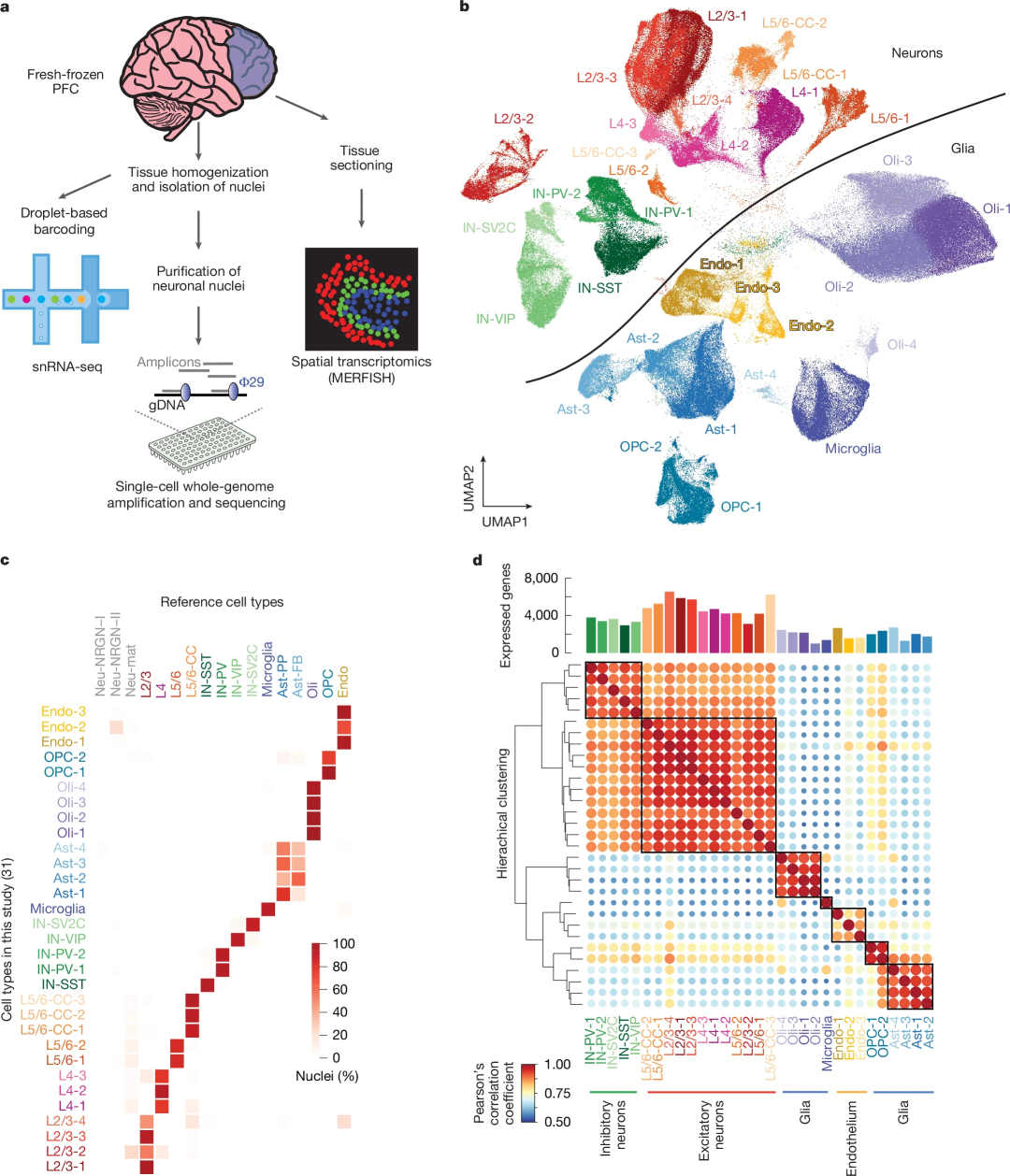
图1. 研究设计和表征
研究发现,生命周期内脑细胞整体比例无年龄差异:神经元与胶质细胞、兴奋性与抑制性神经元比例未变,非病理性衰老中也无神经元亚型丢失或反应性小胶质细胞扩张。但鉴定出两类婴儿特异性细胞亚簇:一类神经元类似L2/3神经元,却同时表达L4、L5/6神经元标志基因及神经发育、迁移相关基因;另一类星形胶质细胞高表达HES5、ID4等未成熟标志物。
此外,少突胶质前体细胞(OPCs)比例随年龄增长显著下降(婴儿期最高),成熟少突胶质细胞比例升高。值得注意的是,IN-SST抑制性神经元转录组突变率在老年时显著升高,IN-SST和IN-VIP的标志基因(SST、VIP)表达随年龄显著下降,表明抑制性神经元功能在衰老过程中受损。
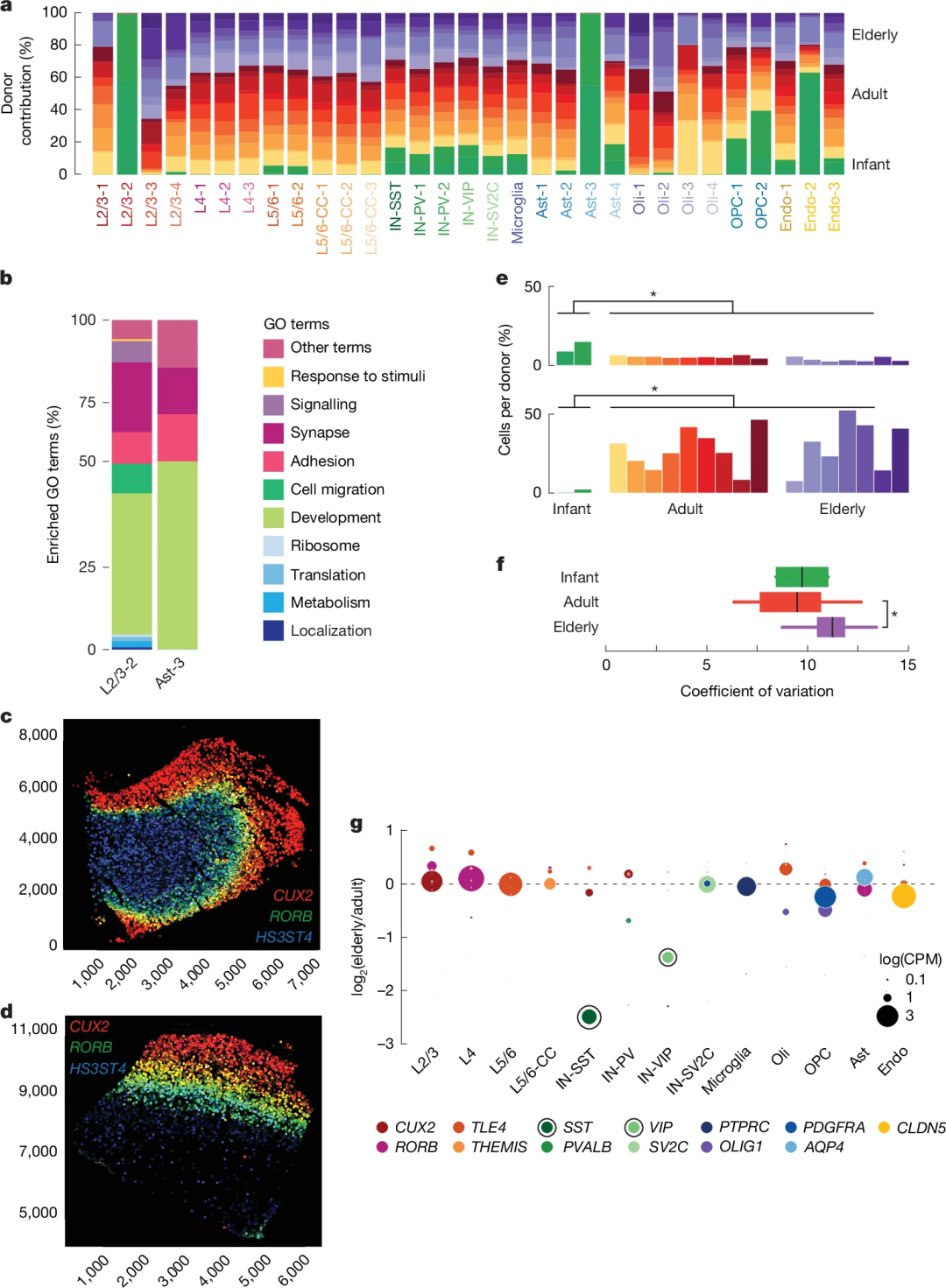
图2. 全生命周期脑细胞转录状态的变化
通过对老年组和成年组PFC细胞进行差异表达分析,研究团队发现2,803个基因随年龄发生显著变化,其中大多数为下调基因,且多存在于神经元中。衰老大脑各细胞类型的共性特征是管家基因的广泛下调,这些基因涉及翻译、代谢、核糖体功能等基本细胞过程;神经元特异性基因表达保持稳定。DepMap分析显示,这些下调的基因可能是细胞存活必需基因。
值得注意的是,核糖体蛋白基因(RPS3A、RPL26等)在13种细胞类型的11种中显著下调,线粒体电子传递链编码基因也呈现协同下调趋势。MERFISH实验进一步证实,核糖体和线粒体相关基因(40岁后显著下降)、即刻早期基因均随年龄下降,提示神经元代谢活性随衰老逐渐减弱。
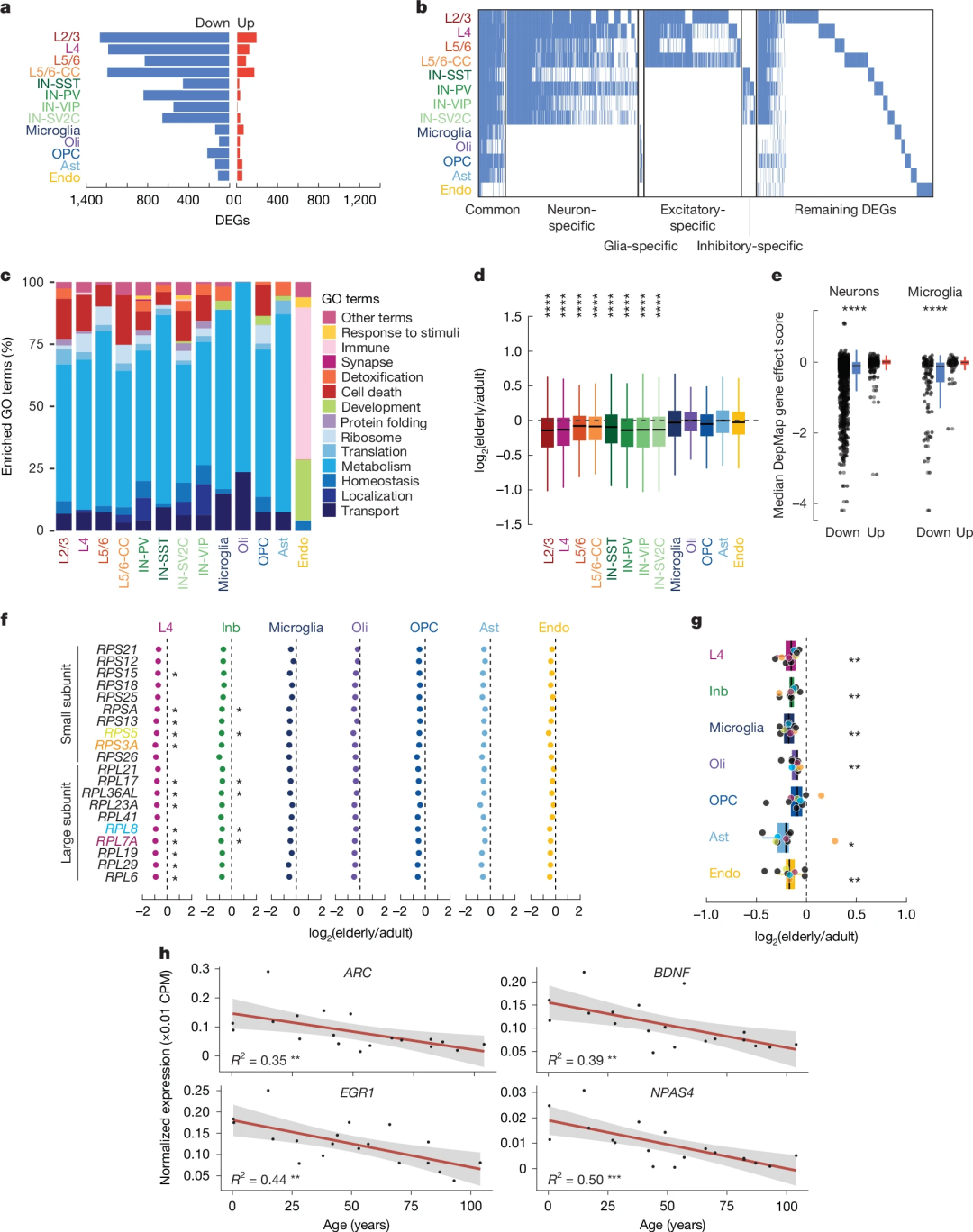
图3. 跨细胞类型基因的常见下调
体细胞突变在人体多种细胞类型中随年龄累积,为解析神经元体细胞突变率与转录水平的关联,研究团队对同一供体、同一脑区的NeuN +神经元进行scWGS,并用SCAN2识别体细胞单核苷酸变异(sSNVs)。结果显示,sSNVs以每年15.1个/神经元的速度累计,其整体突变谱与COSMIC中的年龄相关SBS5特征高度相似。
进一步分析识别出两个突变特征A1和A2。A1与SBS5相似,与供体年龄强相关;每年积累约12.1个突变,与神经元基因表达水平正相关;富集于高表达基因和活跃染色质区域。A2每年累计3个突变,与基因表达水平呈负相关;与发育嵌合突变和SBS30特征相似,富集于低表达基因和基因间区,含氧化损伤相关变异及高比例CpG位点C>T突变。
总之,A1与A2的来源和生物学特性均不同。A1是神经元年龄相关sSNV的主要来源,其形成与转录活性直接相关;A2在发育早期更活跃,但在衰老过程中持续累积于转录沉默区域。
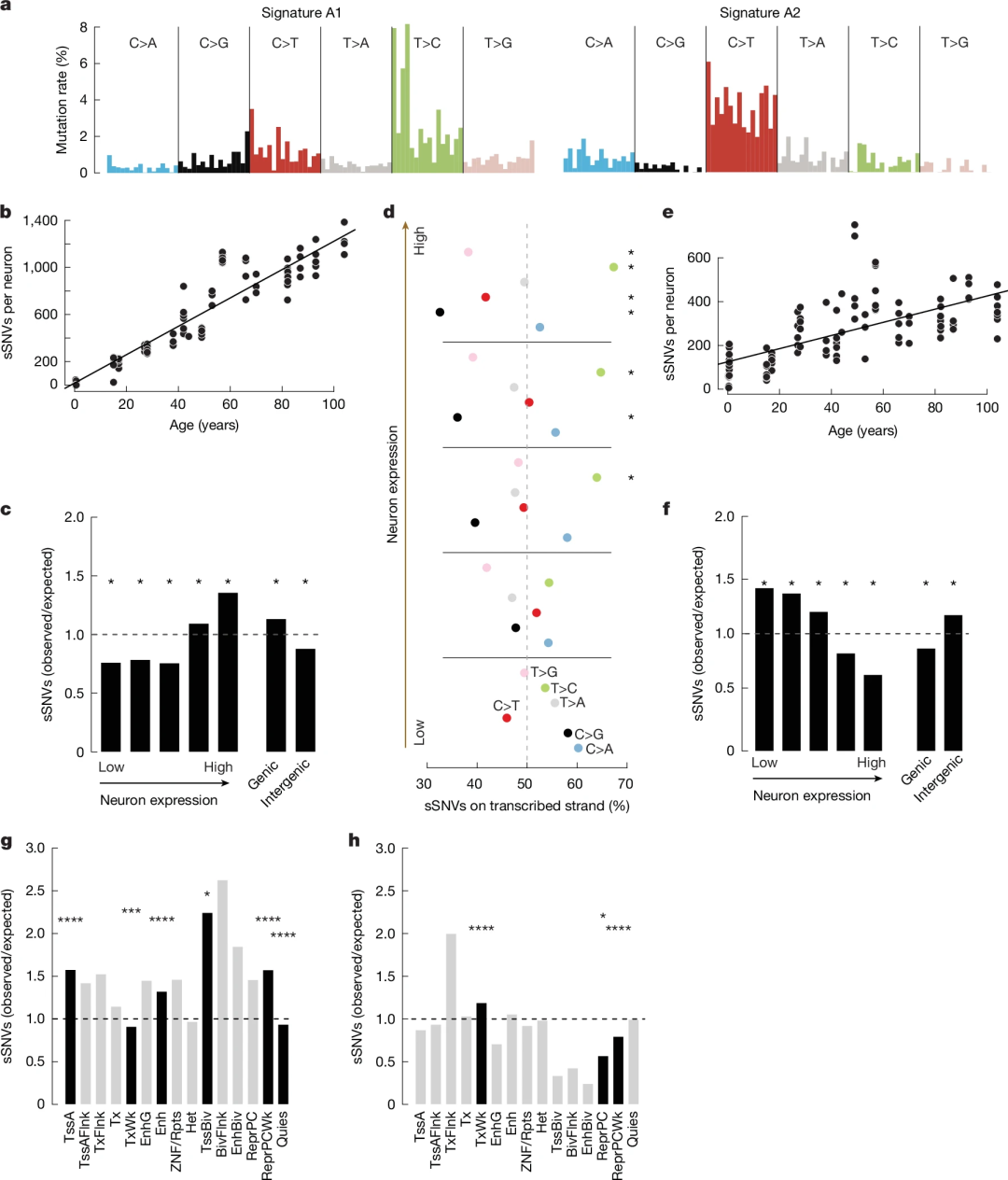
图4. 与表达相关的sSNV突变特征
研究团队探究了基因长度、表达水平对衰老神经元转录及体细胞突变的影响。多重线性回归分析显示,与多数器官相反,随着年龄的增长,人脑神经元中长基因更可能维持或上调表达,而短基因(特别是高表达的管家基因)更易下调。该长度效应在神经元中比胶质细胞更显著,可能与神经元高表达拓扑异构酶保护长基因有关。
管家基因呈现明显长度依赖性:最短的基因下调最明显且体细胞突变率最高,而最长的基因表达稳定且突变率低;神经元特异性基因该相关性较弱。突变率方面,管家基因sSNV率随长度增加而降低,神经元特异性基因无显著关联。这提示两类基因DNA损伤与修复模式不同,其共同构成了大脑衰老的独特转录组特征。
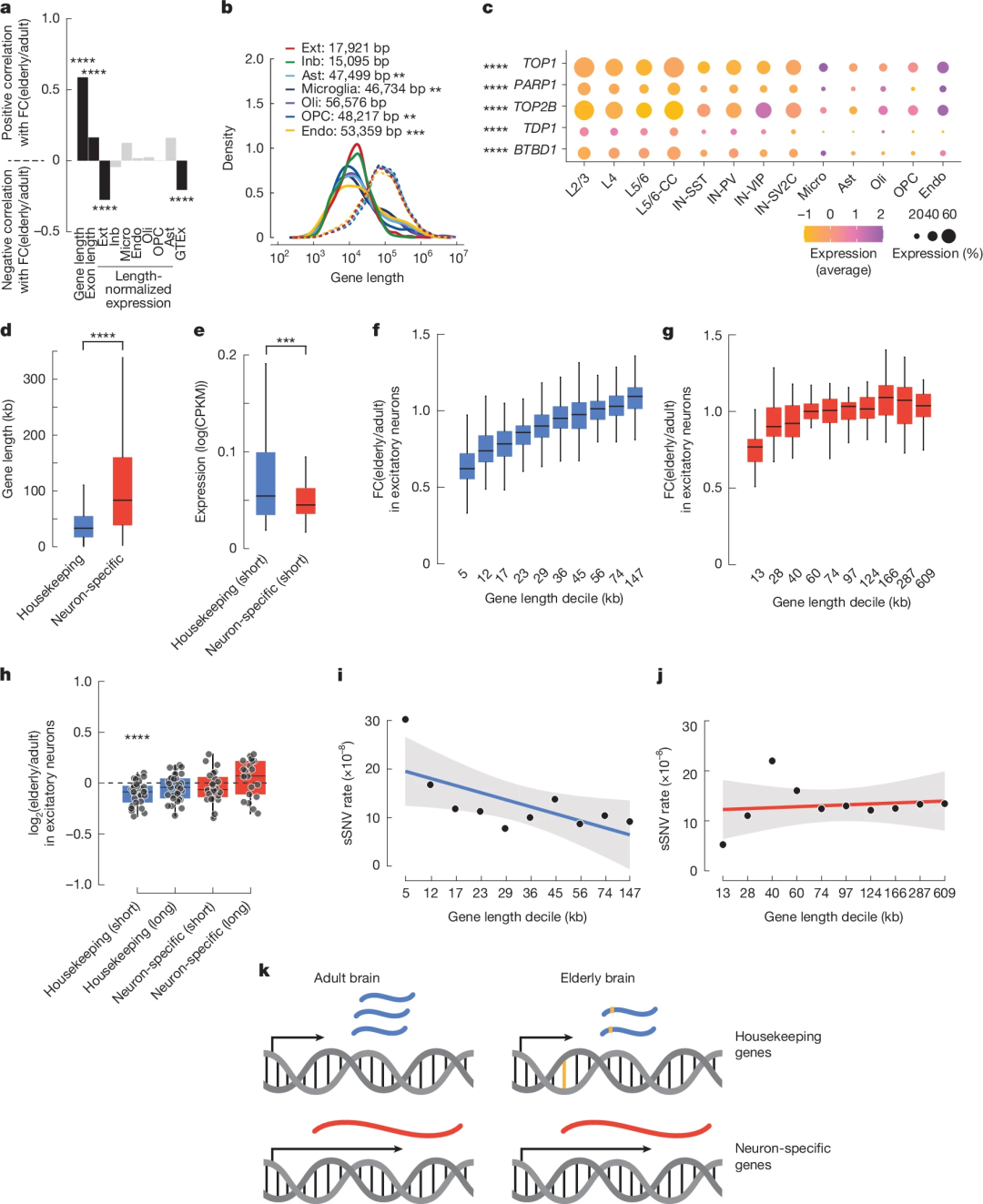
图5. 衰老过程中基因下调与基因大小、表达水平、基因类型和sSNV负荷有关
综上所述,该研究通过多维度单细胞技术,首次系统解析了人脑前额叶皮层在生命周期中的转录组与基因组动态变化,揭示了管家基因表达普遍下调、神经元维持基因稳定表达、体细胞突变与转录活动密切关联等关键现象。这些发现不仅为理解人脑发育和衰老提供了分子基础,也为脑衰老相关疾病的发生机制提供了重要线索。
参考文献:
Jeffries, A.M., Yu, T., Ziegenfuss, J.S. et al. Single-cell transcriptomic and genomic changes in the ageing human brain. Nature (2025). https://doi.org/10.1038/s41586-025-09435-8


