生物学检测与影像学综合评估1017例肺部结节良恶性的回顾性队列研究
时间:2025-09-18 12:12:37 热度:37.1℃ 作者:网络
摘 要
目的 通过联合生物学检测与影像学评估,在大型队列基础上构建临床预测模型,以提高肺结节良恶性鉴别的准确性。方法 回顾性分析浙江大学医学院附属第一医院 2020 年 1 月—2024 年 4 月接受胸部CT 和 7 种肺癌相关血清自身抗体(7-AABs)检测 32 627 例肺结节患者的临床资料。通过单因素和多因素logistic 回归分析筛选肺结节良恶性的独立风险因素,并构建列线图模型。通过受试者工作特征(receiver operating characteristic,ROC)曲线、校准曲线及决策曲线分析(decision curve analysis,DCA)评估模型性能。结果 共纳入1 017 例肺结节患者。训练集共 712 例,其中男 291 例、女 421 例,平均年龄(58±12)岁;验证集共 305 例,其中男 129 例、女 176 例,平均年龄(58±13)岁。单因素 ROC 曲线分析显示,CT 联合 7-AABs 检测的诊断效能[曲线下面积(area under the curve,AUC)=0.794],高于单独使用 CT(AUC=0.667)或 7-AABs(AUC=0.514)。多因素logistic 回归分析显示,影像学结节直径、结节性质及 CT 联合 7-AABs 检测为肺结节良恶性诊断的独立预测因子, 以此构建列线图预测模型。该模型在训练集和验证集的 AUC 值分别为 0.826 和 0.862。DCA 结果显示,该模型能够为临床决策提供较高的净收益。结论 联合 7-AABs 与 CT 能够显著提高肺结节良恶性鉴别的准确性。构建的预测模型为临床决策提供了有力支持,有助于肺结节的精准诊断与治疗。
正 文
肺癌作为当前全球范围内发病率与死亡率均居前列的恶性肿瘤,其早期诊断与有效治疗对于提高患者生存率至关重要[1]。随着影像学技术的飞速发展,尤其是胸部CT技术的广泛应用,肺结节检出率显著提升,但如何精准鉴别结节良恶性成为临床诊疗中的一大挑战[2-4]。
近年来,Science、Cell等国际权威学术期刊相继揭示了肿瘤生物学行为在肿瘤发生、发展过程中的核心作用,为肺结节的精准诊断开辟了全新的视角与途径[5-7]。肿瘤的生物学特征纷繁复杂,涵盖了持续增殖信号、细胞能量异常、抵抗细胞死亡、基因组不稳定性和突变、持续血管新生、组织浸润和转移、促进肿瘤炎症、无限复制能力、避免免疫摧毁、抗生长信号的不敏感性等多个方面[6]。这些特征不仅决定了肿瘤的活跃程度,也影响了其治疗反应和预后。特别值得关注的是,早期肿瘤细胞即可激发免疫反应,产生针对肿瘤相关抗原的特异性抗体[8]。除传统肿瘤标志物之外,7种与肺癌紧密相关的血清自身抗体(autoantibodies,AABs):肿瘤抑制蛋白p53(tumor protein 53,p53)、蛋白基因产物9.5(protein gene product 9.5,PGP9.5)、性别决定区Y框蛋白2(SRY-box containing gene 2,SOX2)、 G抗原7(G antigen 7,GAGE7)、ATP 依赖型RNA解旋酶(ATP-dependent RNA helicase,GBU4-5)、人黑色素瘤相关抗原A1(melanoma antigen A1,MAGEA1)以及癌症/睾丸相关抗原(cancer/testis-associated antigen,CAGE)的抗体,作为当前具有显著应用潜力的肺癌血清生物学标志物。这些抗体组合形成的七联自身抗体组(7-AABs),已被验证在肺癌早期即可被检测到[9-10],同时在诊断中展现出较高的灵敏度[11]。
在肺癌的早期筛查中,影像学检查尤其是CT从宏观层面发挥了关键作用。CT能够检测到直径仅1 mm的肿瘤(约含106个肿瘤细胞),并随着肿瘤直径增大至8 mm(约109个细胞)而清晰显现,进一步增长至20 mm时则可能伴随临床症状[12]。而微观层面上,血清中7-AABs 作为重要指标,能够反映肿瘤细胞的生物学行为,包括增殖、侵袭和转移状态等,为预测肺结节良恶性、手术时机及制定个性化治疗方案提供了宝贵信息[13-14]。2017 年的一项针对1 987 例不确定性肺结节风险评估研究[15]发现,不论结节大小,联合肺癌AABs检测后都能显著提高肺结节诊断的准确性。我们前期分别在包含百人和千人规模的队列中验证了胸部CT联合7-AABs在鉴别肺结节良恶性方面的准确性[16-17]。本研究旨在进一步扩展并深化这一领域的探索,通过回顾性分析浙江大学医学院附属第一医院4余年32 627 例接受胸部CT 体检与7-AABs检测的肺结节患者真实世界数据,旨在构建和优化一个更加精准、高效的肺结节良恶性鉴别模型。
1 资料与方法
1.1 临床资料和分组
回顾性分析2020 年1月—2024年4月在浙江大学医学院附属第一医院接受胸部CT和7-AABs检测的32 627例肺结节患者的临床资料,并筛选出其中接受手术并有明确病理学诊断的肺结节患者。纳入标准:(1)经胸部CT检查诊断为肺部结节;(2)接受血清7-AABs 检测;(3)接受手术切除并有明确病理学诊断结果。排除标准:(1)患有除肺癌外其他恶性肿瘤的患者;(2)既往接受过抗肿瘤治疗的患者;(3)经支气管镜活检或针吸活检病理诊断的患者;(4)多学科团队判断恶性病变>1个的患者,但并非所有病变均已切除,病理结果为良性;(5)7-AABs检测结果无效的患者;(6)临床病历资料不完整的患者。所有患者的CT图像由至少2名经验丰富的放射科医生进行解读,并做出最终诊断。按7∶3 比例将患者随机分为训练集和验证集。
1.2 7-AABs定量检测
采用杭州凯保罗生物科技有限公司提供的试剂盒(p53、PGP9.5、SOX2、GAGE7、GBU4-5、 MAGEA1、CAGE),通过间接酶联免疫吸附试验(ELISA)进行。检测程序:首先,向患者采集5 mL静脉血(使用促凝管),离心后分离上层血清作为待测样品。接着使用磷酸盐缓冲盐水(PBS)对血清样品进行适当稀释(具体比例因试剂盒而异),并将稀释后的样品加入抗原包被的微孔板中。微孔板在室温下振荡孵育,使血清中的AABs(一抗)与预孵育的靶抗原充分结合。之后,用洗涤缓冲液彻底清洗微孔板,以去除未结合的游离抗体。随后,向每孔加入稀释的辣根过氧化物酶(horseradish peroxidase,HRP)偶联的抗人IgG(二抗),并再次在室温下孵育,使二抗与已结合的一抗形成复合物。孵育完成后,使用缓冲液清洗微孔板,去除未结合的二抗。然后,加入显色底物,在室温避光条件下振荡孵育一段时间(具体时长根据试剂盒说明),HRP 催化底物产生颜色反应。反应终止后,立即使用分光光度计在450 nm波长处测定各孔的光密度值(OD值)。每种AAB的阈值分别设定为13.1 U/mL(p53)、11.1 U/mL(PGP9.5)、10.3 U/mL (SOX2)、14.4 U/mL(GAGE7)、7.0 U/mL(GBU4-5)、11.9 U/mL(MAGEA1)、7.2 U/mL(CAGE)。如果至少一个AAB高于阈值,则结果被视为阳性。
1.3 统计学分析
使用R 软件(4.2.2版本)和MSTATA软件(www.MSTATA.com)进行统计分析。正态分布的计量资料以均数±标准差(x±s)描述,两组比较采用独立样本t检验。分类变量使用χ2 检验(四格表χ2检验与R×C列联表χ2 检验)或Fisher确切概率法进行分析。训练集中,采用单因素和多因素logistic回归分析筛选独立风险因素并建立预测列线图(nomogram)。使用受试者工作特征(receiver operating characteristic,ROC)曲线评估列线图的性能。同时进行决策曲线分析(decision curve analysis,DCA),以确定预测的净收益阈值。双侧P≤0.05为差异有统计学意义。
1.4 伦理审查
本研究经浙江大学医学院附属第一医院 IIT 伦理审查委员会审查通过,批件编号:浙大一院伦审 2024 研第 1335 号-快。
2 结果
2.1 基线资料
在纳入分析的32 627 例患者中,共1 017 例患者符合筛选标准。训练集712例,验证集305 例。患者临床资料和基线特征见表1。
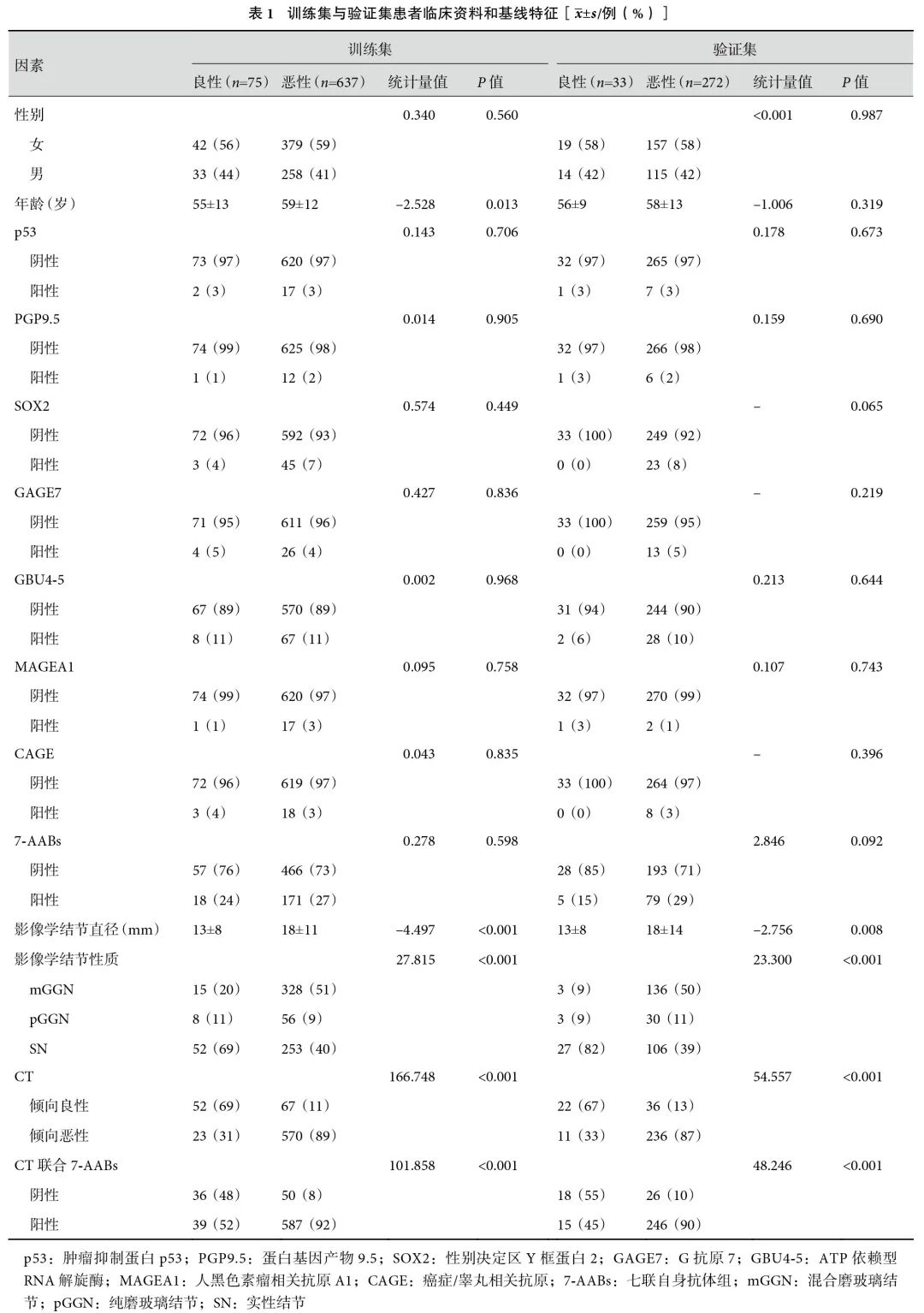
2.2 单因素诊断效能比较
在利用单因素评估肺结节良恶性诊断效能的过程中,通过绘制针对每种变量的ROC曲线来进行分析,单独采用7-AABs 作为诊断指标时,其效能显著不足, 曲线下面积(area under the curve, AUC)仅为0.514;而单独依赖CT影像结果的诊断效能虽有所提升,但仍不够理想,AUC为0.667。当CT结果与7-AABs检测相结合时,诊断效能在所有单因素ROC曲线中达到了最高水平,AUC值为0.794,表明这种联合检测策略显著增强了诊断的准确性;见图1a。此外,还发现其他变量如影像学结节性质也展现出了较好的诊断效能(AUC=0.652),与单独CT诊断相仿。尽管CT联合7-AABs的诊断效能有了显著提升,但未达高精度需求。需探索精准的综合模型,提高肺结节良恶性判断可靠性。
2.3 Logistic回归模型建立
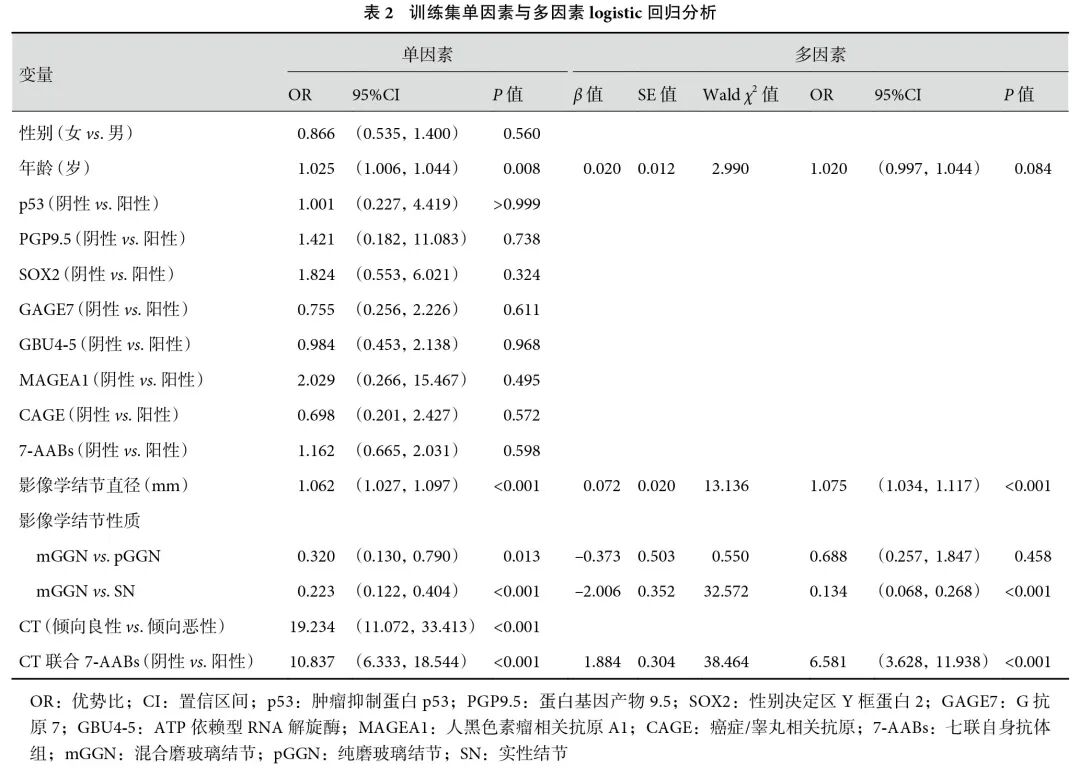
单因素logistic 回归分析结果显示,年龄、影像学结节直径和性质、CT 检查结果以及CT 联合7-AABs 检测差异均有统计学意义;见表2。考虑到CT 结果与CT 联合7-AABs 两个变量存在共线性,而CT 联合7-AABs 的单因素诊断效能比单独CT诊断效能更高,因此排除CT 结果因素,将其余4个独立的预测因子纳入多因素logistic 回归分析,结果发现年龄并非是独立预测因素。因此将影像学结节直径、影像学结节性质、CT 联合7-AABs 检测这3个重要的独立预测因子构建预测模型。为了便于临床使用与解读,将该回归模型转化为一个直观的列线图(图1b),以便清晰地展示各预测因子与预测结果之间的关系。
2.4 预测模型诊断效能验证与评估
经logistic回归构建的诊断模型,在统计验证过程中展现出优秀的诊断能效:在训练集中AUC值为0.826,在验证集中AUC值为0.862 (图1c)。表明该模型在肺结节良恶性预测中具备了高灵敏度和特异度。DCA结果显示,该模型在训练集和验证集中均展现出了优异的DCA曲线(图1d~e),显示在广泛的阈值范围内,采用该模型进行决策相比于极端的诊断结果,能够为临床决策提供更高的净收益。
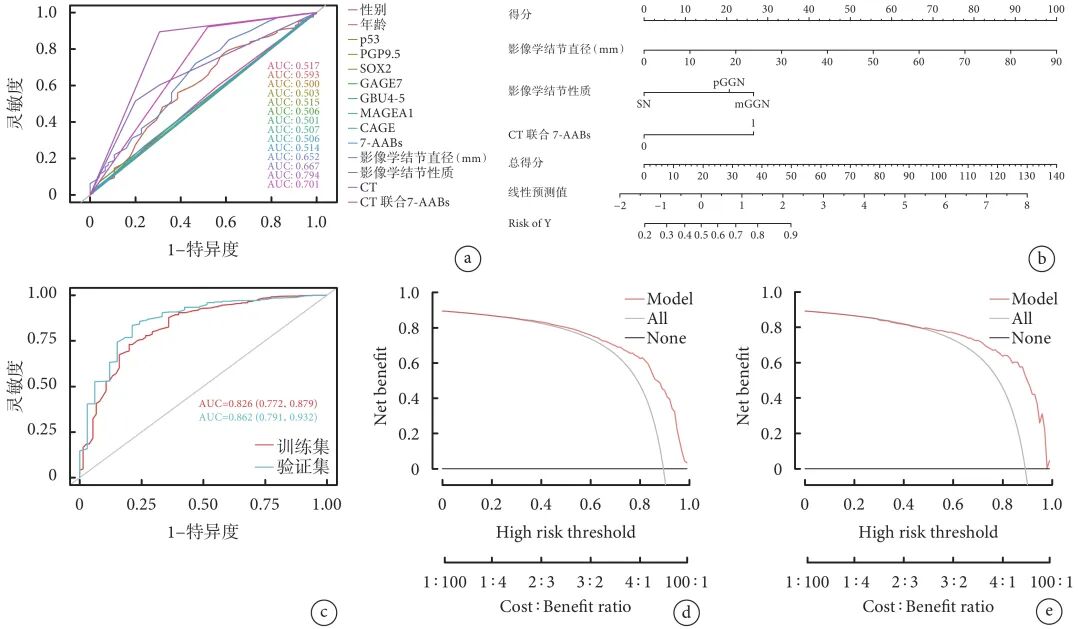
图 1 肺部结节良恶性预测模型的建立与性能分析
a:单因素ROC曲线;b:训练集logistic回归建立预测模型列线图;c:预测模型训练集与验证集ROC曲线;d:训练集列线图的决策曲线分析;e:验证集列线图的决策曲线分析;ROC:受试者工作特征;p53:肿瘤抑制蛋白p53;PGP9.5:蛋白基因产物9.5;SOX2:性别决定区Y框蛋白2;GAGE7:G抗原7;GBU4-5:ATP依赖型RNA解旋酶;MAGEA1:人黑色素瘤相关抗原A1;CAGE:癌症/睾丸相关抗原;7-AABs:七联自身抗体组;mGGN:混合磨玻璃结节;pGGN:纯磨玻璃结节;SN:实性结节
3 讨论
在当今医学领域,癌症的早期诊断被视为提高患者生存率和生活质量的关键。鉴于肺癌的高度生物学异质性,从生物学角度深入理解和定制筛查策略显得尤为重要。为了提高肺癌早筛的准确性和效率,我们将生物学特征检测与影像学评估联合起来,通过整合患者的血清AABs水平和影像学检查结果,对肺结节进行精准评估。研究结果显示,单独使用7-AABs 或单独以CT作为诊断指标时,诊断效能较低,而将CT结果与7-AABs检测相结合时,诊断效能显著提高,表明这种联合检测策略能够显著增强诊断的准确性。通过logistic回归分析构建的预测模型,在训练集和验证集中均表现出优异的诊断能效,显示出高灵敏度和特异度。DCA结果显示,该模型在训练集和验证集中均展现出优异的决策曲线,不仅验证了模型在理论上的优越性,更为其在实际临床场景中的广泛应用奠定了坚实的基础,为临床决策提供了有力支持,有助于实现肺癌的早发现、早诊断。
在深入探索肺癌生物学特性的过程中,一项针对157例非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的长期随访结果显示,尽管总体研究人群的5年生存率达到了62%,但在肺癌AABs检测为阳性的患者群体中,5年生存率却骤降至7.6%,反映了AABs作为预后不良重要标志物的潜力[18]。此外,术前检测肺癌AABs 不仅有助于精准制定诊疗方案,阳性结果提示需采取辅助治疗以提高生存率,而阴性结果则预示着较好的预后。有研究[19]进一步拓展,初步应用7-AABs 检测早期NSCLC患者,发现MAGEA1、PGP9.5、SOX2 和TP53 等AABs 在NSCLC患者血清中显著升高,并与患者总生存期负相关,联合筛查这4种AABs展现出71.8%的敏感度和89% 的特异度,显示出在早期诊断及预后预测中的巨大潜力。这一发现不仅强化了肺癌AABs在筛查中的应用价值,还进一步揭示了其在评估患者预后方面的重要作用,为NSCLC的精准医疗开辟了新途径。
一项由上海瑞金医院李鹤成教授与陶生策教授团队历时3年的研究[20]表明,7-AABs阳性不仅揭示了疾病状态,更是微小残留病灶存在的重要预警信号。历经3年不懈探索,该团队对肺癌患者AABs 在疗效与复发监测中的作用进行了全面而系统的研究,发现手术治疗后,患者体内这些特异性抗体水平呈现显著且持续的下降趋势,尤为关键的是,在肿瘤复发之前,这些抗体即已提前转阳。一项针对352例肺癌患者的长期随访研究[21]发现,表现出高恶性程度的结节不仅预示着更严峻的病情进展,还显著增加了淋巴结受累与远处转移的风险。研究[21]明确指出,肺癌AABs的高表达与淋巴结侵袭及远处转移之间的强烈正相关关系。
因此,通过深入研究血清AABs的特征及其在肺结节诊断中的应用,可以进一步推动肺癌早期筛查技术的发展,为患者带来更高的治疗成功率和更长的生存期。术前进行肺癌AABs 检测,能够帮助医生更精准地评估患者的疾病状态,从而制定个体化的诊疗方案。对于抗体检测阳性的患者,由于其较高的复发和转移风险,应考虑采取更为积极的治疗措施,如辅助治疗等,以尽可能地提高患者的生存率。而对于抗体检测阴性的患者,则可能预示着较好的预后,这为患者的治疗选择和心理调适提供了积极的指导。因此,结合生物学特征和影像学评估的综合策略,将是未来肺癌早期诊断和治疗的重要方向。
我们希望在深化肺结节良恶性预测领域取得更为显著的突破。为此,我们不仅将携手多中心合作,共同发起并推进大规模、高质量的数据验证项目,以确保我们的研究成果具有广泛的代表性和可靠性,还将积极探索并整合更多前沿的生物标志物与检测技术于我们的预测模型中,如血清癌胚抗原、循环肿瘤DNA、微小残留病灶监测、外泌体分析以及挥发性有机化合物气体检测等。这些指标各自蕴含着丰富的生物学信息,能够从不同维度反映肺结节的生物学特性与恶性潜能。通过综合运用这些先进的检测技术,我们有望捕捉到更多细微而关键的生物学变化,从而为肺结节的良恶性预测提供更加全面、精准的依据。同时,我们将继续采用先进的统计方法与机器学习算法,深入挖掘各指标之间的相互作用与关联,构建出既科学又实用的预测模型。我们坚信,随着技术的不断进步与数据的不断积累,一定能将肺结节良恶性预测的精准度推向一个新的高度,为肺癌的早期诊断与治疗赢得宝贵的时间窗口,从而提高患者的生存率与生活质量。这是一项充满挑战与机遇的征程,我们将以坚定的信念与不懈的努力,携手国内外同行,共同推动这一领域的持续进步与发展。
利益冲突:无。
作者贡献:张蕾、李子豪、李楠负责开展研究,分析并解释数据;李子豪撰写初稿并修订稿件;程钧、张锋、夏平会负责数据收集、整理及统计学分析;张蕾、李楠负责数据及结果校对;吕望、胡坚负责研究设计及课题指导;所有作者均同意论文发表。


