肠癌竟能“劫持”大脑情绪中枢?Nature子刊(28.5):我国学者首次发现,慢性压力通过这条神经通路“喂养”肿瘤!
时间:2025-09-11 12:13:46 热度:37.1℃ 作者:网络
在我们熟悉的认知里,癌症是一种局部疾病,是某个器官的细胞发生恶性增殖的结果。然而,近年来一个全新的研究领域——“癌症神经科学”正在悄然兴起。它试图回答一个更深层的问题:癌症是否不仅仅是一场局部的叛乱,而更像是一场有组织、有预谋的“全身战争”?
2025年8月,来自中山大学/南方医科大学的研究团队发表于《自然·癌症》(Nature Cancer)的一项重磅研究,首次揭示了一条从大脑情绪中枢直接通向肠癌细胞的“神经高速路”。这条路径不仅在正常情况下被癌细胞利用以促进自身生长,更在慢性压力下被“激活”,显著加速肿瘤进展。

DOI:10.1038/s43018-025-01033-x
大脑-肠癌轴:一条被“劫持”的神经专线
临床中已经能观察到一个现象:肿瘤患者中抑郁症和焦虑症的发病率显著高于常人,甚至自杀风险也更高。
压力、情绪与癌症之间,似乎存在某种看不见的桥梁。传统观点认为,这种关联可能通过激素(如皮质醇)、免疫抑制或自主神经系统实现。然而,大脑是否存在更直接的方式调控外周肿瘤?尤其是那些与情绪密切相关的脑区,是否也在暗中影响癌细胞的命运?
侧隔区(LS)正是这样一个脑区。它深藏于大脑皮层之下,是情绪调节的核心枢纽,参与奖励、焦虑、恐惧和抑郁等多种情绪过程。近年来,光遗传学研究显示,激活LS中特定的G啊ABA能神经元,甚至可以诱发焦虑样行为。这让人不禁怀疑:LS是否可能是情绪影响肿瘤进展的关键节点?
为了验证这一假设,研究团队构建了多种结直肠癌(CRC)小鼠模型,包括原位直肠肿瘤、坐骨神经肿瘤和患者来源移植瘤(PDX)模型。
他们首先证实,肿瘤中神经纤维的密度越高,小鼠存活率越低。那么,这些神经纤维从何而来?又是如何被招募到肿瘤中的?
通过使用伪狂犬病毒(PRV)进行逆向追踪,研究人员惊讶地发现:在直肠肿瘤中注射病毒后,病毒竟能沿着神经通路“逆行”传播,最终到达大脑的LS和下丘脑外侧区(LH)。而且,LS中被标记的神经元绝大多数是GABA能神经元——这是大脑中主要的抑制性神经元。
随后,使用疱疹病毒(HSV)进行顺向追踪,他们清晰地看到:从LS发出的信号,经过多突触传递,最终抵达肠道胆碱能神经元,而这些神经元的纤维正深入肿瘤微环境。
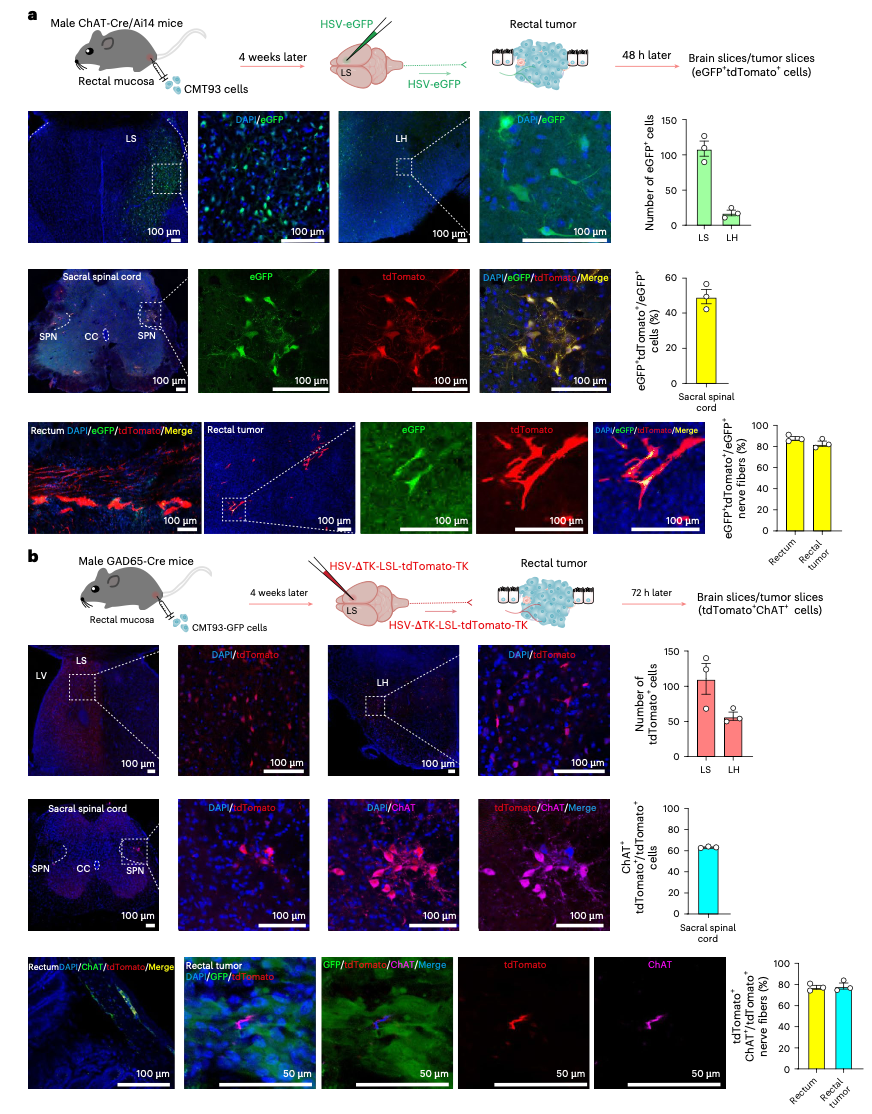
LS神经元多突触调控肿瘤支配胆碱能神经元
也就是说,大脑LS区的GABA能神经元,可以通过一条多突触通路,间接控制着肠道中通向肿瘤的神经纤维。这条通路,在正常情况下可能参与调节肠道蠕动和情绪,但现在,它被癌细胞“劫持”了。
激活则肿瘤长,抑制则肿瘤缩
随后,研究团队使用了化学遗传学和光遗传学这两大神经操控利器,对LS的GABA能神经元进行精准干预。
当他们通过药物或蓝光刺激激活这些神经元时,直肠肿瘤的生长速度显著加快;相反,如果用药物或黄光抑制这些神经元,肿瘤的生长则受到明显遏制。
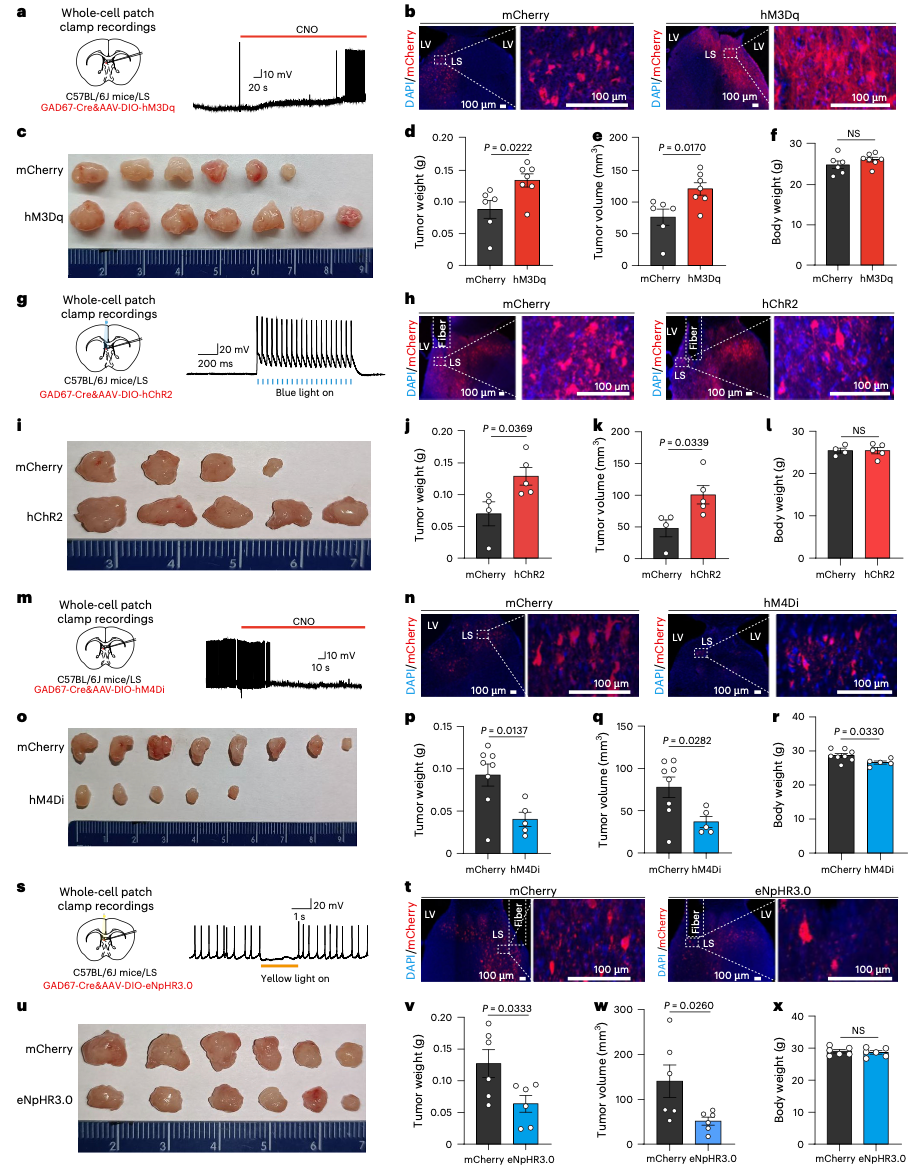
GABA能神经元的激活会促进结直肠癌生长,而抑制这些神经元则会抑制结直肠癌生长
进一步研究发现,LS的GABA能神经元是通过抑制LH的GABA能神经元来发挥作用的。而LH神经元则直接投射到骶髓副交感核(SPN),最终控制肠道胆碱能神经元。这就好比一个接力赛:LS发出“启动”信号,LH接收后传递至SPN,SPN再激活肠道神经,最终向肿瘤发出“生长”指令。
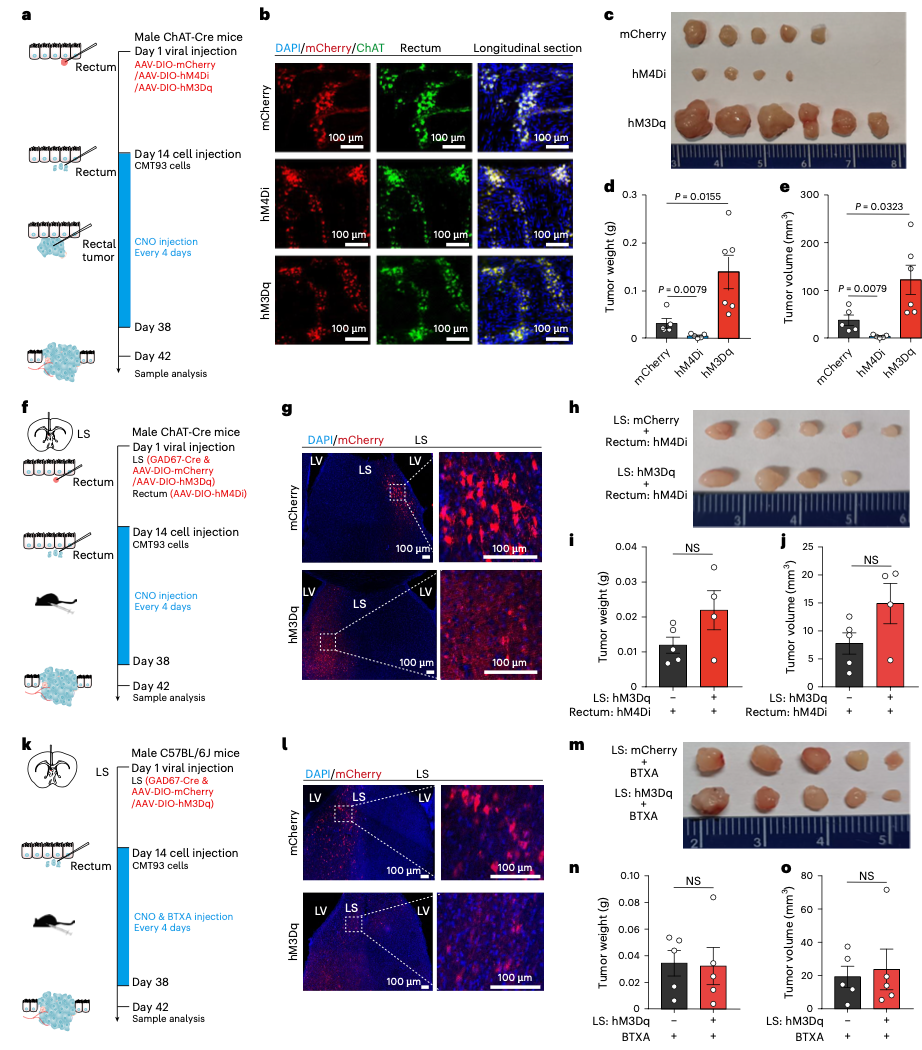
LS神经元诱导的肿瘤生长依赖于肠胆碱能神经元的激活
那么,神经信号最终是如何传递给癌细胞的呢?
原来,在肿瘤内部,胆碱能神经纤维不仅释放乙酰胆碱(Ach),还共同释放γ-氨基丁酸(GABA)——一种大脑中最重要的抑制性神经递质。GABA通过激活肿瘤细胞表面上一种含有ε亚基的GABA_A受体(由GABRE基因编码),进而上调一种名为TSPAN1的蛋白表达,最终推动肿瘤生长。
压力越大,肿瘤越长
如果说这条通路只是静静存在,那或许还不算可怕。真正令人警觉的是:慢性压力会显著激活这条“大脑-肠癌轴”。
研究人员对小鼠实施了为期两周的慢性束缚应激(CRS),模拟人类长期处于高压状态下的情况。结果发现:
-
小鼠血清皮质酮(压力激素)升高,焦虑行为增加;
-
LS中GABA能神经元被强烈激活;
-
结肠和肿瘤中的GABA水平上升,而ACh水平下降。
而如果在这个时候抑制LS神经元、阻断GABA合成,或是敲低肿瘤细胞上的GABRE受体,都可以有效缓解压力带来的促癌效果。
这也就意味着,压力通过激活LS神经元,重塑了肿瘤微环境中的神经递质平衡,使得GABA成为主导信号,从而加速癌症进展。
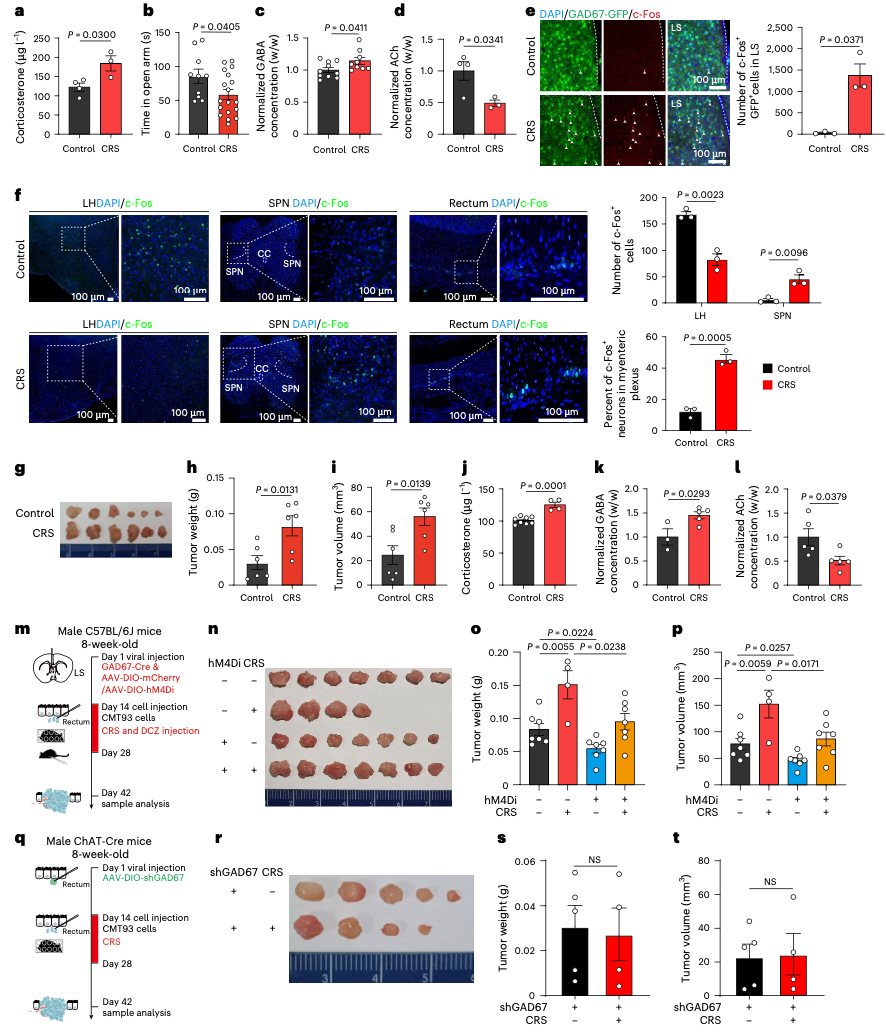
慢性应激通过激活隔 - 肠多突触环路,影响肠神经递质(GABA、乙酰胆碱)水平,进而促进结直肠癌生长
最后,研究团队回顾性分析了103名健康人和103名肠癌患者的脑部PET-CT影像,重点关注了人脑中与小鼠LS对应的“隔区”的代谢活性。结果发现:肠癌患者隔区的葡萄糖代谢活性显著高于健康人。并且,在51名接受了手术的肠癌患者中,隔区代谢活性与肿瘤体积呈明显正相关——即隔区越活跃,肿瘤越大。
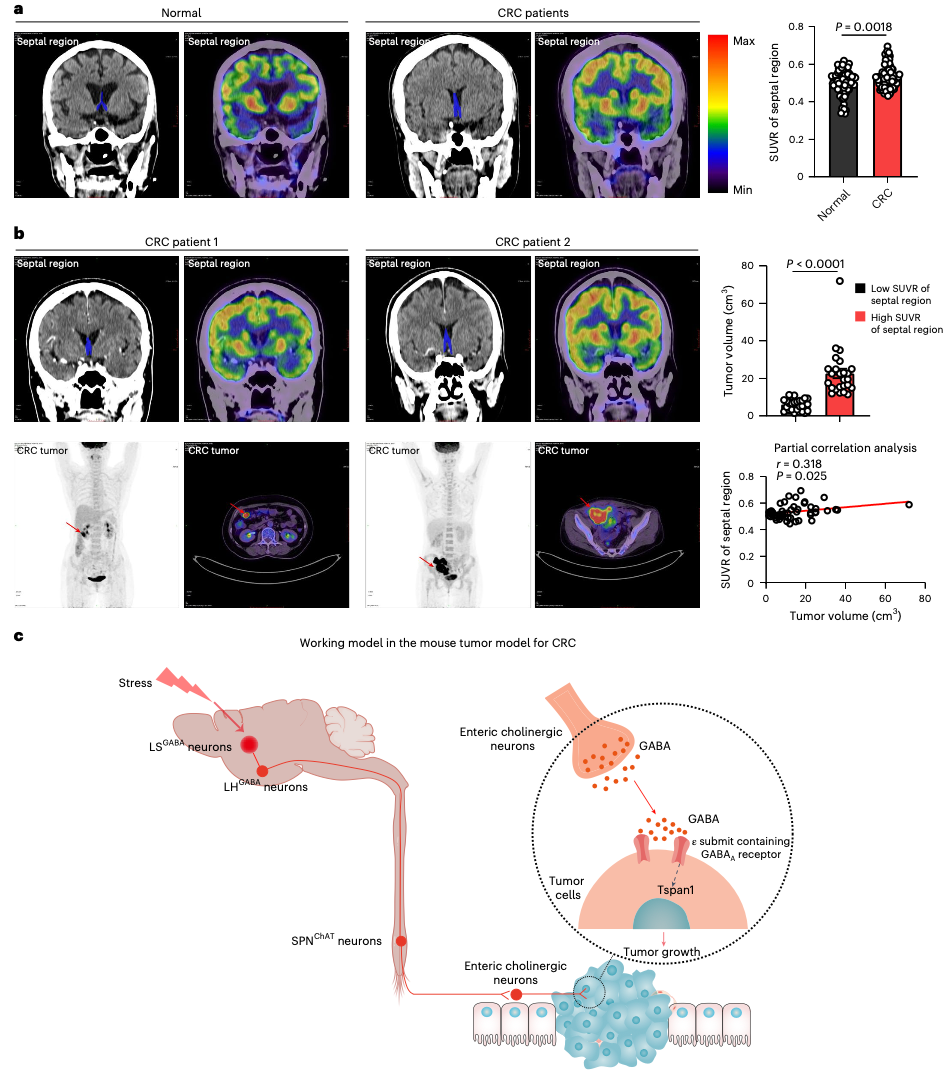
人类隔区代谢活性与CRC进展相关
总的来说,这项研究不仅揭示了一条全新的“大脑-肠-肿瘤”轴,也从另一个角度解释了为何保持情绪稳定、乐观积极的心态,在癌症治疗中如此重要。
结语
大脑中负责情绪调节的区域,竟通过一条漫长的神经通路,与远在肠道的癌细胞建立了直接“通讯”。在慢性压力的助推下,这条通路被激活,成为癌细胞的“营养通道”,释放GABA作为生长信号,不断滋养肿瘤。
这也提醒我们,癌症从来不是局部疾病,而是一种全身性疾病。未来的癌症治疗,或许不仅要瞄准癌细胞本身,还要关注调控癌细胞的神经系统和情绪与心理状态。
[1]Li Y, Yu H, Li ZM, Yin KW, Jin SY, Chen CC, Tan MS, Zhang CJ, Liu XH, Li WP, Yang JM, Zhou AJ, Zhang X, Ni ED, Wang ML, Mo H, Qin C, Hu J, Li SJ, Gao TM, Li JM. Colorectal cancer cells hijack a brain-gut polysynaptic circuit from the lateral septum to enteric neurons to sustain tumor growth. Nat Cancer. 2025 Aug 21. doi: 10.1038/s43018-025-01033-x. Epub ahead of print. PMID: 40841473.


