北京理工大学彭绍军团队JACS:开发出基于磺胺嘧啶的新型两性离子胶束,用于脑部的高效药物递送与精准治疗
时间:2025-09-11 12:13:48 热度:37.1℃ 作者:网络
背景:脑胶质瘤治疗难题
脑胶质瘤是最常见的中枢神经系统恶性肿瘤,具有高度侵袭性、血管化和异质性的特点,治疗难度大。传统的化疗药物由于难以突破人体内的重重屏障,尤其是一道天然的“防火墙”——血脑屏障(Blood-Brain Barrier, BBB)的存在,使得绝大多数药物难以进入肿瘤组织,在脑胶质瘤治疗中往往折戟沉沙,即便药物侥幸进入,还要面对肿瘤组织高压、细胞膜屏障、溶酶体降解等多重阻碍,导致治疗效果也大打折扣。
近日,北京理工大学彭绍军教授团队在《美国化学会志》(JACS) 上发表了一项突破性研究,他们巧妙利用临床药物磺胺嘧啶的特性,合成了全新的两性离子单体以及两嵌段聚合物胶束(PCL–PSDMA),在不修饰外加刺激响应基团或靶向基团的前提下,以极简的分子结构,成功突破了从血液循环到肿瘤细胞内的五重生物屏障,实现了对脑胶质瘤的高效药物递送与精准治疗。
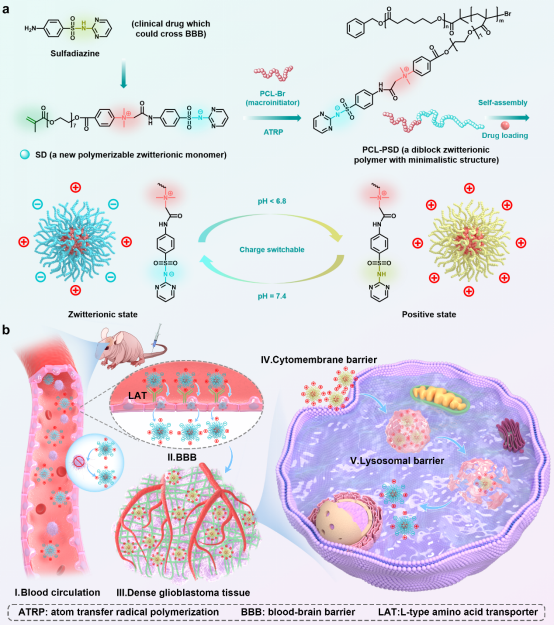
PCL-PSDMA胶束的合成路线及其克服五大生物屏障用于增强抗胶质母细胞瘤药物递送的示意图
01 困境:卓越的治疗策略,输在“最后一公里”
虽然纳米药物在肿瘤治疗中已被研究数十年,但临床转化成功率仍然很低。究其根本,一个高效的纳米药物必须像一名“特种兵”,在体内成功穿越多重关卡,才能将“弹药”(药物)精准送达“敌人”(肿瘤细胞)腹地。对脑胶质瘤而言最典型的生理屏障有:
①血液循环屏障:易被网状内皮系统和免疫系统识别和清除。
②血脑屏障(BBB):阻止绝大多数物质进入大脑。
③肿瘤组织高压屏障:高密度的肿瘤组织阻碍药物渗透。
④肿瘤细胞膜屏障:控制物质进出,难以被细胞内化。
④溶酶体屏障:细胞自身的“消化车间”,内含大量消化酶,处理各种细胞废弃物。
传统的纳米药物为了突破这些屏障往往是去叠加各种功能模块((如隐形层、靶头、环境响应单元),这使得设计异常复杂,不仅合成难度大,批次的可重复性和稳定性也难以得到保证,导致临床转化难。如何在结构简单与功能强大之间找到平衡,成为纳米药物领域长期面临的两难选择。
02 破局:源于临床的灵感,化繁为简的设计
研究团队独辟蹊径,从临床药物中寻找灵感。磺胺嘧啶是临床上一种常用于治疗流行性脑膜炎的抗菌药,其已知特性就是能够高效穿透血脑屏障,且其酸碱电离常数在6.5。基于此,团队设计并合了一种全新的两性离子单体SDMA,并以聚己内酯(PCL)为疏水段,通过原子转移自由基聚合(ATRP)制备了PCL–PSDMA双嵌段聚合物。它结构简单,不含任何额外的靶向配体或复杂的刺激响应基团。
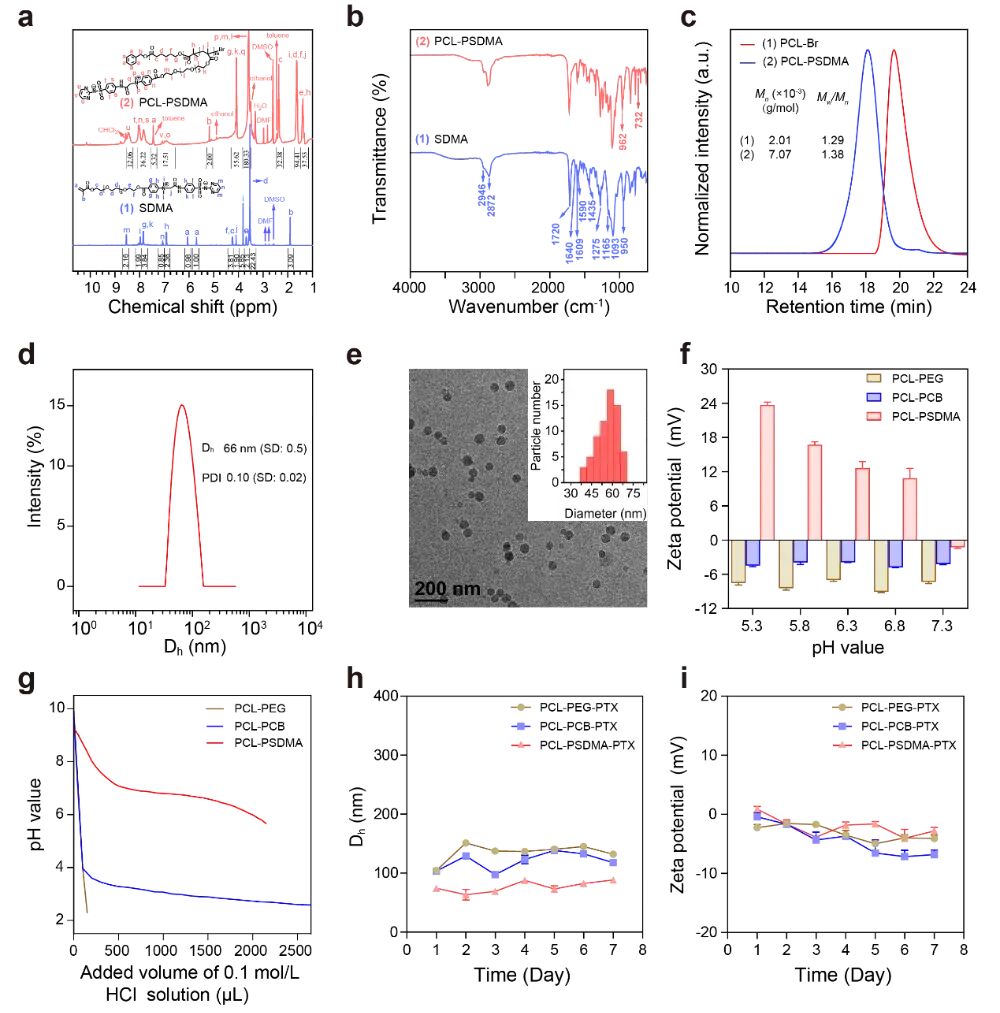
图1:PCL-PSDMA胶束的设计、合成与表征:(a) 智能型PCL-PSDMA胶束的合成路线及作用示意图:可依次克服五重生物屏障,实现高效的抗胶质瘤药物递送。(b-c) 核磁共振(NMR)和红外光谱(FTIR)证明SDMA单体和PCL-PSDMA聚合物成功合成。(d-e) 动态光散射(DLS)和冷冻电镜(cryo-TEM)显示胶束粒径均匀(~88 nm),形貌规整。(f-g) 电荷转换特性:zeta电位和酸碱滴定曲线表明,PCL-PSDMA胶束在生理中性环境(pH 7.4)下呈电中性(隐身),在微酸性肿瘤环境(pH ~6.8)中转变为带正电,具备电荷转换能力。
03 闯关:智能胶束的“五重屏障突破”之旅
从长效隐身的血液循环,到借助LAT1“特快专递”穿越血脑屏障,再到在肿瘤微酸环境中“变身”正电以深部渗透和高效率胞,最后成功逃离溶酶体,PCL-PSDMA胶束完成了一场精准高效的“五关通关”之旅,展现了其智能响应的强大功能。
第一关:长效循环,避免清除

图2:克服血液循环屏障的能力
研究人员将荧光染料DIR载入胶束,多次注射入小鼠体内模拟临床给药。结果表明:
(c-e) PCL-PSDMA胶束表现出与经典两性离子材料PCL-PCB相似的长循环特性,且优于传统的PEG化胶束(PCL-PEG)。
(f) 在第三次注射后24小时,PCL-PSDMA的血中滞留率仍高达27.7%,而PCL-PEG组仅为6.67%。
(g-h) 更重要的是,PCL-PSDMA不会像PEG那样引发加速血液清除(ABC)效应,即不会因多次注射而产生抗体(IgM/IgG),导致药效迅速下降。这对于需要长期重复给药的临床治疗至关重要。
第二关:穿越“防火墙”,直抵大脑
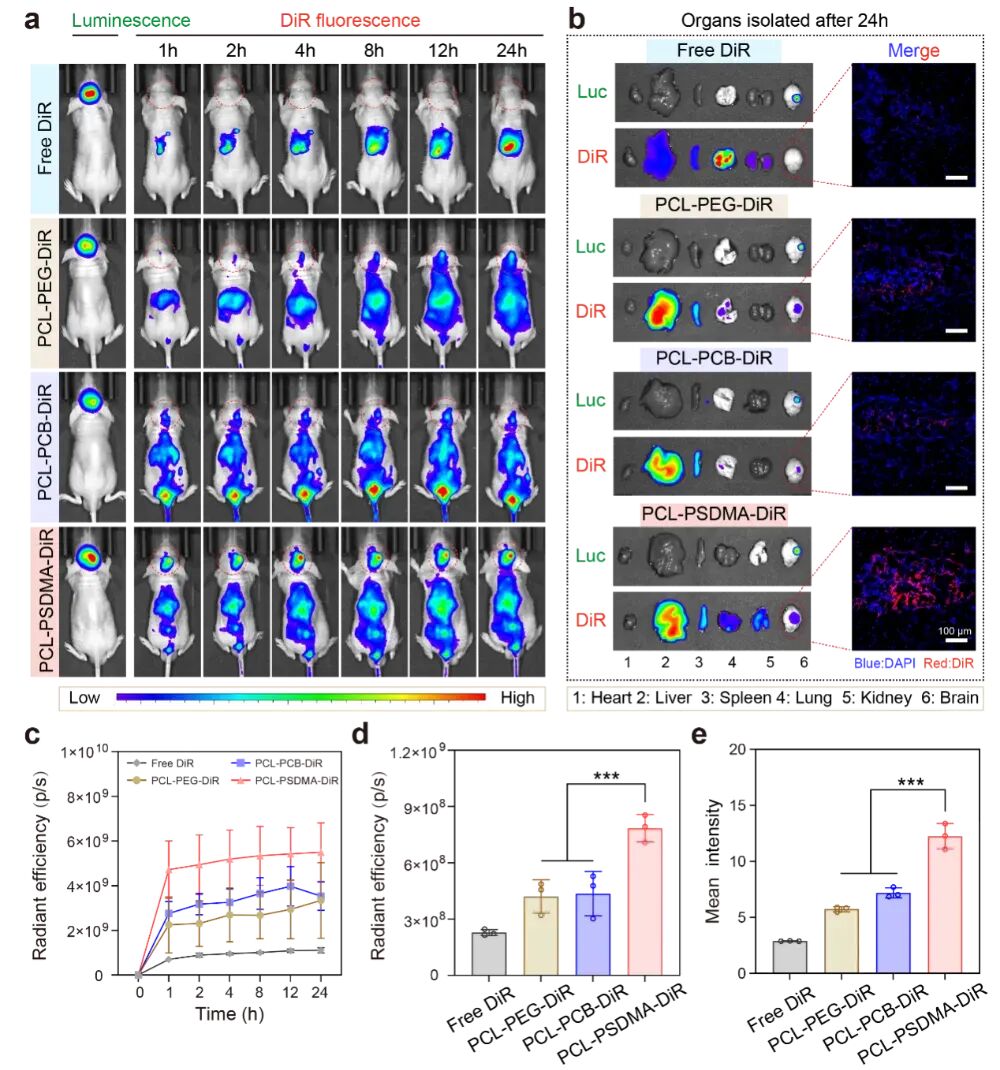
图3:体内脑靶向的能力
(a-c) 活体成像显示,注射PCL-PSDMA-DIR的小鼠,其大脑肿瘤区域的荧光信号最强且持续时间最长。
(b) 24小时后取各器官进行离体成像,发现PCL-PSDMA组在脑部的富集量最高。
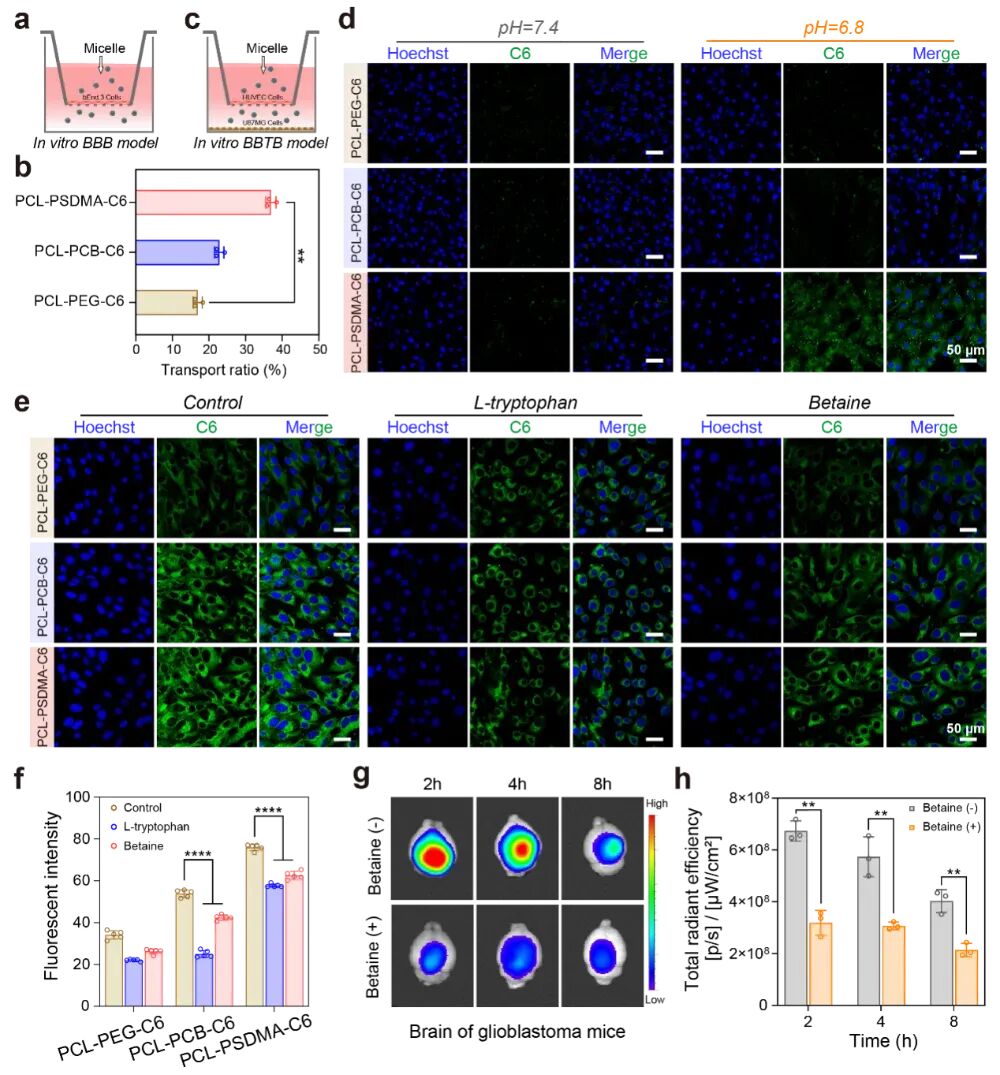
图4:克服血脑屏障/血瘤屏障(BBB/BTB)的能力与机制
(e-h) 机制研究表明,这一能力源于磺胺嘧啶可与脑血管内皮细胞上高表达的L型氨基酸转运体1(LAT1)结合。当使用LAT1的抑制剂(如甜菜碱)预处理后,PCL-PSDMA进入大脑的量显著降低。这表明PCL-PSDMA“继承”了磺胺嘧啶的“通行证”功能,通过LAT1介导的转运途径主动进入大脑。
第三关:深部渗透,攻克高压

图5:克服肿瘤组织高压(IFP)屏障的能力
研究人员在体外构建了三维(3D)肿瘤球体模型来模拟致密的肿瘤组织。
(a-b) 在中性环境(pH 7.4)下,所有胶束的渗透能力都很有限。
(c-d) 在微酸环境(pH 6.8)下,PCL-PSDMA胶束凭借其表面转变为正电荷的特性,与带负电的肿瘤细胞产生强静电相互作用,实现了深度穿透,其荧光强度是中性条件下的2.5倍。而PCL-PEG和PCL-PCB胶束则无此变化。
第四关 & 第五关:高效进入细胞并成功逃逸
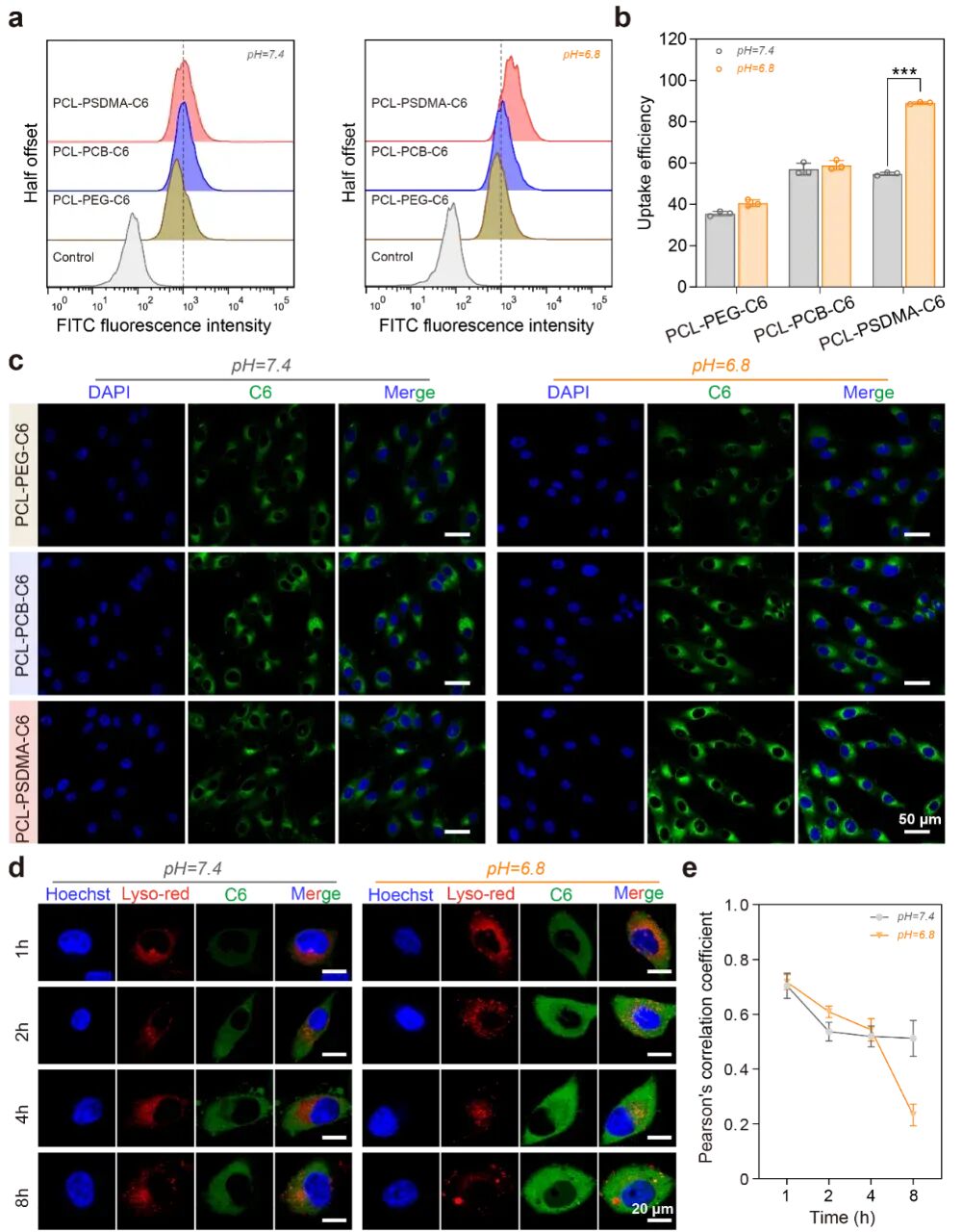
图6:克服细胞膜屏障和溶酶体屏障的能力
(a-c) 流式细胞术和共聚焦显微镜显示,在pH 6.8下,带正电的PCL-PSDMA被U87MG肿瘤细胞摄取的效率显著提高。
(d-e) 进入细胞后,PCL-PSDMA还能在溶酶体的酸性环境下进一步质子化,带更强的正电,通过破坏溶酶体膜实现高效逃逸(Pearson相关系数随时间下降),将药物成功释放到细胞质中,避免被降解。
04捷报:显著抑制肿瘤生长,延长生存期
装载了紫杉醇的PCL-PSDMA胶束能最高效地将药物递送至大脑肿瘤部位,从而实现显著抑制肿瘤生长的效果,患瘤小鼠生存期显著延长。
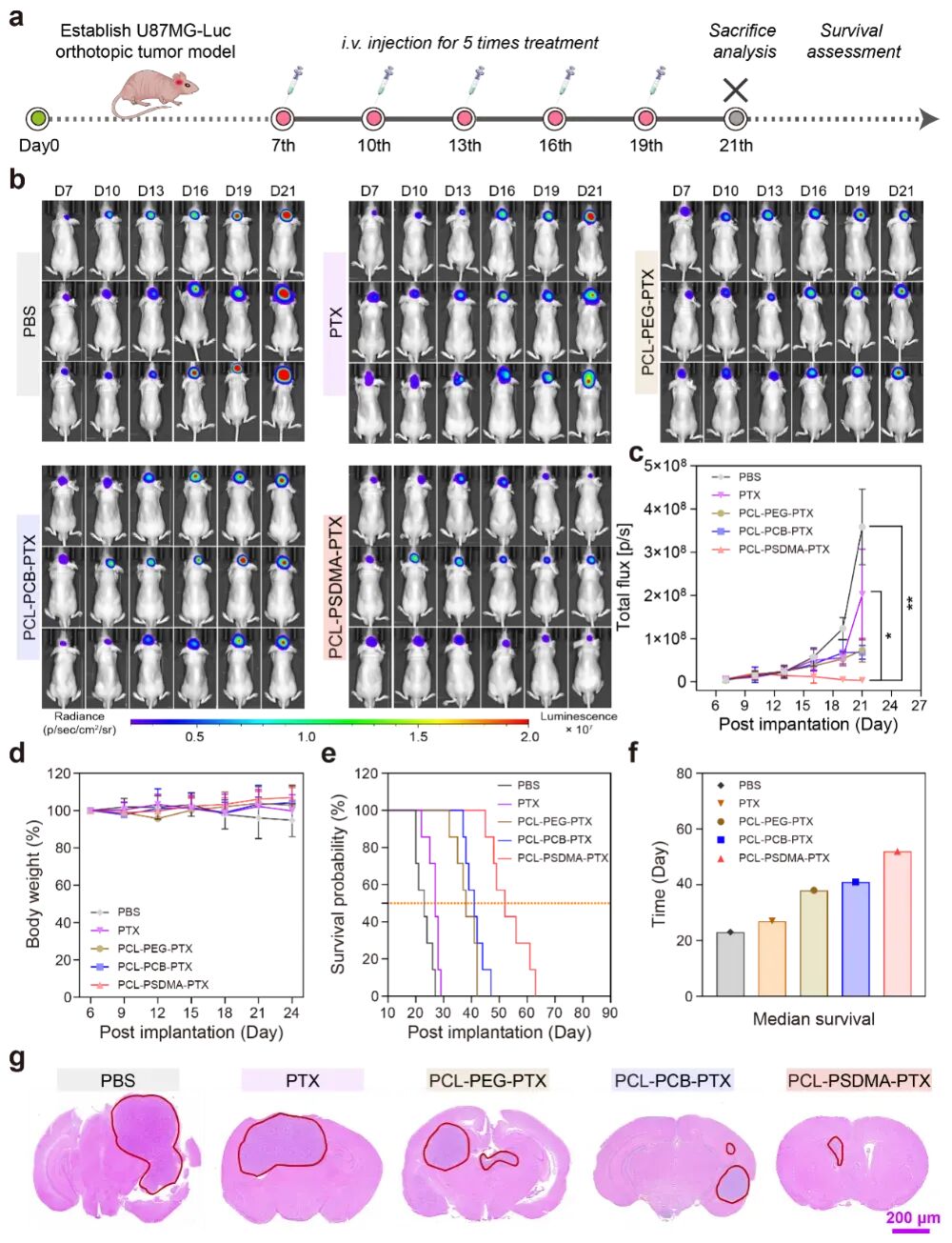
图7:优异的抗胶质瘤效果
(b-c) 活体生物发光成像显示,PCL–PSDMA-PTX治疗组的肿瘤生长被显著抑制,荧光信号未见明显增强。
(e-f) 生存分析显示,PCL–PSDMA-PTX治疗组的中位生存期延长至52天,显著优于其他对照组。
(g) 肿瘤组织切片(H&E染色)显示,该治疗组的肿瘤区域面积最小。
05 保障:高生物安全性,凸显临床潜力
全面的安全性评估表明,该两性离子磺胺嘧啶胶束不会对主要器官造成损伤,血液相容性良好,各项生化指标均正常,证明其良好的生物安全性。
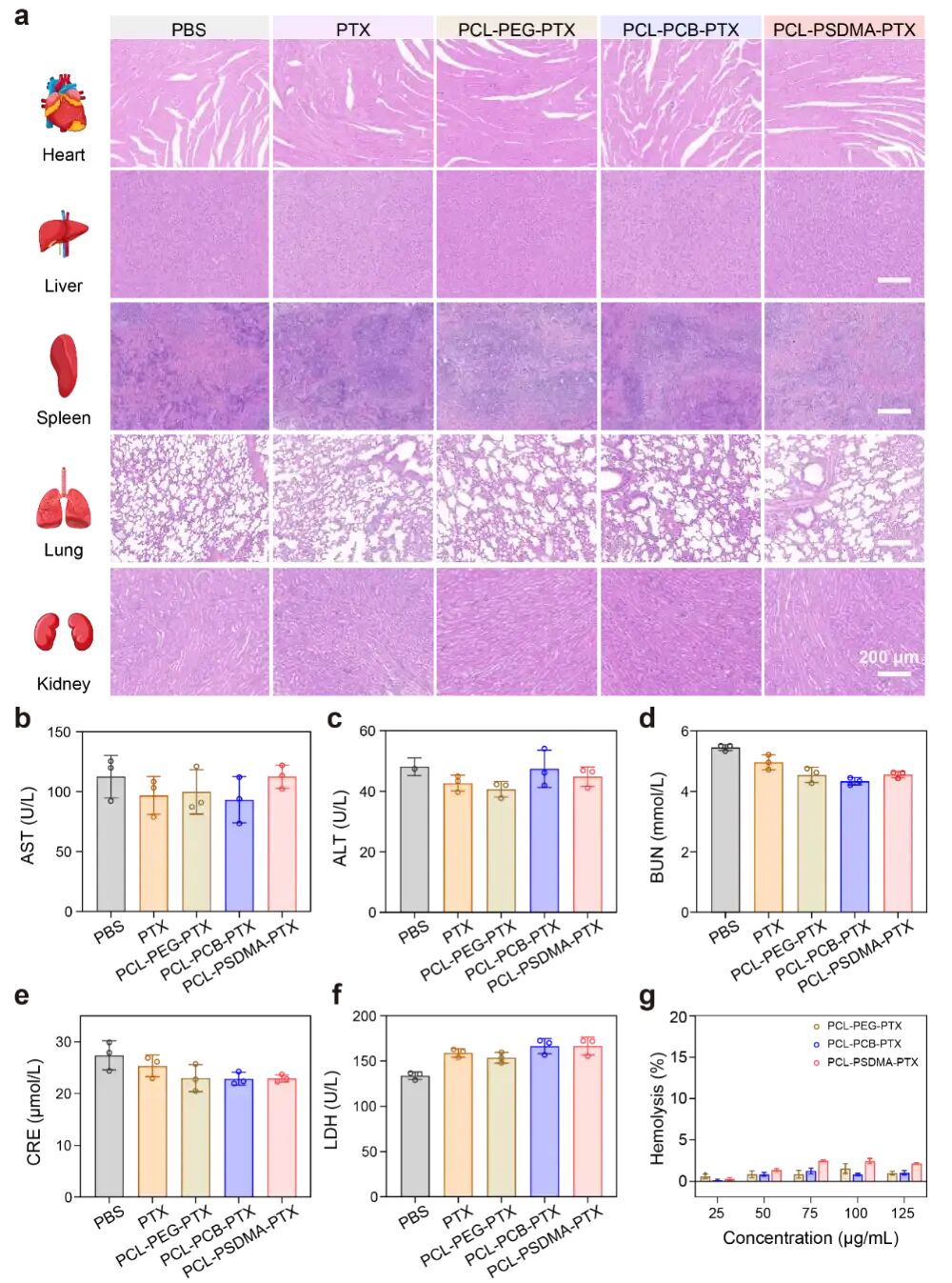
图8:全面的生物安全性评估
(a) 主要器官(心、肝、脾、肺、肾)的H&E染色切片显示,各治疗组均未发现明显组织损伤。
(b-f) 血液生化指标(AST、ALT、BUN、CRE、LDH)均在正常范围内,表明无肝肾功能损伤。
(g) 溶血实验证明,即使在较高浓度下,胶束也不引起红细胞破裂,血液相容性良好。
本研究不仅首次将磺胺嘧啶引入两性离子聚合物体系,更以其 “极简结构”实现“极致功能” 的设计理念,为攻克脑胶质瘤等脑部疾病的药物递送难题提供了全新的解决方案。
彭绍军教授表示:“我们希望这种‘以简驭繁’的设计思路,能推动更多高效、可控、易转化的纳米药物走向临床。”
原文链接:
https://pubs.acs.org/doi/10.1021/jacs.5c10422


