【协和医学杂志】中国和全球早发性肺癌的疾病负担及相关风险因素分析
时间:2025-09-12 12:10:47 热度:37.1℃ 作者:网络
肺癌是全球和中国最常见的癌症类型,也是癌症死亡的主要原因[1-2]。其多见于50岁以上人群,给家庭和社会造成了严重的疾病负担。
早发性肺癌是指诊断时患者年龄在15~49岁之间的肺癌,虽然仅占全部肺癌病例的5%左右[2],但其与老年人群肺癌具有不同的流行病学、生物学和临床特征[3-6]。
此外,虽然吸烟仍是肺癌的主要风险因素,但其他环境风险致癌物、空气污染及遗传因素在早发性肺癌发生中扮演着越来越重要的角色[4],因此早发性肺癌可能与现行的肺癌预防、诊断和治疗存在不同之处。此外,50岁以下人群还面临着职业发展、家庭责任和社会价值实现等挑战,早发性肺癌患者在治疗和康复期间可能面临职业发展停滞、经济压力增加及社交关系与家庭责任变化等风险,进而造成其生活质量严重下降[7-8]。因此,充分了解早发性肺癌的疾病负担及影响因素,对肺癌的三级预防具有重要指导价值。
本研究旨在通过全球权威数据库GLOBOCAN和全球疾病负担(GBD)数据库,评估中国和全球早发性肺癌疾病负担和相关风险因素,重点分析并比较中国和全球早发性肺癌发病率和死亡率模式及在地域、性别和人类发展水平方面的差异,明确中国早发性肺癌疾病负担的程度及主要风险因素,以期为相关部门制订针对早发性肺癌的干预策略提供科学依据,改善肺癌防控资源配置。
1 资料与方法
1.1 研究对象
由于15岁以下人群发生肺癌的病例较为罕见,故本研究将诊断肺癌时患者年龄为15~49岁判定为早发性肺癌,这一年龄范围的上限人群不在肺癌筛查的推荐年龄范围[9-10],该定义与既往研究[11]保持一致。肺癌病例均按照国际疾病分类第10版(ICD-10)的编码标准进行分类,其中肺癌编码为C33和C34。其中中国涵盖31个省、自治区、直辖市和香港、澳门特别行政区。
本研究基于公开可获得的人群水平上的匿名数据,无需进行伦理委员会审查或患者知情同意。
1.2 数据来源
早发性肺癌的发病、死亡数据来源于国际癌症研究署(International Agency for Research on Cancer)发布的GLOBOCAN 2022数据集(https://gco.iarc.who.int/today/en)。全球早发性肺癌的风险因素数据来自健康指标与评估研究所(Institute for Health Metrics and Evaluation)发布的GBD 2021数据集(https://vizhub.healthdata.org/gbd-results/)。人类发展指数(HDI)数据来自联合国开发计划署(UNDP)发布的《2023/2024人类发展报告》(HUMAN DEVELOPMENT REPORT 2023/2024)。HDI为该报告的核心指标,用于衡量各国在社会经济发展方面的综合表现。
1.3 统计学处理
采用R软件进行统计学分析,数据可视化采用“ggplot2”包[12]完成。本研究纳入了全球185个国家或地区的早发性肺癌病例,并按照联合国划分的21个区域进行统计报告。在全球、各区域内新发病例数居前2位国家的水平上报告了早发性肺癌的新发病例数、死亡病例数、年龄标化发病率(ASIR)和年龄标化死亡率(ASMR)。年龄标准化率的计算采用了Segi提出的世界标准人口(Doll等[13]修订后版本),以确保不同数据来源之间的一致性和可比性。
为系统评估早发性肺癌发病和死亡负担的区域分布特征及人群差异,本研究比较了各年龄组中不同区域早发性肺癌的发病和死亡情况。此外,进一步探讨了早发性肺癌发病和死亡负担与HDI水平之间的健康不平等关系,并通过散点图结合局部加权散点平滑回归(locally estimated scatterplot smoothing),对国家水平上的标准化率与HDI之间的关系进行可视化;对归因于HDI的绝对健康不平等和相对健康不平等,则通过计算相关衡量健康不平等的指标予以评估,其中与HDI相关的绝对和相对健康不平等衡量指标包括:反映绝对不平等的绝对集中指数(ACI)和不平等斜率指数(SII),以及反映相对不平等的相对集中指数(RCI)和相对不平等指数(RII),上述指标均通过“heal-thequal”包[14]计算。早发性肺癌疾病负担的主要风险因素评估,则基于GBD 2021数据集进行计算,各风险因素所致的早发性肺癌伤残调整生命年(DALYs)损失贡献率计算方法见下述公式:
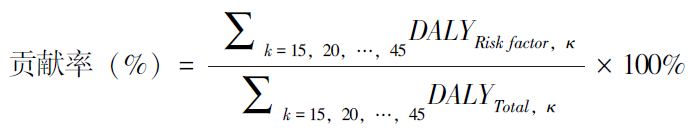
其中,DALYRisk factor,κ表示各风险因素在特定年龄段(如15~19岁、20~24岁、25~29岁等)所致的DALYs损失之和;DALYTotal,κ表示该年龄段早发性肺癌的总DALYs。
2 结果
2.1 2022年全球和中国早发性肺癌疾病负担
2022年,全球早发性肺癌新增病例137705例,死亡病例72646例,其ASIR和ASMR分别为3.43/10万人和1.82/10万人。在全球层面,男性的早发性肺癌发病和死亡负担高于女性。男性早发性肺癌新增病例74950例,占新发病例总数的54.43%;死亡病例46235例,占死亡病例总数的63.64%,其ASIR和ASMR分别为3.72/10万人和2.31/10万人。女性早发性肺癌新增病例62755例,死亡病例26411例,其ASIR和ASMR分别为3.14/10万人和1.33/10万人(表1)。
表1 2022年早发性肺癌在全球、21个区域、部分国家及不同HDI水平下的发病和死亡负担分布
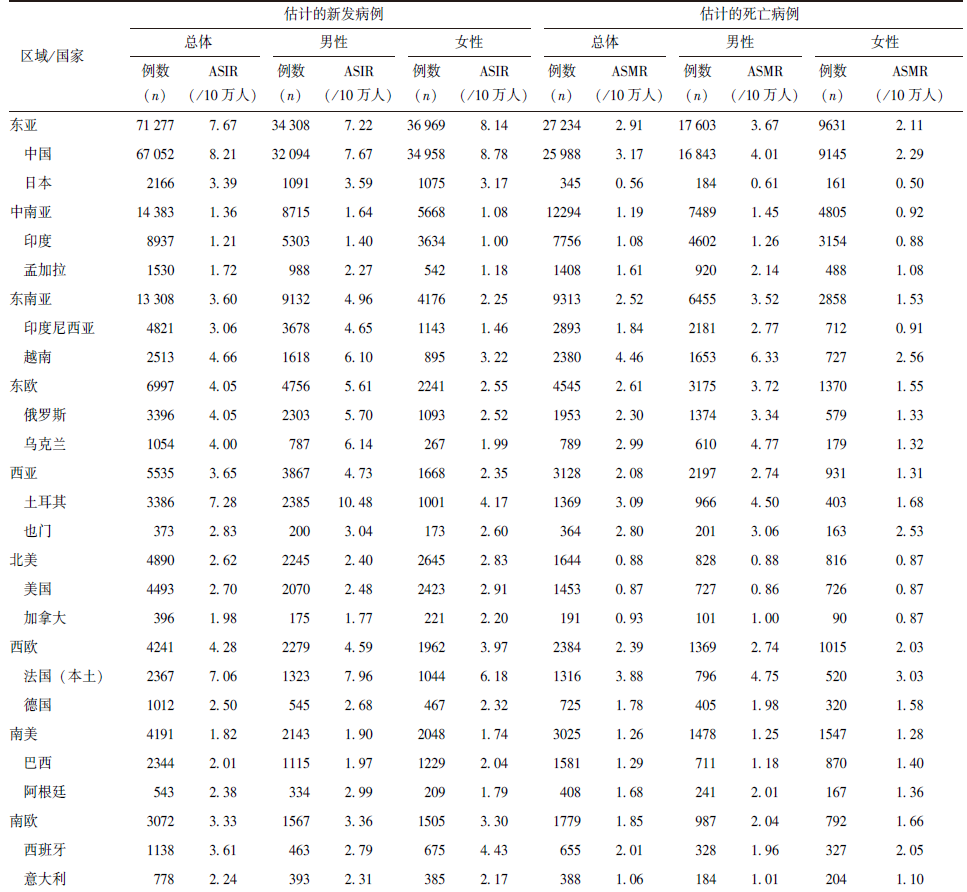
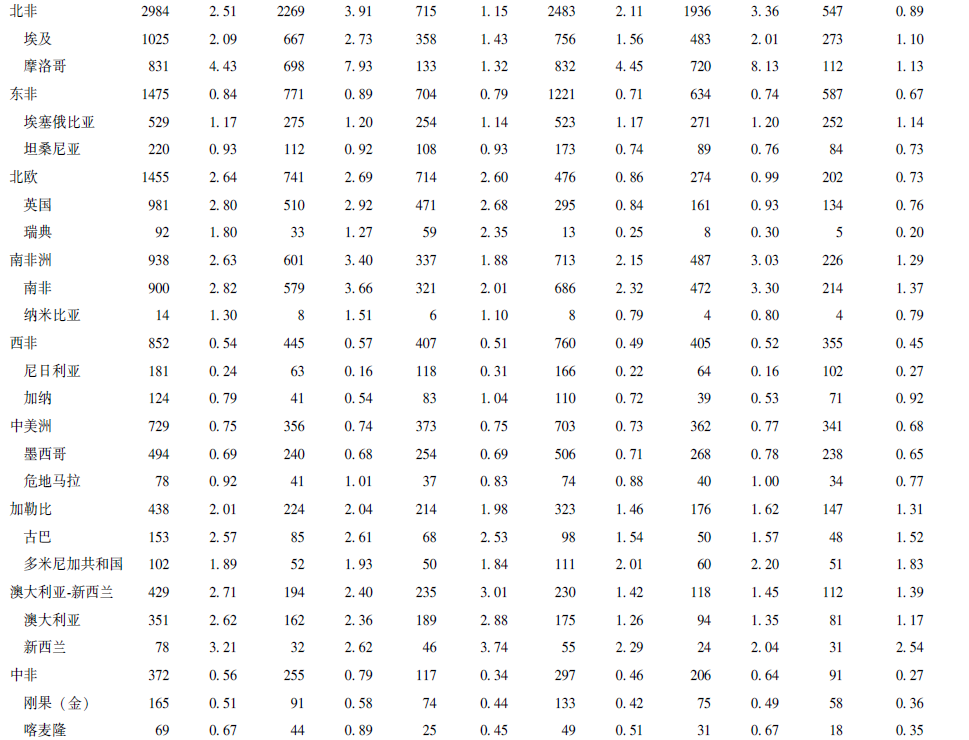
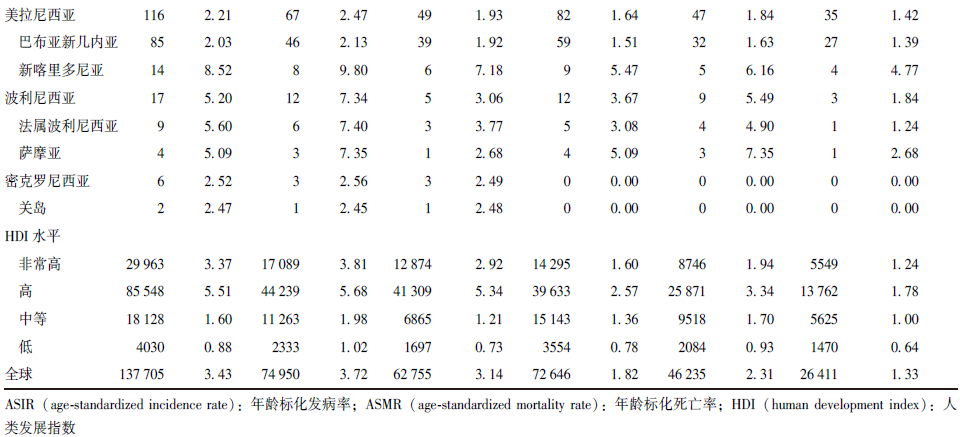
早发性肺癌疾病负担存在明显的地理差异,在全球21个区域中,早发性肺癌发病和死亡负担最严重的区域为东亚(图1),2022年其早发性肺癌新增病例71277例,死亡病例27234例,分别占全球相关病例总数的51.76%和37.49%,ASIR和ASMR分别居全球第一位和第二位(表1)。不同年龄组早发性肺癌的发病和死亡负担具有类似的地理分布,即在任一年龄组中,东亚均是早发性肺癌发病和死亡相对严重的区域(图1)。
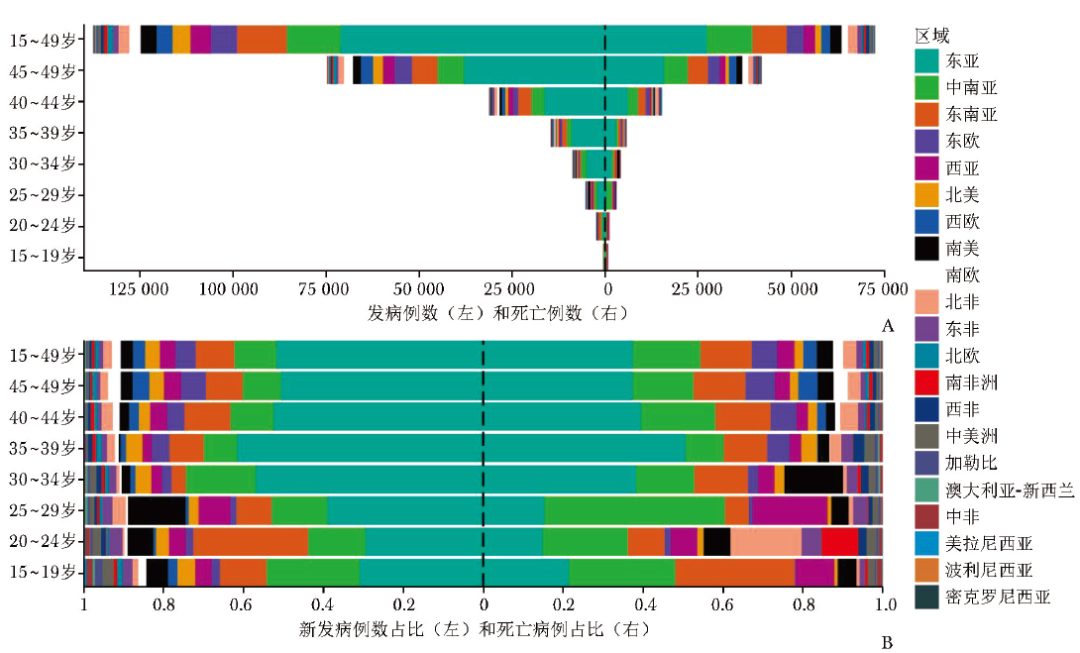
图1 全球不同区域早发性肺癌特定年龄组的发病与死亡病例数(A)及其占比(B)
各区域早发性肺癌的男、女性ASIR比为1.13(1.03,2.01),其中男性ASIR高于女性的区域共17个,占比80.95%;男、女性ASMR比为1.35(1.15,2.31),其中超过90%的区域,男性死亡负担高于女性(表1)。
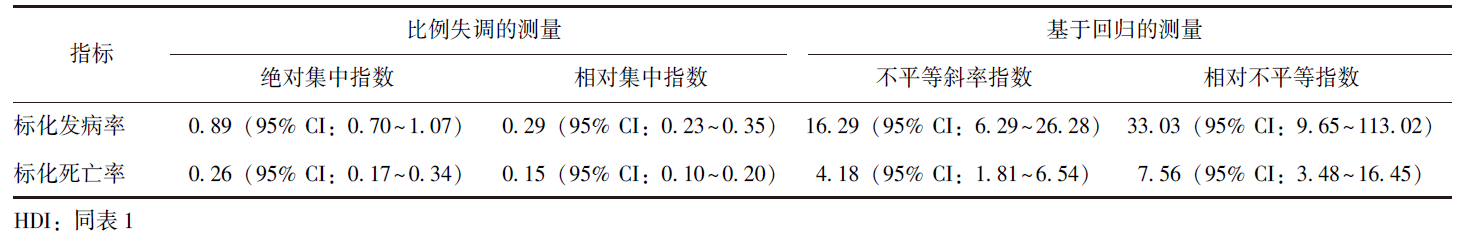
早发性肺癌的发病和死亡负担主要集中于高HDI地区(表1)。早发性肺癌的发病和死亡负担与不同国家发展水平之间存在复杂的关系。随着HDI水平升高,ASIR和ASMR逐渐增高,但当HDI>0.80后(高HDI水平),ASIR和ASMR逐渐下降(图2A)。与HDI相关的早发性肺癌疾病负担不平等性分析结果表明,ASIR和ASMR的集中曲线均凸向诊断平等线的下方(图2B)且用于测量与HDI相关的早发性肺癌疾病负担不平等性的综合指标(表2)也均提示早发性肺癌的发病和死亡负担主要集中于高HDI水平的地区。
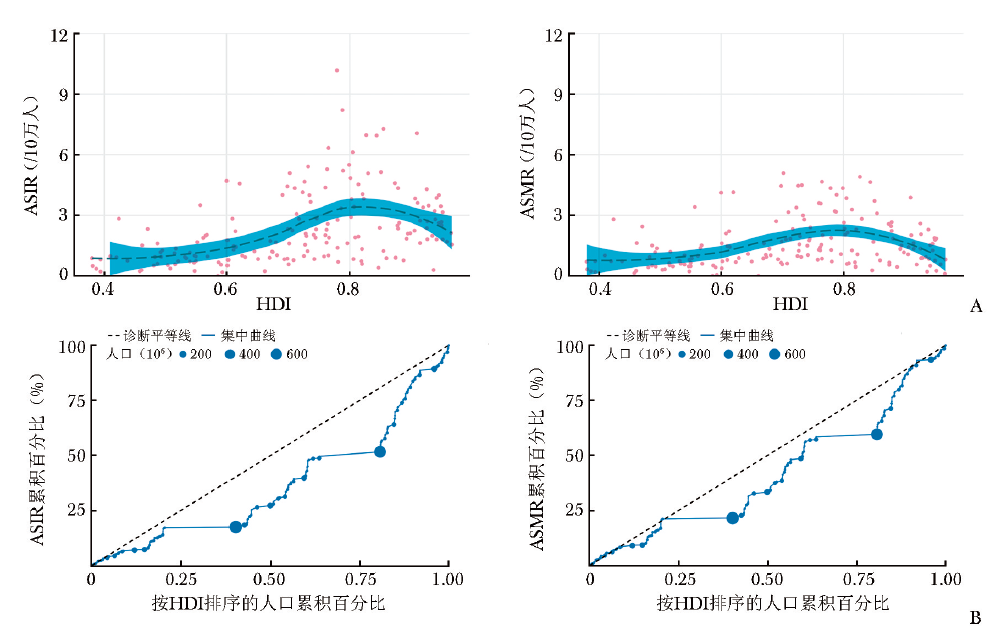
图2 全球早发性肺癌发病和死亡负担与HDI相关的不平等
A.ASIR和ASMR与HDI的关联;B.ASIR和ASMR的集中曲线
表2 与HDI相关的年龄标准化率不平等性的综合测量指标
中国早发性肺癌疾病负担较为沉重。2022年中国早发性肺癌新增病例67 052例,占全球新增病例总数的48.69%,死亡病例25988例,占全球死亡病例总数的35.77%,ASIR和ASMR分别为8.21/10万人和3.17/10万人,疾病负担远高于美国、日本等国家。
在性别差异方面,中国早发性肺癌的疾病负担呈现明显的性别不平等现象。2022年中国男性早发性肺癌新增病例为32094例,ASIR为7.67/10万人,女性早发性肺癌新增病例为34958例,ASIR为8.78/10万人。尽管男性早发性肺癌发病负担低于女性,但死亡负担却高于女性。2022年男性早发性肺癌死亡病例16843例,ASMR为4.01/10万人,女性早发性肺癌死亡病例9145例,ASMR为2.29/10万人,男性早发性肺癌死亡例数和ASMR约是女性的2倍(表1)。
2.2 全球和中国早发性肺癌相关风险因素
基于全球和中国数据的风险因素分析结果显示,16种风险因素对早发性肺癌DALYs损失具有实质性贡献(贡献率>0)。
在全球范围内,吸烟和室外颗粒物污染是最主要的风险因素,分别导致42.01%和15.62%的DALYs损失。与全球趋势相似,中国早发性肺癌的主要风险因素同样为吸烟和室外颗粒物污染,其DALYs损失贡献率分别达46.78%和20.84%,表明吸烟和室外颗粒物污染对中国的相对危害更为严重。
在全球层面,室内空气污染(6.40%)和二手烟(5.80%)分别为第三和第四位的风险因素;但在中国,室内空气污染则降至第五位(4.26%),二手烟升至第三位(7.89%)(图3)。
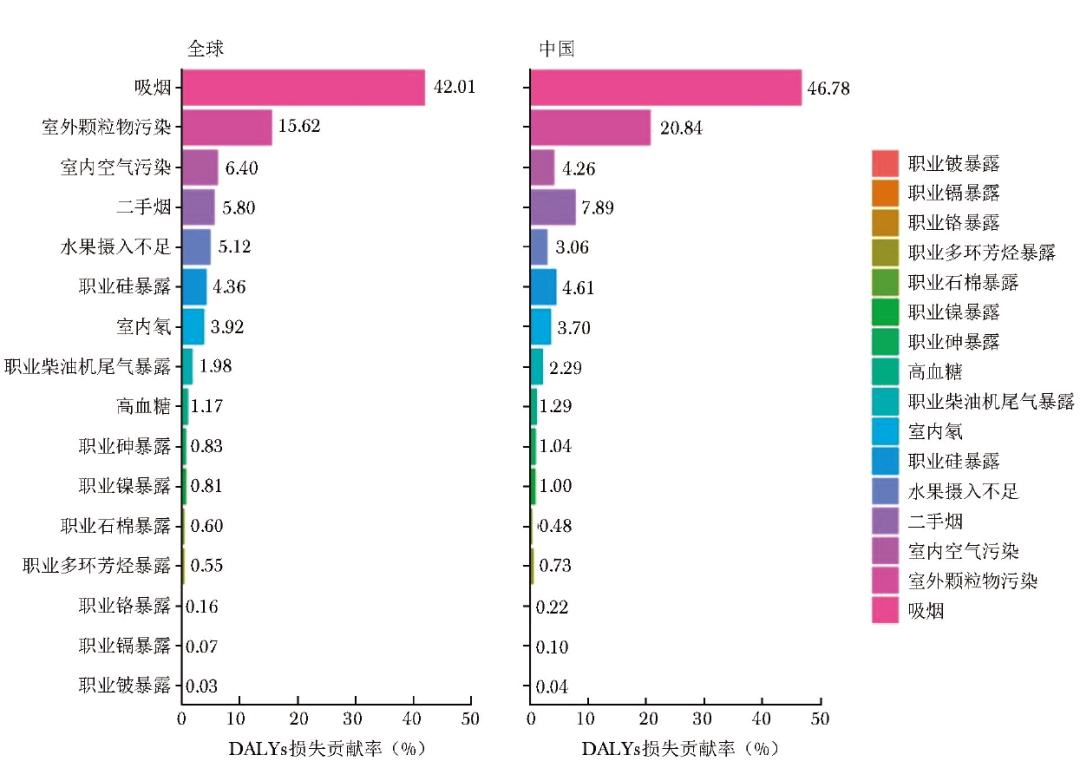
图3 全球及中国各项风险因素对早发性肺癌DALYs损失贡献率
此外,在全球层面不同年龄组中,早发性肺癌的风险因素构成亦存在明显差异。在25~49岁年龄组中,吸烟和室外颗粒物污染对DALYs损失的贡献率较高,是早发性肺癌的主要风险因素。相比之下,在15~24岁年龄组中,仅室内氡暴露造成了部分DALYs的损失。此外,随着年龄增加,可变的风险因素对DALYs损失的贡献率逐步增加(图4)。这些差异反映出不同国家与地区在社会环境、行为习惯及空气质量方面的差别,进而影响早发性肺癌的疾病负担构成。
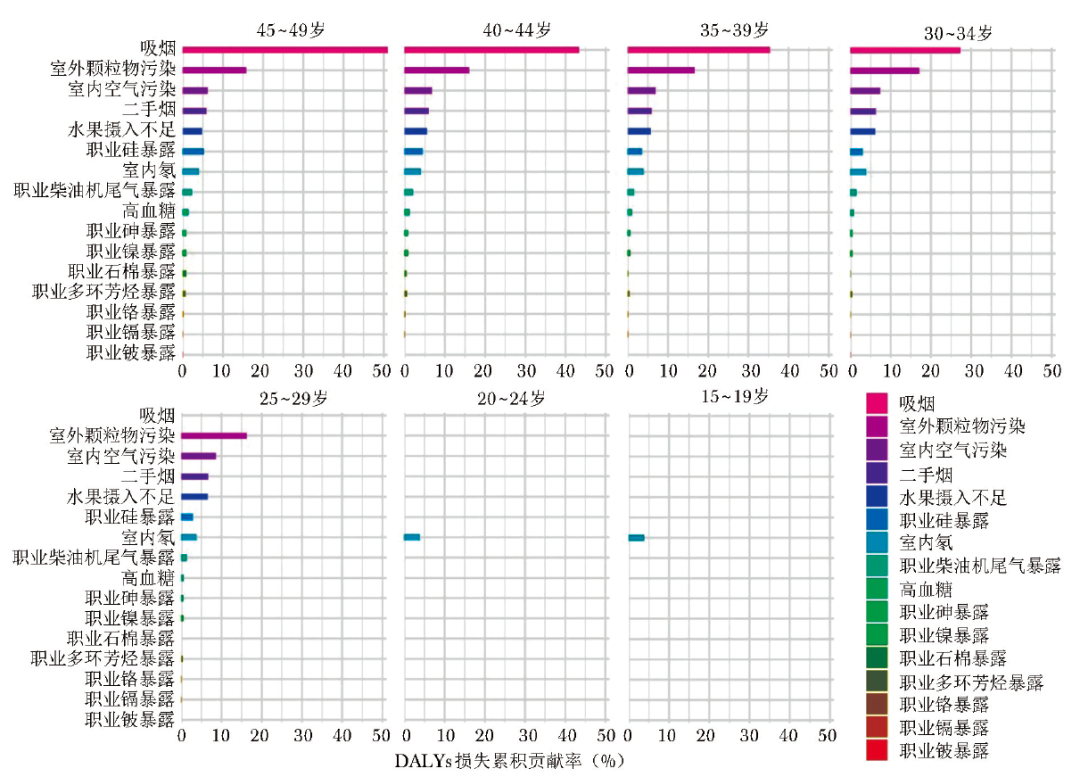
图4 全球特定年龄组中各项风险因素对早发性肺癌DALYs损失贡献率
3 讨论
本研究基于GLOBOCAN 2022数据集和GBD 2021数据集,从全球和中国层面系统评估了15~49岁人群早发性肺癌的疾病负担,为肺癌疾病负担评价提供了最新数据。结果证实,在全球层面,东亚(特别是中国)是早发性肺癌高疾病负担的核心区域,吸烟是造成全球和中国早发性肺癌DALYs损失的主要原因。此外,全球和中国的早发性肺癌疾病负担在区域、性别和年龄组方面均存有差异,需分层进行管理,以进一步提升癌症防治效果。
本研究发现HDI与早发性肺癌疾病负担存在明显的健康不平等,高HDI地区的发病和死亡负担高于其他水平HDI地区。分析可能原因:相较于非常高HDI的地区,高HDI地区正处于快速工业化和经济转型时期,伴随经济迅速发展,居民物质生活水平极大改善的同时,一系列环境变化和风险因素也随之出现,如室外空气污染,特别是PM2.5、氮氧化物等空气污染物,已被广泛认定为诱发肺癌的重要环境因素[15-17]。
此外,吸烟与肺癌的关系早已被证实[18-20],在高HDI的国家,居民吸烟率虽有所下降,但仍具有庞大的吸烟人群,比如2019年中国年龄标化吸烟率相比1990年下降了19.5%,然而吸烟者数量却增加了22.2%[21],因此,归因于空气污染和吸烟所引起的早发性肺癌疾病负担是高HDI国家或地区的主要原因,这与本研究全球和中国早发性肺癌疾病负担风险因素报告的结果相一致。此外,相比于中等或低HDI地区,高HDI地区拥有更为完善的医疗保障体系、癌症筛查方案、数据收集和报告机制[22-23],这使得高HDI地区的人群早期发现并有效报告早发性肺癌的可能性更高。
中国作为高HDI水平的代表国家之一,承担着全球近一半的早发性肺癌新增病例和超过三分之一的死亡病例,具有较高的ASIR和ASMR。造成这一现象的原因除上述的高HDI地区在经济快速发展的同时,易产生环境相关致癌风险因素外,庞大的人口基数是中国早发性肺癌疾病负担远高于其他国家的重要原因。
此外,本研究发现,全球男性早发性肺癌的发病和死亡疾病负担均高于女性,这一结论与既往针对肺癌疾病负担的评价结果一致[24]。然而,中国男性的早发性肺癌发病负担低于女性,死亡负担却高于女性,造成这一现象的原因较为复杂。其中更多的风险因素暴露和更敏感的烟草暴露可能是中国女性早发性肺癌发病负担高于男性的重要原因。研究表明,内源性和外源性性激素与烟草中致癌物之间的相互作用使得女性吸烟者更易发生肺癌[25]。
除烟草暴露外,室内油烟暴露也是女性发生肺癌的风险因素之一[26]。女性早发性肺癌患者更易被早期发现、更有可能被诊断为腺癌,对新辅助化疗的反应更好,使女性早发性肺癌患者比男性具有更高的生存率[26-28]。此外,一项基于GBD 2019数据集的研究发现,自1990—2019年以来,中国早发性肺癌的ASIR和ASMR均呈下降趋势[29],这可能与中国政府积极采取控烟措施使得人群吸烟流行趋势下降有关[21],该结果进一步强调了积极实施烟草控制措施对减轻早发性肺癌疾病负担的重要性。
吸烟和室外颗粒污染物是全球和中国范围内早发性肺癌疾病负担的主要风险因素,但其对中国的相对危害更为严重。此外,二手烟对中国早发性肺癌的危害程度同样高于全球水平,这些发现强调了中国进一步加强烟草控制措施,降低吸烟率和二手烟暴露率的必要性和紧迫性。
目前,中国正处在经济发展的转型时期,经济发展结构快速调整,国家已出台了一系列绿色发展措施,推动经济绿色转型,对于降低早发性肺癌发生率具有重要意义[30]。在15~24岁年龄组中,可变风险因素对DALYs损失的贡献率十分有限,这可能与遗传和该年龄段早发性肺癌病例较少,DALYs负担相对较低,导致风险因素的可量化贡献率较小有关。
由于肺癌发病机制的多样性和复杂性,在肺癌防控领域,除政府进行宏观调控外,还应动员个体、家庭和社区组织在多方面形成合力,通过新媒体传播方式加强健康宣教,提高个体认知能力和自我效能,并共同着手改善个体的饮食、生活方式等癌症病因学相关危险因素[31],形成理论与实践相结合、宏观与微观并举的科学防控体系。
本研究局限性:(1)为横断面研究,未对早发性肺癌疾病负担和相关风险因素进行纵向分析,因此无法了解早发性肺癌疾病负担和相关风险因素的长期变化趋势;(2)虽然基于GBD 2022数据集计算了早发性肺癌相关风险因素对DALYs损失的贡献率,但不同风险因素之间可能存在交互作用,因而单独计算各风险因素的DALYs损失贡献率可能会出现重复归因问题,在理论上会高估某些风险因素对DALYs的影响。
综上所述,高HDI地区,尤其是中国承受着最为沉重的早发性肺癌疾病负担。烟草暴露和空气污染是全球及中国导致DALYs损失的主要可变风险因素,该结果更新并拓展了全球及中国早发性肺癌疾病负担和风险因素的流行病学证据,为政策制订者实施有针对性的干预措施提供了重要依据,从而促进早发性肺癌疾病负担的减轻。
参考文献
[1]Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
[2]Ferlay J, Ervik M, Lam F, et al. Global cancer observatory: cancer today (version 1.0)[EB/OL]. [2024-12-24]. https://gco.iarc.who.int/today.
[3]Lu X B, Chen Y Z, Li Y X, et al. Different clinicopathological features between young and older patients with pulmonary adenocarcinoma and ground-glass opacity[J]. Sci Rep, 2024, 14(1): 15679.
[4]Laguna J C, Tagliamento M, Lambertini M, et al. Tackling non-small cell lung cancer in young adults: from risk factors and genetic susceptibility to lung cancer profile and outcomes[J]. Am Soc Clin Oncol Educ Book, 2024, 44(3): e432488.
[5]Shi J, Li D J, Liang D, et al. Epidemiology and prognosis in young lung cancer patients aged under 45 years old in northern China[J]. Sci Rep, 2021, 11(1): 6817.
[6]Liu B L, Quan X Y, Xu C G, et al. Lung cancer in young adults aged 35 years or younger: a full-scale analysis and review[J]. J Cancer, 2019, 10(15): 3553-3559.
[7]Bridgette T, Catherine B, Danielle N F, et al. The interp of financial toxicity and family building in young adult cancer survivors[J]. Cancer, 2018, 124(16): 3284-3289.
[8]Kim K, Yoon H. Health-Related quality of life among cancer survivors depending on the occupational status[J]. Int J Environ Res Public Health, 2021, 18(7): 3803.
[9]Chinese Expert Group on Early Diagnosis and Treatment of Lung Cancer, China Lung Oncology Group. China national lung cancer screening guideline with low-dose computed tomography (2023 version)[J]. Chin J Lung Cancer, 2023, 26(1): 1-9.
[10]US Preventive Services Task Force. Screening for lung cancer: US preventive services task force recommendation statement[J]. JAMA, 2021, 325(10): 962-970.
[11]Li Z, Zhang X J, Sun C Y, et al. Global, regional, and national burdens of early onset pancreatic cancer in adolescents and adults aged 15-49 years from 1990 to 2019 based on the Global Burden of Disease Study 2019: a cross-pal study[J]. Int J Surg, 2024, 110(4): 1929-1940.
[12]Wickham H. Ggplot2: elegant graphics for data analysis[M]. Cham: Springer, 2016.
[13]Doll R, Payne P, Waterhouse J. Cancer incidence in five continents[M]. Berlin: Springer, 1966.
[14]Antiporta D A, Menéndez P, Kirkby K, et al. Healthequal: Calculating summary measures of inequality[EB/OL].[2024-12-24]. https://cloud.r-project.org/web/packages/healthequal/vignettes/healthequal-package-demo.html.
[15]Chen C Y, Huang K Y, Chen C C, et al. The role of PM2.5 exposure in lung cancer: mechanisms, genetic factors, and clinical implications[J]. EMBO Mol Med, 2025, 17(1): 31-40.
[16]Zhang Z Y, Zhu D W, Cui B, et al. Association between particulate matter air pollution and lung cancer[J]. Thorax, 2020, 75(1): 85-87.
[17]Turner M C, Andersen Z J, Baccarelli A, et al. Outdoor air pollution and cancer: an overview of the current evidence and public health recommendations[J]. CA Cancer J Clin, 2020, 70(6): 460-479.
[18]Wynder E L, Hoffmann D. Smoking and lung cancer: scientific challenges and opportunities[J]. Cancer Res, 1994, 54(20): 5284-5295.
[19]Loeb L A, Ernster V L, Warner K E, et al. Smoking and lung cancer: an overview[J]. Cancer Res, 1984, 44(12 Pt 1): 5940-5958.
[20]O'Keeffe L M, Taylor G, Huxley R R, et al. Smoking as a risk factor for lung cancer in women and men: a systematic review and meta-analysis[J]. BMJ Open, 2018, 8(10): e021611.
[21]GBD 2019 Tobacco Collaborators. Spatial, temporal, and demographic patterns in prevalence of smoking tobacco use and attributable disease burden in 204 countries and territories, 1990-2019: a systematic analysis from the Global Burden of Disease Study 2019[J]. Lancet, 2021, 397(10292): 2337-2360.
[22]Bizuayehu H M, Ahmed K Y, Kibret G D, et al. Global disparities of cancer and its projected burden in 2050[J]. JAMA Netw Open, 2024, 7(11): e2443198.
[23]Rafiemanesh H, Mehtarpour M, Khani F, et al. Epidemiology, incidence and mortality of lung cancer and their relationship with the development index in the world[J]. J Thorac Dis, 2016, 8(6): 1094-1102.
[24]Guo L W, Zhu C X, Cai L, et al. Global burden of lung cancer in 2022 and projected burden in 2050[J]. Chin Med J (Engl), 2024, 137(21): 2577-2582.
[25]Stapelfeld C, Dammann C, Maser E. Sex-specificity in lung cancer risk[J]. Int J Cancer, 2020, 146(9): 2376-2382.
[26]Ko Y C, Lee C H, Chen M J, et al. Risk factors for primary lung cancer among non-smoking women in Taiwan[J]. Int J Epidemiol, 1997, 26(1): 24-31.
[27]Cerfolio R J, Bryant A S, Scott E, et al. Women with pathologic stage Ⅰ, Ⅱ, and Ⅲ non-small cell lung cancer have better survival than men[J]. Chest, 2006, 130(6): 1796-1802.
[28]Sakurai H, Asamura H, Goya T, et al. Survival differences by gender for resected non-small cell lung cancer: a retrospective analysis of 12,509 cases in a Japanese Lung Cancer Registry study[J]. J Thorac Oncol, 2010, 5(10): 1594-1601.
[29]杨宗明, 许健豪, 朱章航, 等. 中国人群早发性癌症的疾病负担分析及预测[J/OL]. 科学通报:1-11[2024-12-24]. http://kns.cnki.net/kcms/detail/11.1784.N.20240620.1707.023.html.
[30]Zhang S L, Wu Z H, Wang Y, et al. Fostering green development with green finance: an empirical study on the environmental effect of green credit policy in China[J]. J Environ Manage, 2021, 296: 113159.
[31]Gotay C C. Behavior and cancer prevention[J]. J Clin Oncol, 2005, 23(2): 301-310.


