脑室外神经细胞瘤“误诊”为室管膜瘤,检出特征性FGFR1::TACC1融合助力临床诊断
时间:2025-09-10 12:12:13 热度:37.1℃ 作者:网络
中枢神经系统肿瘤的诊断和管理具有挑战性,尤其是当肿瘤表现不典型且需要分子分析来确认病理,以提供发病率和死亡率风险最低的最佳治疗时。本文病例为一名 34 岁男性,表现为胼胝体和脑室内出血性病变,最初被归类为室管膜瘤,经分子检测后重新定义为神经细胞瘤。患者无明显既往病史。初始临床表现为剧烈头痛、恶心和畏光。初始处理包括为急性脑积水置入脑室外引流管。在导航辅助下对病变进行了活检。为持续性脑积水行脑室-腹腔分流术。在确认神经细胞瘤的分子诊断后,伽玛刀治疗取得了良好效果。本病例的重要性核心在于分子诊断在准确分类中枢神经系统(CNS)肿瘤中的关键作用,特别是在组织病理学分析可能不确定的情况下,从而实现更具针对性的管理。通过伽玛刀等微创治疗方案,有望使这些复杂病变的有效管理成为可能。

▲摘自《2021年第五版WHO中枢神经系统肿瘤分类》
背 景
脑室外神经细胞瘤(EVNs)是罕见的神经元肿瘤,由于其与其他中枢神经系统(CNS)肿瘤的组织病理学相似性,给诊断带来了显著挑战。这类肿瘤最初归类于2007年世界卫生组织(WHO)中枢神经系统肿瘤分类中,通常表现为大脑半球内大的、边界清晰的病变,好发于额叶和顶叶。然而,已有报道称其可发生于多个部位,包括丘脑、小脑甚至脊髓,凸显了其多样的解剖学分布和临床表现。影像学在脑室外神经细胞瘤的初步评估中发挥着关键作用。磁共振成像(MRI)通常显示异质性病变,伴不同程度的强化,常伴有囊性成分和钙化。组织病理学上,脑室外神经细胞瘤表现出广泛的形态学谱,包括片状、簇状、条索状或玫瑰花结状的形态单一的神经细胞,散在神经毡。这种变异性可能导致误诊,因为这些特征常与其他类型的中枢神经系统肿瘤(如室管膜瘤)相似。分子检测(尤其是DNA甲基化分析)的出现彻底改变了中枢神经系统肿瘤的诊断和分类,能够将其与组织学相似的肿瘤区分开来。FGFR1::TACC1融合基因的检测为脑室外神经细胞瘤的诊断提供了关键证据。近期研究强调了此类分子改变不仅在诊断中,而且在理解这些罕见肿瘤的发病机制和潜在治疗靶点中的重要性。
本病例强调了影像学、组织病理学和分子检测在脑室外神经细胞瘤诊断中的关键相互作用,凸显了涉及神经影像学、神经病理学和分子遗传学的多学科方法的必要性。尽管大体全切除仍是治疗的基石,但这些肿瘤的浸润性以及与重要结构的邻近性常需要辅助治疗,如放疗或基于分子变异的新兴靶向治疗。尽管在分类和管理方面取得了进展,但对脑室外神经细胞瘤的生物学特性和最佳治疗策略的理解仍存在差距。本报告通过对本病例(包括诊断挑战和分子层面的见解)进行详细分析,旨在为不断增长的脑室外神经细胞瘤文献做出贡献,并指导未来的研究工作以改善患者预后。
病 例
患者男,34 岁,洪都拉斯人,无相关既往病史。其临床表现始于剧烈头痛,伴恶心、呕吐及畏光。患者最初在原籍国接受了脑部MRI检查,显示胼胝体水平有一肿块,伴脑室内出血及急性脑积水。为暂时缓解脑积水,患者接受了右侧额部脑室外引流术。随后患者被转至美国接受专科治疗。抵达拉金迈阿密神经科学中心时,患者神志清醒、警觉且定向力正常。体格检查未发现运动功能障碍,脑室外引流管功能正常。患者接受了脑部断层扫描及MRI检查。头颅CT显示胼胝体水平有一肿块,延伸至脑室内,可见出血征象及点状钙化。脑室外引流管位于侧脑室右侧额角,与肿瘤肿块直接接触(图1)。
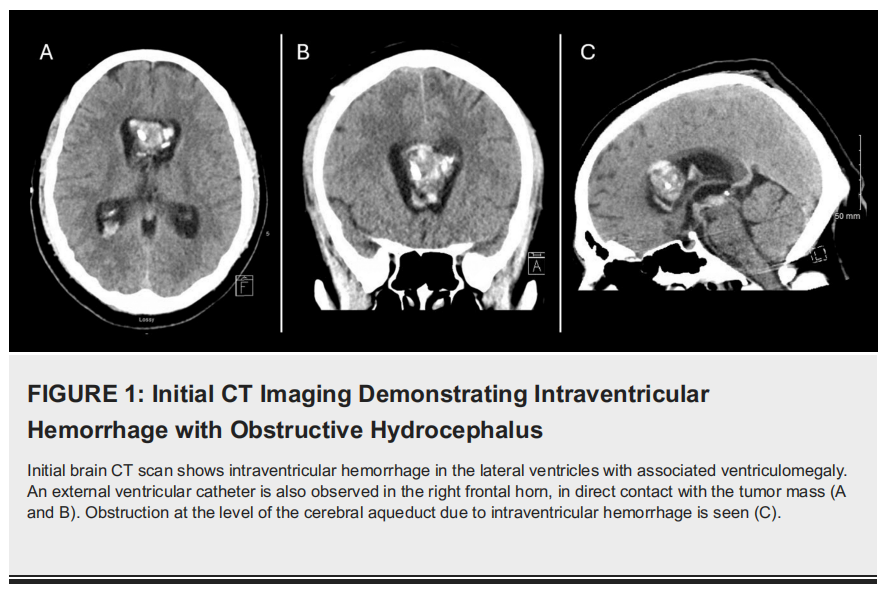
▲图1 初始CT成像显示脑室内出血伴阻塞性脑积水
脑部MRI显示胼胝体前三分之一与中三分之一之间存在异质性病变,伴脑室内延伸。病变中央部分可见轻度强化(图2)。患者计划在导航辅助下对脑部病变进行立体定向活检。
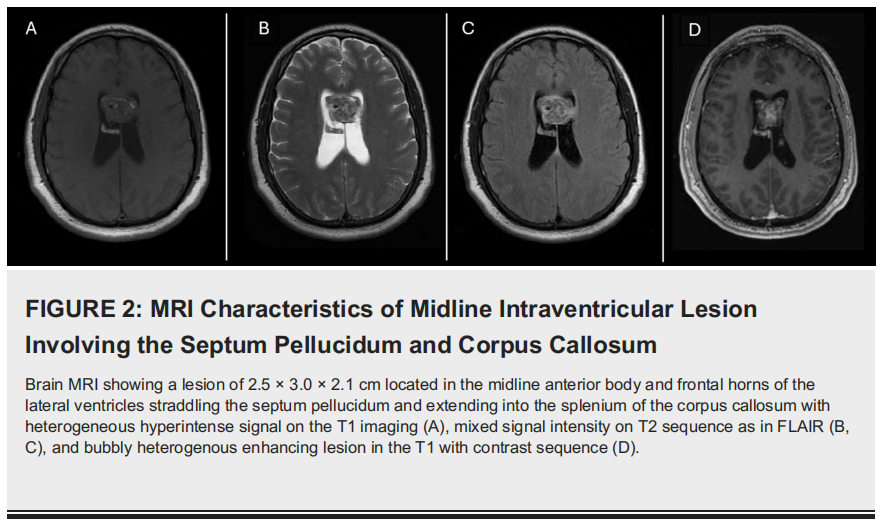
▲图2 累及透明隔和胼胝体的中线脑室内病变的MRI特征
肿瘤显示轻至中度异型性、纤维状胶质基质及特征性血管周围假菊形团。免疫组化分析支持该分类,胶质纤维酸性蛋白(GFAP)和S100呈弥漫强阳性,且突触素表达阳性。这提示存在神经元分化的可能。Ki-67增殖指数约 5%,提示为低级别肿瘤(图3)。
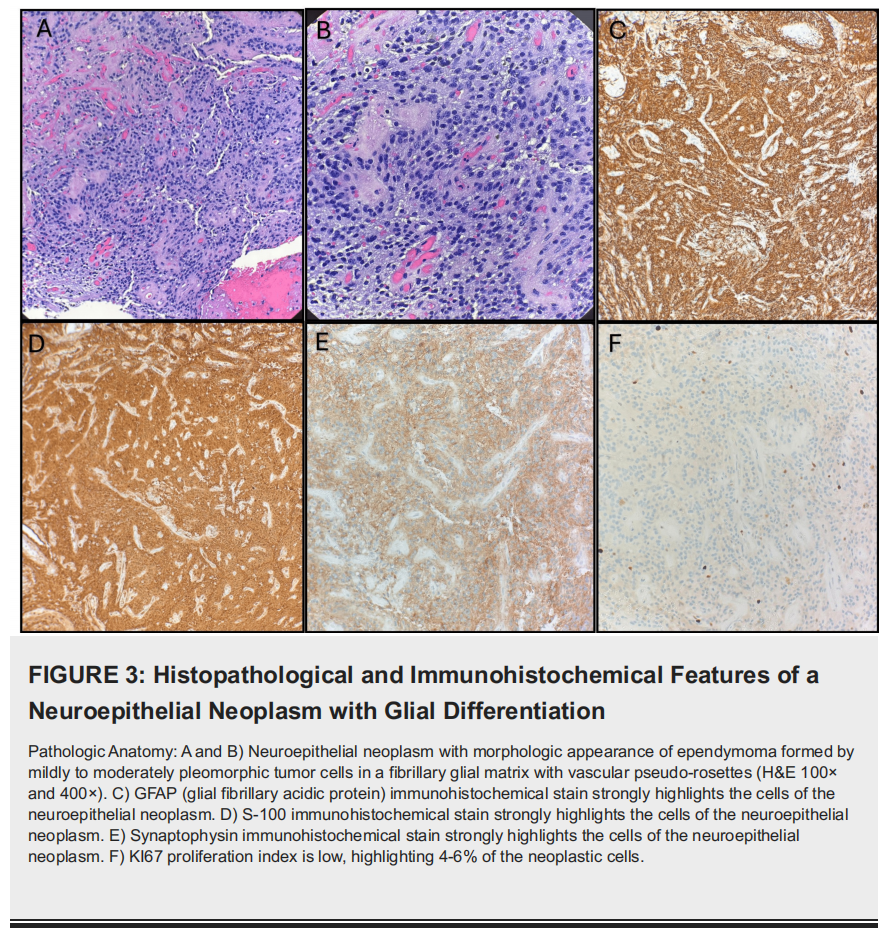
▲图3 具有神经胶质分化的神经上皮肿瘤的组织病理学和免疫组织化学特征
由于脑积水持续存在,需要行确定性脑室-腹腔分流术,该手术同样计划在导航辅助下进行(图4A)。手术过程顺利,患者术后转入重症监护病房,病情稳定。患者术后恢复良好,头痛症状改善,神经功能稳定。给予丙戊酸预防癫痫发作,类固醇治疗脑水肿。随访影像学检查显示脑室扩张减轻(图4B)。患者出院进行门诊随访,等待活检结果。
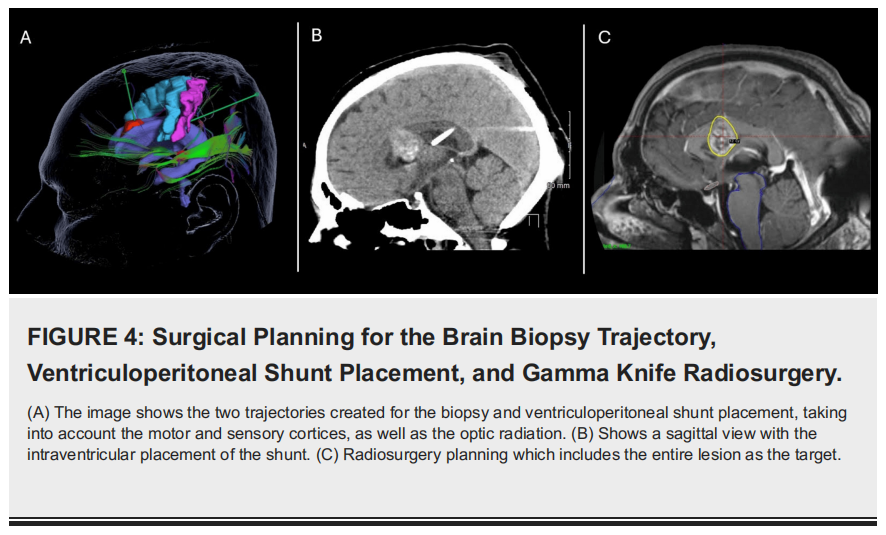
▲图4 脑活检轨迹、脑室腹腔分流术放置和伽玛刀放射外科手术计划
该患者的诊断检查结合了神经影像学、组织病理学分析和分子研究,以准确确定肿瘤性质。在获得脑室外神经细胞瘤(EVN)的明确诊断后,患者接受了伽玛刀放射外科(GKRS)治疗,取得了良好的临床效果(图4C)。患者门诊随访时无明显症状,无任何神经功能缺损,随访MRI显示肿瘤体积显著缩小,无相关脑或脊髓病变(图5)。
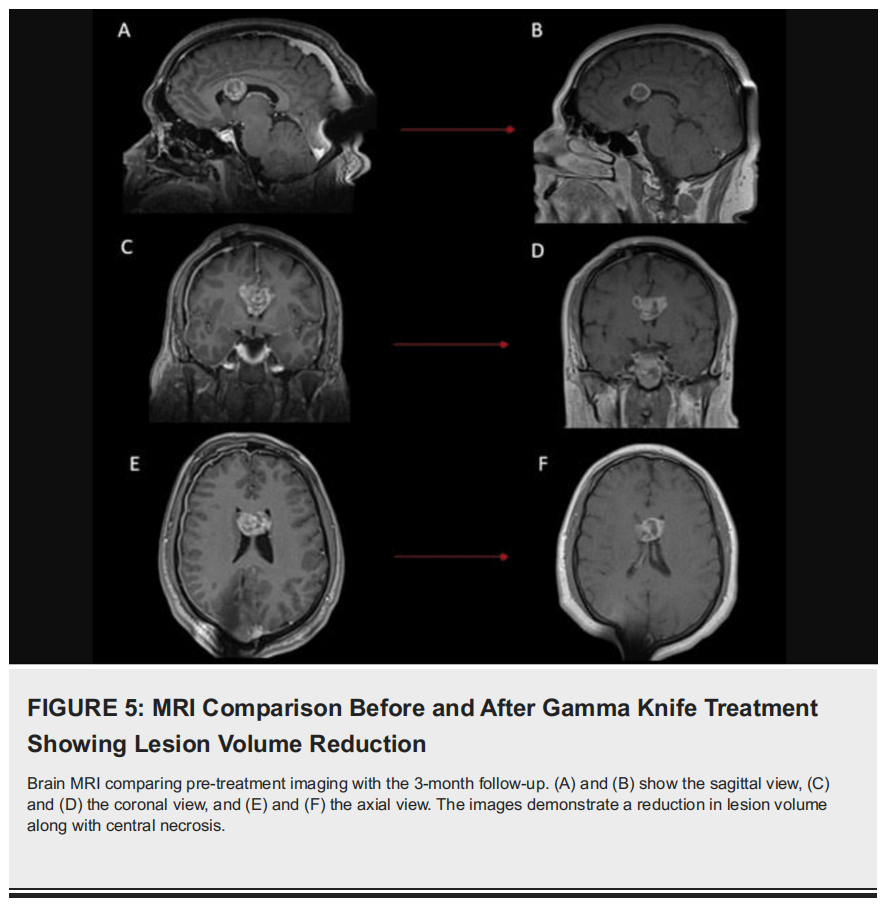
▲图5 伽玛刀治疗前后MRI对比显示病灶体积缩小
患者出现急性头痛和脑积水体征促使进行紧急神经影像学检查。脑部计算机断层扫描显示侧脑室和第三脑室脑室内出血,并伴有脑室扩大。磁共振成像显示侧脑室体部前部有肿块样病变伴强化,伴有病灶周围水肿及相关占位效应。鉴于组织病理学特征重叠且存在神经元标志物,遂进行了额外的分子检测。DNA甲基化谱将该肿瘤重新归类为脑室外神经细胞瘤,中枢神经系统WHO 2级。FGFR1::TACC1融合基因的检测进一步证实了这一分类,该融合基因是神经细胞瘤的特征性分子标志物。这些分子学发现有助于解释其不典型的组织病理学表现——最初因其形态相似而被提示为室管膜瘤。
组织学、免疫组织化学和分子数据的整合得以确立脑室外神经细胞瘤(中枢神经系统WHO 2级)的诊断。本病例强调了先进分子诊断技术在中枢神经系统肿瘤准确分类中的关键作用。深刻认识到先进分子诊断技术对于辅助疑难中枢神经系统肿瘤分类的重要性。这对于组织病理学特征重叠的病例尤为重要。最初,基于形态学和免疫组织化学,组织病理学检查倾向于诊断为2级室管膜瘤。尽管如此,甲基化研究揭示了其分子分类为脑室外神经细胞瘤(中枢神经系统WHO 2级)。这一过程强调了多学科方法的必要性,该方法整合了神经病理学、分子遗传学和神经放射学,以确保准确诊断和最佳患者管理。
治疗计划为单个部位,使用 4 mm、8 mm和 16 mm准直器,共 16 个等中心。随后患者被转至伽玛刀治疗室,接受放射外科治疗。50% 等剂量线处给予总剂量 12 Gy,覆盖治疗体积 8.2 cm3(图3C)。脑干接受的最大剂量小于 1.6 Gy,远在安全耐受限度内。放射外科手术完成后,患者被送至手术室拆除立体定向头架。固定针部位被彻底清洁并妥善包扎。经过短期观察和监测后,患者病情稳定出院回家,并开具了地塞米松处方。
讨 论
2021 年世界卫生组织(WHO)中枢神经系统肿瘤分类将神经细胞瘤分为两大类,即中枢神经细胞瘤(CN)和脑室外神经细胞瘤(EVNs),两者均被认为是罕见的颅内病变。中枢神经细胞瘤和脑室外神经细胞瘤的患病率明显较低,约占所有脑肿瘤的 0.1%-0.5%。据报道,美国中枢神经细胞瘤和脑室外神经细胞瘤的合并年发病率为每 10 万人 0.032 例,其中中枢神经细胞瘤的发病率(0.022)高于脑室外神经细胞瘤(0.009)。
神经细胞瘤通过综合临床评估策略进行诊断。磁共振成像(MRI)是识别这些病变的主要影像学检查手段。对于中枢神经细胞瘤,其特征性表现为脑室内定位,常见于侧脑室。其表现为边界清晰的强化病变,偶见钙化和囊性成分。另一方面,脑室外神经细胞瘤通常发生于脑室系统外,最常见于额叶和小脑,也有病例报道见于颞叶。脑室外神经细胞瘤在MRI上常表现为不均匀强化、囊性变、病灶周围水肿和钙化。组织病理学检查具有共同特征,包括胞质透明、细胞核圆形的细胞,呈玫瑰花结状排列。突触素、神经元核抗原(NeuN)和神经元特异性烯醇化酶(NSE)等神经标志物阳性,且Ki-67增殖指数不等,也是其特征。以DNA甲基化和下一代测序为中心的分子检测有助于确诊,尤其是因为与其他肿瘤的组织病理学特征相似的情况。这有助于明确诊断并帮助判断可能的预后。
中枢神经细胞瘤伴有与颅内高压相关的症状,包括头痛、恶心和呕吐;这些症状常掩盖梗阻性脑积水,后者由肿瘤位于侧脑室导致脑脊液流动受阻引起。另一方面,脑室外神经细胞瘤的临床表现包括多种症状,如头痛、恶心,以及取决于其位置、肿块效应和水肿效应的神经功能缺损。已有特定病例报告描述脑出血为脑室外神经细胞瘤的初始表现,如本例所示。
鉴于本例为位于胼胝体水平、累及脑室的复杂出血性病变,使用导航等先进技术对准确活检和脑室-腹腔分流管的精准放置至关重要。这种在现有技术支持下的方法可降低风险,确保良好的术后效果,且不会引起额外的泌尿系统并发症。
室管膜瘤通过综合临床评估、组织病理学和分子检测进行诊断。磁共振成像(MRI)是确定肿瘤位置和范围的主要手段。室管膜瘤的特征为不均匀的实性-囊性表现,伴钙化和多种强化模式。组织病理学分析对正确诊断至关重要。室管膜瘤可根据细胞形态和有丝分裂活性进行识别和分类。其常见组织病理学特征包括血管周围假菊形团和室管膜菊形团,胶质纤维酸性蛋白(GFAP)和上皮膜抗原(EMA)等免疫组化标志物常阳性。值得注意的是,仅靠组织病理学不被视为确诊的足够准确工具。分子检测正成为诊断中枢神经系统疑难肿瘤的有价值工具。WHO分类根据分子标志物和特定解剖部位将室管膜瘤分为不同亚组。幕上室管膜瘤通过ZFTA(先前称为RELA)或YAP1融合进行分类。而后颅窝(PF)室管膜瘤根据甲基化谱命名为PFA和PFB,脊髓室管膜瘤可能出现MYCN扩增。DNA甲基化谱分析已成为准确诊断和预后评估的越来越有价值的工具。这有助于将室管膜瘤与其他具有相似组织病理学特征的肿瘤区分开来,同时也为潜在治疗策略提供分析依据。
正如本文病例所示,鉴于室管膜瘤和神经细胞瘤在临床表现、MRI特征及组织学特征上的高度相似性,正确诊断此类病变存在特定挑战。弥散加权成像结合表观弥散系数(ADC)值可能有助于鉴别。与神经细胞瘤相比,室管膜瘤通常具有更高的ADC值,而神经细胞瘤因细胞密度更高,ADC值较小。两种肿瘤均表现为小而圆、胞质透明的细胞,因此若无明确诊断依据,鉴别诊断过程十分困难。免疫组化染色必不可少。特别是神经细胞瘤,其突触素和神经元核抗原(NeuN)等神经标志物常呈高阳性。另一方面,室管膜瘤可表达不同的胶质标志物,尤其是胶质纤维酸性蛋白(GFAP)。值得注意的是,这些标志物并非完全特异,可能存在重叠。在分子研究方面,神经细胞瘤中的FGFR1:TACC1融合基因是一种关键的分子改变,因其具有临床意义。该融合基因可产生具有致癌潜能的嵌合蛋白,与FGFR1激酶结构域的失控激活相关,后者通过存活和增殖信号通路促进肿瘤发生。这些突变的存在有助于神经细胞瘤的准确诊断。此类突变因其对复发风险和侵袭性增强的影响而改变预后;充分理解分子特征是制定个性化随访策略的关键。该突变对潜在治疗策略也具有意义,因为FGFR抑制剂(如厄达替尼和佩米替尼)已在FGFR改变的治疗中显示出高效性。未来,神经细胞瘤中FGFR1:TACC1融合基因的识别可能提供比传统治疗方案更有效的靶向治疗策略。
关于分子分类,存在特定挑战需要考虑。2021年世界卫生组织(WHO)中枢神经系统肿瘤分类强调分子诊断工具对提高诊断准确性的重要性日益增加。室管膜瘤根据特定基因变异进行分类,例如幕上室管膜瘤以ZFTA(前称RELA)或YAP1融合基因为特征,而后颅窝室管膜瘤根据甲基化谱分为PFA和PFB亚型,脊髓室管膜瘤可能存在MYCN扩增。神经细胞瘤可能需要甲基化谱分析以与具有相似组织学特征的肿瘤区分。整合组织病理学、免疫组织化学和分子数据的综合诊断方法对明确诊断的重要性日益凸显。这种方法有助于克服单一诊断手段的局限性,全面了解肿瘤本质。
准确的鉴别诊断至关重要,因为室管膜瘤与脑室外神经细胞瘤的预后和治疗策略存在差异。例如,确诊ZFTA融合的幕上室管膜瘤通常比YAP1融合者预后更差。室管膜瘤的主要治疗方法是最大安全切除,随后进行放疗,尤其适用于II级和III级肿瘤或完全切除不可行或未实现的病例。化疗常用于复发情况,目前针对特定分子亚型的新兴免疫疗法正在研究中。
关于神经细胞瘤,此类肿瘤通常比室管膜瘤预后更好,但管理仍具挑战性。脑室外神经细胞瘤的 5 年总生存率(OS)约为 90.4%,但无进展生存率为 48.6%,表明存在显著的复发风险。50 岁以下患者预后更好。尽管被认为是良性肿瘤,神经细胞瘤仍具有多样的生物学行为、组织学模式和临床病程。在过去 15 年中,分次放疗和放射外科联合显微手术已用于其治疗。
脑室外神经细胞瘤的罕见性迄今阻碍了对其手术特征和治疗策略的准确定义。尽管两者均为WHO 2级肿瘤,但其预后较中枢神经细胞瘤差。大多数研究关注中枢神经细胞瘤的治疗,因此治疗指南被外推至脑室外神经细胞瘤。接受次全切除(STR)后行常规放疗或立体定向放射外科的中枢神经细胞瘤患者,其预后与接受大体全切除(GTR)者相当。然而,脑室外神经细胞瘤的预后仍不明确。
伽玛刀放射外科(GKRS)作为中枢神经细胞瘤的主要或辅助治疗已显示出良好效果。但由于脑室外神经细胞瘤发病率极低,相关数据缺乏。已有报道显示,伽玛刀放射外科治疗中枢神经细胞瘤术后残留肿瘤效果良好;在影像学诊断的中枢神经细胞瘤中也观察到良好效果,提示伽玛刀放射外科可作为小体积中枢神经细胞瘤的主要治疗方法。
最近一项关于脑室外神经细胞瘤管理的系统综述指出,完全手术切除是治疗的基石,辅助术后治疗的作用尚未明确,但应个体化治疗每个病例。与次全切除相比,大体全切除可显著改善生存结局。然而,当肿瘤位于功能区附近时,手术可能带来显著风险,包括术后神经功能缺损。立体定向放射外科因其能最大限度减少对周围脑结构的损伤,在功能区病变中具有独特优势,可作为主要或辅助治疗的有效替代方案,且神经并发症风险较低。在神经细胞瘤的综合治疗中,平衡肿瘤控制与神经功能保护仍是主要挑战。
对中枢神经细胞瘤(CN)立体定向放射外科(SRS)术后临床结局的系统分析表明,这种方法可能是一种有效的治疗手段。目前报道的剂量分别被认为是安全且有效的。放射相关不良事件(定义为影像学上治疗病灶周围的高信号)在中枢神经细胞瘤SRS治疗后罕见。据报道,接受原发性SRS治疗的患者局部控制失败率为 20%,而接受辅助性SRS治疗的患者失败率为 40%。其他研究也发现,原发性SRS能有效控制无症状偶发性神经细胞瘤。较小的肿瘤体积不太可能需要手术减压或出现症状,因为较小的肿瘤体积与更好的局部控制显著相关。
伽玛刀放射外科(GKRS)作为中枢神经细胞瘤的主要治疗方法,已被报道可实现成功的长期疾病控制。在一项对 14 例接受原发性GKRS治疗的患者的研究中,中位随访 25 个月期间均未出现复发。此外,GKRS治疗后无患者出现远处复发或沿颅脊轴扩散。
手术和放射外科之间的选择取决于多个因素,包括肿瘤的大小、确切位置以及患者的一般状况。因此,每个病例都必须个体化管理。在本例中,患者表现为胼胝体水平出血性病变并导致持续性脑积水,研究人员不得不借助导航技术对病变进行准确活检,然后在侧脑室右侧枕角放置脑室-腹腔分流管,以避免与肿瘤肿块接触。对于位于脑室前部区域的出血性病变,通过后方入路高精度放置导管的能力凸显了影像引导技术的关键价值。如本例所示,后方入路本应是最合适的初始策略,以最大限度降低初始手术干预中发生的肿瘤肿块接触风险。病变的位置和范围需要一种并发症可能性更低的微创治疗,因此在明确诊断为脑室外神经细胞瘤(EVN)后,研究人员进行了伽玛刀治疗,在疾病控制和神经功能恢复方面取得了优异效果。基于所回顾的数据和本病例,研究人员可以证实,立体定向放射外科是治疗功能区脑室外神经细胞瘤(EVNs)的一种有效且安全的治疗选择,如本例所示,在精准度和功能保留方面具有显著优势。
总之,本病例强调了多学科方法在诊断和治疗复杂中枢神经系统(CNS)肿瘤(如神经细胞瘤)中的重要性,尤其是当组织病理学发现与其他病变重叠且临床表现不典型时。该肿瘤最初被诊断为 2 级室管膜瘤,分子甲基化分析将其重新归类为神经细胞瘤。这种区分具有重要的临床意义,因为这些病变的预后和治疗策略不同。FGFR1::TACC1融合基因的识别和甲基化谱分析是实现准确诊断的关键,凸显了分子评估作为中枢神经系统肿瘤诊断中组织病理学补充的关键作用。胼胝体脑室外神经细胞瘤(EVN)伴瘤内出血是一种罕见且复杂的表现。神经导航和伽玛刀放射外科(GKRS)等先进技术的应用,通过促进活检操作、脑积水管理和精准治疗实施,以最低的发病率和死亡率提高了患者安全性。
实体瘤1560基因融合RNA检测(NGS方法学)项目,可检测FGFR1::TACC1融合在内超过1560种已知融合和数百个基因相关的未知融合。脑肿瘤460基因检测项目,面向胶质瘤、脑膜瘤、髓母细胞瘤、室管膜瘤等原发性中枢神经系统肿瘤患者,辅助分子分型,预后评估,预测可能获益的靶向、免疫、化疗药物,提示肿瘤遗传风险。中枢神经系统肿瘤全基因组甲基化检测项目,覆盖了CpG岛、启动子、编码区及增强子区域共约100万个CpG位点,筛选样本中的DNA甲基化位点,并与数据库中已知样本信息进行比较聚类分析,辅助中枢神经系统肿瘤的精准诊断及分子分型,同时包括了染色体拷贝数变异分析。

▲中枢神经系统肿瘤全基因组甲基化检测报告覆盖范围(部分)
参考文献:
Valerio J, Zumaeta J, Aguirre Vera GJ, Mazon P, Santiago Rea N, Alvarez-Pinzon AM. Extraventricular Neurocytoma With a Complex Presentation: The Role of Molecular Studies and Technology in Its Management. Cureus. 2025 Jun 17;17(6):e86229. doi: 10.7759/cureus.86229. PMID: 40677455; PMCID: PMC12270190.


