首例发生于胸膜的「GLI1改变的间叶性肿瘤」有何特征?RNA NGS检出PTCH1-GLI1融合助力临床诊断
时间:2025-09-10 12:12:20 热度:37.1℃ 作者:网络
GLI1改变的间叶性肿瘤是一类罕见的软组织肿瘤,最近被纳入世界卫生组织(WHO)第五版头颈部软组织肿瘤分类中。然而,其确切性质仍不明确,且尚未被赋予ICD编码。这些肿瘤主要位于头颈部区域,并表现出独特的病理形态学和分子特征。本文报告首例发生于胸膜的GLI1改变的间叶性肿瘤。显微镜检查显示,肿瘤由卵圆至圆形、隐约呈上皮样的细胞以及少量梭形细胞组成,所有细胞形态一致,呈巢状和网状排列,间质内伴有丰富的毛细血管网。免疫组织化学染色显示CD56、S-100和SMA阳性。下一代测序(NGS)显示存在PTCH1-GLI1融合。根据形态学和免疫表型特征,分子研究证实了GLI1改变的间叶性肿瘤的诊断。在 15 个月的随访中,患者存活。研究人员对所有复发和转移病例进行了回顾,结论是该类型肿瘤具有明显的肺转移倾向。该肿瘤具有恶性潜能,其发生于头颈部区域外、高级别组织学形态、活跃的核分裂象(>5/10 个高倍视野)、坏死以及PTCH1-GLI1融合等因素均被认为是潜在危险因素。
背 景
2004 年,Dahlen等人收集了一组独特的软组织肿瘤队列,分别位于舌(3 例)、胃(1 例)和小腿(1 例)。这些肿瘤的形态学特征为分叶状结构,由卵圆形和短梭形细胞组成,富含薄壁血管网。免疫组织化学分析显示平滑肌肌动蛋白(SMA)和层粘连蛋白(Laminin)阳性,而电子显微镜观察显示与周细胞一致的分化特征。分子检测结果证实存在ACTB::GLI1融合。在中位 24 个月的随访期内,未观察到复发或转移。基于这些发现,研究人员将这组肿瘤归类为血管周细胞肿瘤谱系中的良性肿瘤,并将其命名为“伴t(7;12)易位的周细胞瘤”。随后,出现了更多报告,记录了发生于不同解剖部位的病例,并发现了不同的GLI1融合伴侣基因,部分病例表现出复发和转移。在《WHO头颈部肿瘤分类》第五版中,该肿瘤类型被纳入并更名为GLI1改变的间叶性肿瘤。由于其具有广泛的形态学和免疫组织化学特征,且缺乏明确的分化途径,目前将其归类为分化不确定的肿瘤。本报告首次记录了发生于胸膜的GLI1改变的间叶性肿瘤病例。
TIPS|GLI1改变的间叶性肿瘤

▲摘自Ali RH. GLI1 altered soft tissue tumors. PathologyOutlines.com website. https://www.pathologyoutlines.com/topic/softtissuegli1altered.html. Accessed September 8th, 2025.
-
定义/一般:新兴的、谱系未定的肿瘤类型,由GLI1(神经胶质瘤相关致癌基因同源物1)基因变异定义,具有多变的临床行为、形态学模式和免疫表型特征。

-
基本特征:
①由GLI1基因融合或扩增定义的致病相关肿瘤,最常见的是ACTB::GLI1融合;
②发生于广泛的年龄范围和不同的解剖部位,包括躯干和四肢的软组织、头部和颈部以及各种内脏位置;
③组织学特征为均匀的圆形至上皮样细胞,排列成独特的嵌套模式,周围有明显的血管网络,但也可以看到不同的生长模式;
④呈非特异性免疫特征,频繁表达CD56和S100,SMA表达可变;
⑤通常表现出惰性临床行为,但已有转移潜能相关记录。

-
术语:
①GLI1改变(上皮样)软组织肿瘤或间叶肿瘤;
②伴t(7;12)易位的周细胞瘤;
③独特的嵌套肾盂肿瘤。

-
ICD编码:
尚未分配特定的ICD编码;可能归类为以下类别:
①ICD-10:D48.1-结缔和其他软组织行为不确定的肿瘤;C49.9-未特指的结缔和软组织恶性肿瘤。
②ICD-11:2F7C-结缔或其他软组织行为不确定的肿瘤;2B5F.2-未分类的其他特定部位肉瘤。

病 例
患者女,34 岁,因 1 年多前体检发现胸膜结节,于 2023 年 9 月 17 日入住浙江大学医学院附属第四医院胸外科。住院期间,胸部CT扫描显示左胸膜有一边界清晰的结节,长径约 22 mm,考虑为胸膜来源(图1A)。排除手术禁忌证后,于 2023 年 9 月 22 日行左胸膜结节切除术。病理检查显示,结节状肿物大小为25×18×15mm,呈实性囊性,灰红色。显微镜观察可见肿瘤边界清晰(图1B),纤维囊壁组织及实性区域呈巢状(图1C)、网状(图1D)及结节状结构。肿瘤细胞由形态单一的卵圆至圆形、隐约呈上皮样的细胞(图1E)以及少量梭形细胞(图1F)组成。细胞质呈淡嗜酸性至透明。细胞核呈圆至卵圆形,染色质细腻,核仁不明显或小,偶见核分裂象(<1/2 mm²)。肿瘤细胞间可见发达的分支状毛细血管网,未检测到明显坏死。免疫组织化学染色结果显示,CD56弥漫阳性(图1G),S-100(图1H)和SMA局灶阳性,而AE1/AE3、突触素(Synaptophysin)、嗜铬粒蛋白A(Chromogranin A)、CD34、结蛋白(Desmin)、钙视网膜蛋白(Calretinin)、WT-1及甲状腺转录因子1(TTF1)均为阴性。Ki-67标记指数约为 2%。荧光原位杂交(FISH)分析显示GLI1基因断裂信号,提示GLI1重排阳性,主要表现为单个绿色异常信号(图1I);60%的细胞中存在异常GLI1信号。靶向RNA测序显示存在PTCH1-GLI1融合(图2)。本病例中鉴定的融合由PTCH1第1外显子的3′端(5′非翻译区)与GLI1第5外显子的5′端组成,保留了GLI1的FOXP卷曲螺旋结构域(FOXP-CC)以及DNA结合锌指结构域(C2H2锌指)。上述形态学及分子学特征支持GLI1改变(PTCH1-GLI1融合)间叶性肿瘤的诊断。15 个月随访期间,患者未出现复发及转移。
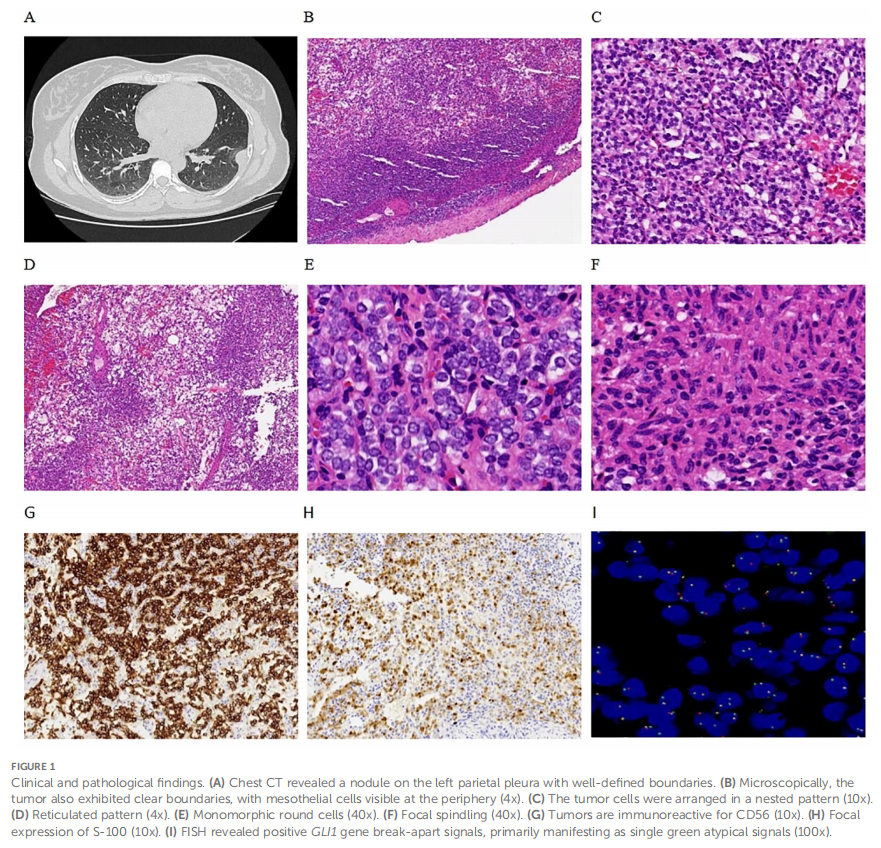
▲图1 临床及病理学结果
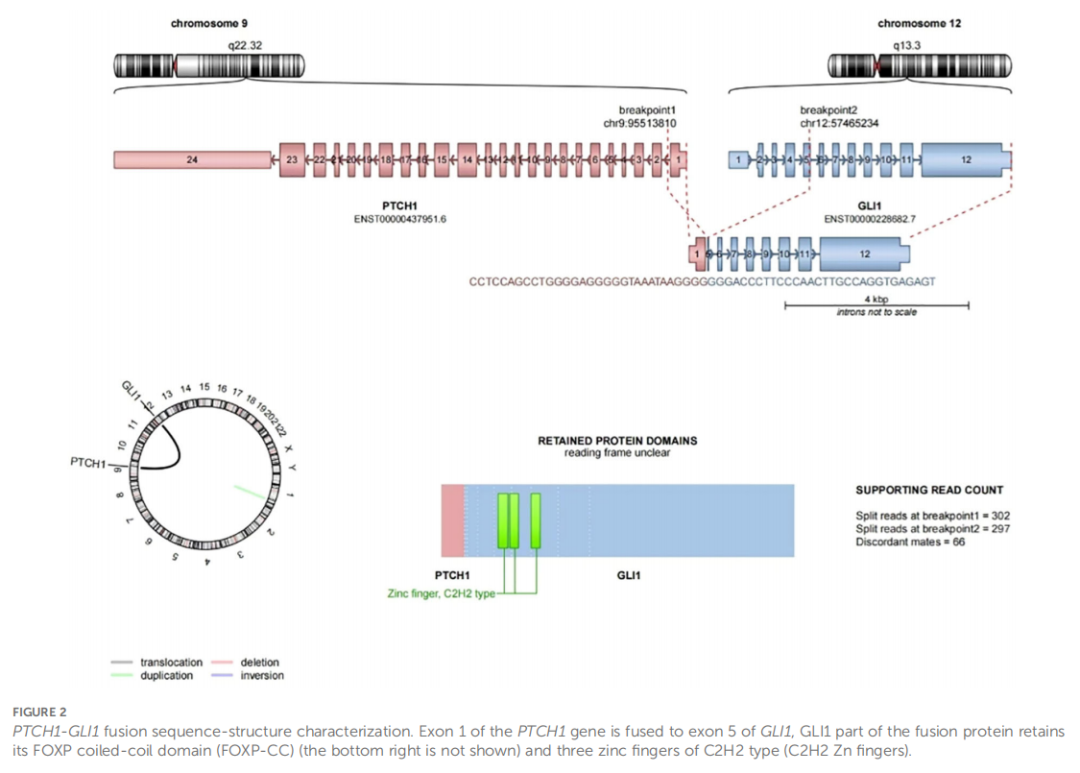
▲图2 PTCH1-GLI1融合序列及结构
讨 论
GLI1改变的间叶性肿瘤是一类罕见的肿瘤,截至目前英文文献中仅记录 90 例。这些肿瘤主要累及中青年成人,中位发病年龄为 40 岁,无明显性别倾向。约 33%(30/90 例)的病变发生于头颈部区域,其次为四肢,尤其是大腿,这与既往研究基本一致。较罕见部位包括胃、肠、卵巢、子宫、肺、肾及骨。本报告中,我们首次报告发生于胸膜的GLI1改变的间叶性肿瘤病例。这些肿瘤的临床表现因部位而异,大多数病例表现为缓慢无痛性生长。
GLI1改变的间叶性肿瘤表现出复杂多变的形态结构和细胞学特征。这些肿瘤通常表现为分叶状结构,肿瘤细胞呈片状、巢状排列,偶尔呈筛状、网状、微囊状、假腺样、乳头状及束状结构。细胞形态相对一致,主要为上皮样、圆形、卵圆形或梭形。细胞质可呈嗜酸性或透明,细胞核呈圆形,染色质细腻,核仁小而点状。在某些情况下,可见高级别形态,其特征为多形性梭形细胞和局灶上皮样细胞。核分裂象数量为 0–5 个/mm²,少数病例可高达 40 个/10 个高倍视野(HPF)。肿瘤细胞突入血管腔是常见现象。此外,间质内可见丰富的分支状血管网,某些病例中可见间叶性黏液变性或玻璃样变性。也有罕见坏死病例的报道。本病例表现出典型的组织学结构、细胞特征及间质内丰富的分支状血管网。GLI1改变的间叶性肿瘤表现出非特异性免疫组织化学特征。大多数病例表达CD56,S-100表达不一,部分病例还表达SMA、AE1/AE3、CD10、细胞周期蛋白D1(cyclin D1)及BCOR。在GLI1扩增的病例中,也可检测到MDM2、CDK4及STAT6的表达。其他标志物如CD34、ERG、突触素(Synaptophysin)、嗜铬粒蛋白A(Chromogranin A)、结蛋白(desmin)、钙调蛋白(calponin)及SOX10均为阴性。本病例中CD56、S-100及SMA阳性与既往研究结果一致。值得注意的是,其免疫组织化学表型缺乏特异性;因此,依赖这些相对非特异性标志物的阳性免疫反应可能导致误诊。Parrak等人报道,GLI1免疫组织化学表达对诊断GLI1改变的间叶性肿瘤的敏感性为 91%,特异性为 98%。GLI1表达定位于细胞质和细胞核,或可仅局限于细胞核。在缺乏GLI1分子检测的情况下,GLI1免疫组织化学可作为有价值的诊断辅助手段,有助于鉴别GLI1改变的间叶性肿瘤。
与GLI1改变的间叶性肿瘤相关的分子事件包括GLI1基因融合和扩增。76%(68/90 例)为融合型,其中 1 例同时存在扩增和融合;但具体融合位点尚不清楚。其余 3 例通过FISH检测到GLI1融合,但融合伴侣未明确。值得注意的是,66%(42/64 例)已明确的融合伴侣为ACTB,其次为MALAT1、PTCH1,以及APOD、DERA、SYT、NCOR2、PAMR1、DDIT3、KDM2B和TUBAIA等较罕见的伴侣。偶尔,GLI1也可同时与两个基因融合。这些不同的融合基因均保留了位于GLI1基因3’端的FOXP卷曲螺旋结构域(FOXP-CC)和DNA结合锌指结构域。然而,GLI1基因5’端启动子被融合伙伴的高活性启动子取代,导致GLI1表达升高,随后激活下游基因转录,从而促进肿瘤发生发展。值得注意的是,GLI1与不同伙伴基因的融合产生相似的病理形态和免疫组织化学谱。此外,约 26%(23/90 例)存在GLI1基因扩增,常伴有位于12q13-15位点附近基因的共扩增,包括DDIT3、CDK4、MDM2、STAT6及HMGA2。这种扩增可导致相应蛋白的过表达,可通过免疫组织化学方法检测到。本病例通过FISH技术成功检测到GLI1基因断裂信号。NGS显示PTCH1-GLI1融合,结合形态学一致指向GLI1改变的间叶性肿瘤。
手术是GLI1改变的间叶性肿瘤的主要治疗方法,而sonic hedgehog信号通路抑制剂可能为表现出GLI1激活的肿瘤提供潜在的靶向治疗。大多数GLI1改变的间叶性肿瘤在完整手术切除后表现为惰性临床进程。本病例中,患者术后 15 个月病情稳定。由于病例数有限,《WHO头颈部肿瘤分类》第五版未对其生物学行为提供明确说明,也无相关ICD编码。研究人员汇总了英文文献中关于发生复发和转移的GLI1改变的间叶性肿瘤病例数据(表1)。
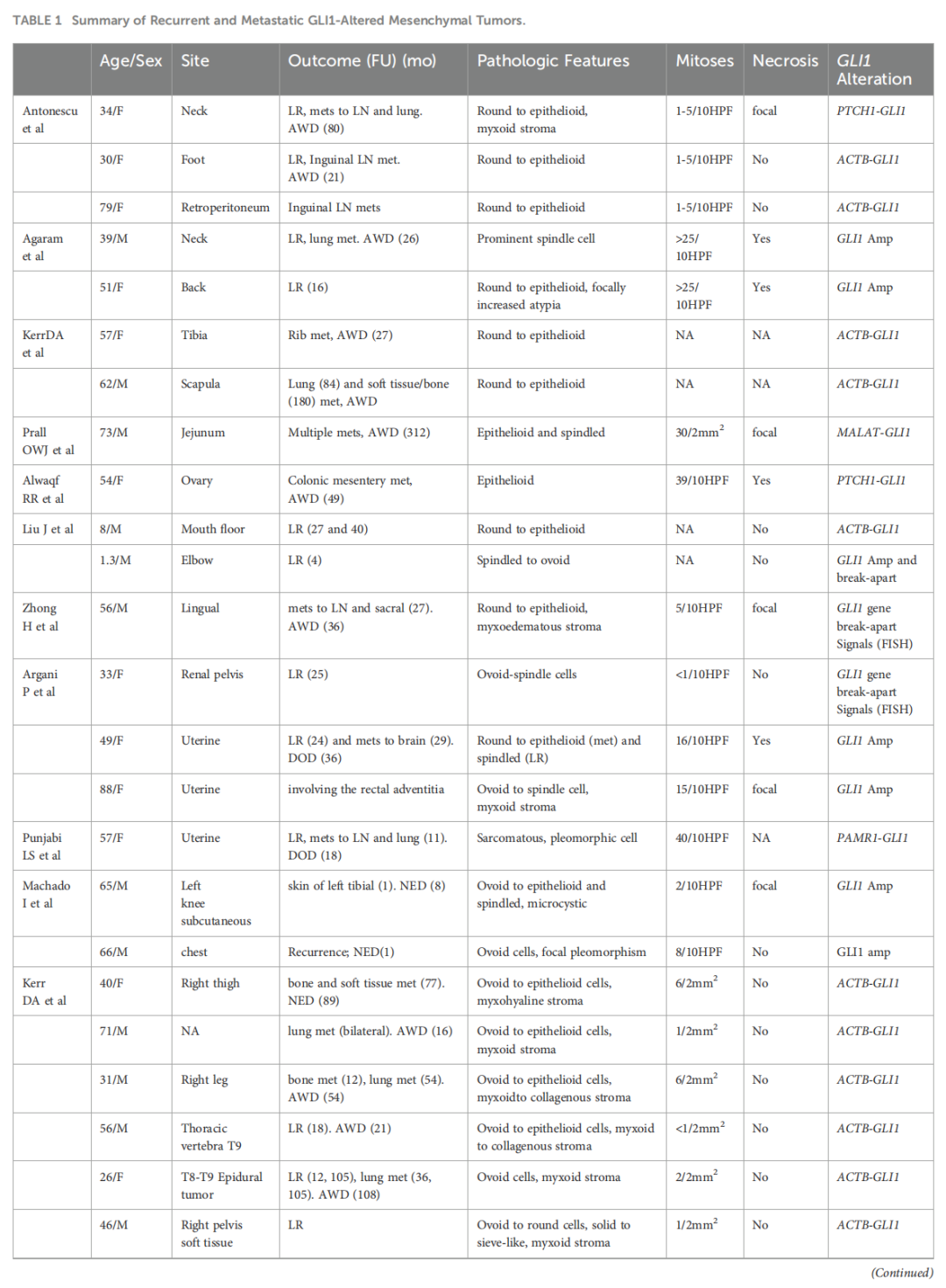
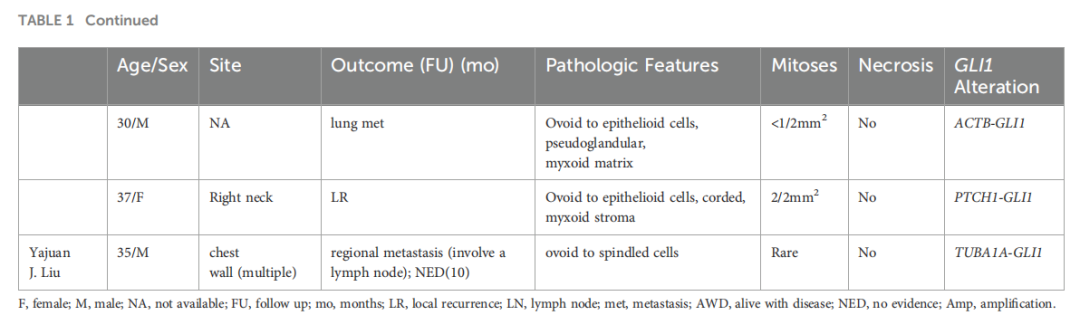
▲表1 复发性和转移性GLI1改变间叶肿瘤汇总
在 64 例有随访数据的患者队列中,42%(27/64 例)发生复发和转移。其中,20%(13/64 例)表现为局部复发,30%(19/64 例)发生远处转移。值得注意的是,在远处转移患者中,47%(9/19 例)发生肺转移,包括2例双侧肺转移。软组织肿瘤通常通过血行转移,而肺脏因其丰富的毛细血管床,为循环肿瘤细胞滞留提供了有利环境。此外,肺内成纤维细胞可能通过重塑局部免疫微环境,促进这些循环肿瘤细胞的外渗和定植。GLI1改变的间叶性肿瘤以肿瘤细胞突入血管腔为特征,这与上述因素共同显著促成了其肺转移倾向。此外,这些肿瘤还可转移至淋巴结、骨、肝、脑、肠及多个软组织部位。复发转移的平均年龄为 47 岁,男女之间无显著差异。约 80%(20/25 例)的原发肿瘤位于头颈部区域外,2 例远处转移患者的原发部位无法确定。显微镜下,肿瘤细胞主要为卵圆至上皮样,呈巢状排列,伴间质黏液变性,核分裂象数量不等。在有预后信息的患者中,12 例核分裂象 >5/10 个高倍视野(HPF),其中 83%(10/12 例)发生复发转移。在 15 例肿瘤内存在坏死的患者中,高达 67%(10/15 例)发生复发转移。分子水平上,研究人员观察到 50%(3/6 例)的PTCH1-GLI1融合肿瘤发生复发转移,其余2例随访时间不足4个月,不足以可靠评估预后。在复发转移病例中,1 例表现为形态温和、核分裂象不明显且无坏死,但仍发生复发。这一发现提示PTCH1-GLI1基因改变可能与不良预后相关。尽管复发转移率高达 42%,但死亡率仅为 3%(2/64 例),两例致死病例均发生于子宫。该肿瘤表现出活跃的核分裂象,1 例呈现高级别肉瘤样组织学形态。这些发现提示该肿瘤具有侵袭性生物学潜能,将其归类为具有恶性潜能的GLI1改变的间叶性肿瘤可能更为恰当。肿瘤位于头颈部区域外、高级别组织学形态、活跃的核分裂象(>5/10 HPF)、坏死及PTCH1-GLI1基因改变均为显著的复发转移危险因素。在这些因素中,高级别组织学形态侵袭性最强,存在该形态提示肿瘤可归类为恶性。此外,有 1 例无上述任何危险因素的患者发生复发。该病例位于头颈部区域外,存在复发转移风险,因此严格的随访观察至关重要。由于随访时间存在差异(部分病例随访时间较短,而另一些病例在复发转移发生前随访超过十年),预后数据的统计分析较为复杂。这种差异可能给数据引入偏倚,从而影响其准确性。为实现更准确的预后评估,更大样本量和更长随访时间是必要的。在本研究中,肿瘤部位和分子改变均被确定为危险因素,后续将进行密切随访。
鉴别诊断包括:①间皮瘤:本病例发生于胸膜,胸部CT提示可能为胸膜来源。经典上皮样间皮瘤以乳头状、小梁状及实性排列为特征,表现出显著的细胞异型性和多形性。免疫组织化学显示间皮标志物阳性,包括钙视网膜蛋白(Calretinin)、WT1及D2-40。②血管球瘤:血管球瘤与GLI1改变的间叶性肿瘤形态学相似,但免疫组织化学弥漫表达SMA和钙调蛋白(Caldesmon),分子改变以NOTCH基因融合为特征。③神经内分泌肿瘤:肿瘤由形态一致的细胞组成,间质血管丰富,易与神经内分泌肿瘤混淆。可通过免疫组织化学鉴别,神经内分泌肿瘤特征性弥漫表达神经内分泌标志物,如CD56、突触素(Synaptophysin)及嗜铬粒蛋白A(Chromogranin A)。④外胚层间叶软骨黏液样肿瘤:该肿瘤通常发生于舌背侧,形态学与以间质黏液变性为特征的GLI1改变的间叶性肿瘤相似。值得注意的是,肿瘤细胞通常表达GFAP和S-100,分子改变为RREB1-MKL2融合。⑤其他GLI1基因改变的肿瘤包括胃母细胞瘤、胃丛状纤维黏液瘤及脂肪肉瘤,每种肿瘤均具有独特的形态学和组织化学特征。
结 论
GLI1改变的间叶性肿瘤是一类罕见肿瘤,具有独特的形态学和分子特征,主要见于头颈部,但也可发生于其他解剖部位。这些肿瘤与显著的复发和转移风险相关;即使是具有良性细胞特征的肿瘤也可能表现出转移行为,尤其是转移至肺部。复发和转移的关键危险因素包括肿瘤位于头颈部外、高级别组织学形态、活跃的核分裂象(>5/10 个高倍视野)、坏死以及PTCH1-GLI1基因融合。值得注意的是,高级别组织学形态与这些肿瘤的最高侵袭性行为相关。因此,它们具有显著的恶性潜能,有时可能表现出恶性生物学特征。鉴于此,密切随访至关重要,准确诊断和持续监测这些肿瘤极为重要。
骨与软组织肿瘤DNA1308+RNA1560基因检测、骨与软组织肿瘤DNA272+RNA1560基因检测、骨与软组织肿瘤DNA160+RNA1560基因检测(NGS方法学)项目,可从RNA层面检测PICH1-GLI1、ACTB-GLI1等GLI1融合在内超过1560种已知和未知融合变异,还可从DNA层面检测GLI1相关变异(CDS),预测可能获益的靶向、免疫、化疗等治疗方案,同时辅助分子分型、预后和遗传评估。此外,GLI1(12q13.3)重排(FISH方法学)也可辅助临床诊疗。
参考文献:
Zhong Y, Li B, Wang G, Liu Y, Chen Z. GLI1-altered mesenchymal tumor involving the parietal pleura: case report and literature review. Front Oncol. 2025 Feb 10;15:1484206. doi: 10.3389/fonc.2025.1484206. PMID: 39995845; PMCID: PMC11847683.


