独家揭秘!安徽中医药大学发布:桔梗多糖14周逆转脂肪肝,不节食不运动,肠道菌群一键切换“易瘦模式”!
时间:2025-08-31 12:13:40 热度:37.1℃ 作者:网络
肥胖已成为全球公共卫生领域最棘手的慢性代谢性疾病之一,世界卫生组织预计到2030年全球肥胖人口将突破十亿。高脂膳食结构、久坐生活方式与肠道微生态失衡共同驱动能量过剩与脂质异位沉积,进而诱发胰岛素抵抗、非酒精性脂肪性肝病及动脉粥样硬化等多系统并发症。传统化药如奥利司他、西布曲明等虽能短期减重,却伴随肝损伤、心血管事件等严重不良反应,长期应用受限。中医药历来重视“脾主运化”与“肠腑传化”理论,认为肥胖属“膏浊内阻”,治宜健脾化湿、通腑泄浊。
桔梗 Platycodonis Radix(PR)是药食同源之品,《神农本草经》谓其“主胸胁痛如刀刺,腹满肠鸣幽幽”,现代研究证实其富含多糖、皂苷、黄酮等活性成分,具有降血脂、抗炎、抗氧化等作用。然而,桔梗多糖通过“肠-肝轴”干预肥胖的具体机制尚未阐明。
安徽中医药大学张祥伟、桂双英团队从桔梗中分离得到PG1、PG2两种多糖组分,借助高脂饮食(HFD)诱导的C57BL/6小鼠模型,系统评价其抗肥胖效应,并首次揭示PG1可通过重塑肠道菌群、激活SCFA-GPR信号、抑制BA-FXR-FGF15通路等多重途径,发挥减重、调脂、保肝、抗炎的综合作用,为中药多糖防治肥胖提供了坚实的循证依据。

图1 论文首图
PG对高脂饮食小鼠体重及组织病理变化的影响
研究采用4.7 kcal/g高脂饲料喂养雄性C57BL/6小鼠90天,成功复制饮食性肥胖模型。与正常对照组相比,模型组小鼠平均体重升高32.4%,肝脏呈现显著大泡性脂肪变、肝索紊乱及炎性浸润,附睾脂肪细胞体积增大2.1倍,结肠隐窝深度变浅、杯状细胞减少,提示肠屏障功能受损。PG1高剂量组(0.4 g/kg)干预后,小鼠体重增长曲线在第4周即开始低于模型组,第13周体重较模型组下降18.9%,与阳性对照辛伐他汀(20 mg/kg)效果相当;肝脏HE染色显示肝细胞脂肪空泡明显减少,肝板排列趋于整齐;附睾脂肪细胞面积缩小至接近正常水平;结肠组织PAS染色可见杯状细胞数量回升、隐窝深度增加,提示PG1能有效逆转高脂饮食诱导的体重增加及多组织病理损伤。PG2虽也有一定改善,但效果弱于PG1,提示不同分子量及单糖组成的多糖活性存在差异。
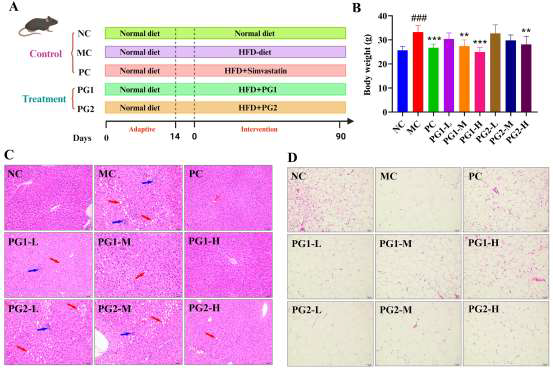
图2 PG对高脂饮食小鼠体重及组织病理变化的影响
PG对高脂饮食小鼠脂质代谢、肝功能及炎症的影响
模型组小鼠血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)分别升高61.2%、58.7%、72.4%,高密度脂蛋白胆固醇(HDL-C)下降31.5%,ALT、AST活性显著升高,呈现典型脂质代谢紊乱与肝细胞损伤。高剂量PG1干预后,TC、TG、LDL-C分别下降29.8%、33.6%、38.2%,HDL-C回升24.7%,ALT、AST分别下降44.5%、39.7%,提示PG1能显著改善血脂谱并保护肝细胞。与此同时,模型组促炎因子TNF-α、IL-1β、IL-6及血清LPS水平分别升高2.6、3.4、2.8、4.1倍,显示慢性低度炎症状态。PG1剂量依赖性降低上述炎症指标,高剂量组TNF-α、IL-1β、IL-6降至模型组的62.7%、48.9%、56.3%,LPS水平下降54.1%,表明PG1可通过抑制炎症反应减轻代谢性内毒素血症。
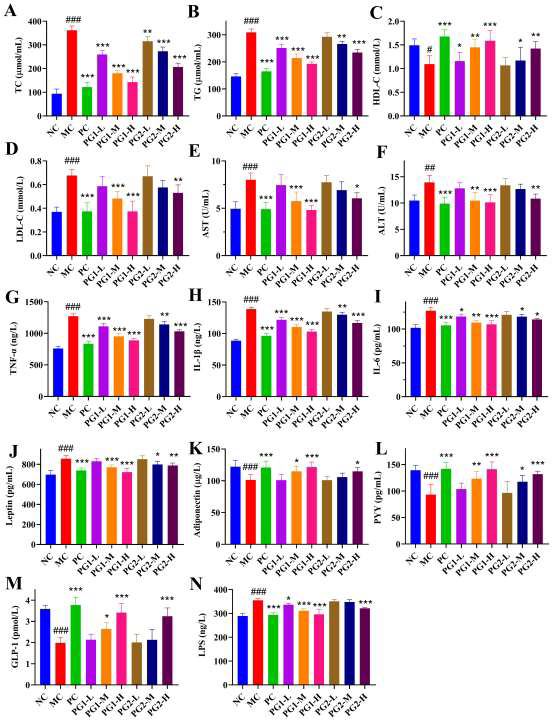
图3 PG对高脂饮食小鼠脂质代谢、肝功能及炎症的影响
PG对高脂饮食小鼠血清激素水平的影响
肥胖常伴随“肠-脂肪-胰岛”内分泌轴失衡,模型组小鼠血清瘦素(Leptin)升高3.2倍,提示瘦素抵抗;饱腹激素PYY、GLP-1及脂联素(Adiponectin)分别下降57.2%、62.8%、45.6%,导致摄食增加、能量消耗减少。PG1高剂量干预后,Leptin降低15.7%,PYY、GLP-1、Adiponectin分别回升51.5%、72.1%、19.8%,部分恢复激素平衡。PG1通过上调GPR41/43表达、促进SCFA信号转导,刺激肠道L细胞分泌PYY与GLP-1,抑制脂肪组织瘦素过度分泌,改善胰岛素敏感性与能量代谢。PG对高脂饮食小鼠SCFAs浓度、相关感受介质基因表达及BAs浓度的影响。短链脂肪酸(SCFAs)是肠道菌群发酵多糖产生的关键代谢产物,模型组小鼠盲肠内容物中乙酸、丙酸、丁酸总量下降46.3%,GPR41、GPR43 mRNA表达分别下调62.8%、58.9%。高剂量PG1显著增加总SCFAs含量,其中乙酸、丙酸、丁酸分别升高2.1、2.5、2.8倍,GPR41、GPR43表达恢复至接近正常水平,提示PG1通过促进SCFA产生及受体表达介导代谢获益。胆汁酸(BAs)方面,模型组初级BAs(CA、CDCA)升高,次级BAs(DCA、LCA)降低,提示BA代谢紊乱。PG1处理后,初级BAs下降36.7%,次级BAs升高1.9倍,表明PG1能增强菌群介导的7α-脱羟基化反应,促进初级BA向次级BA转化,从而加速胆固醇排泄。
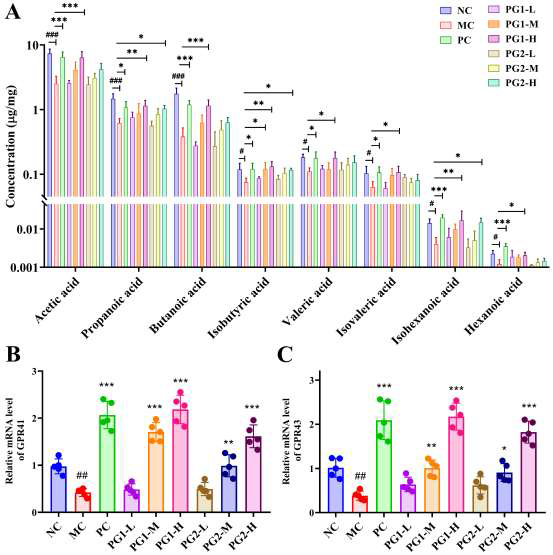
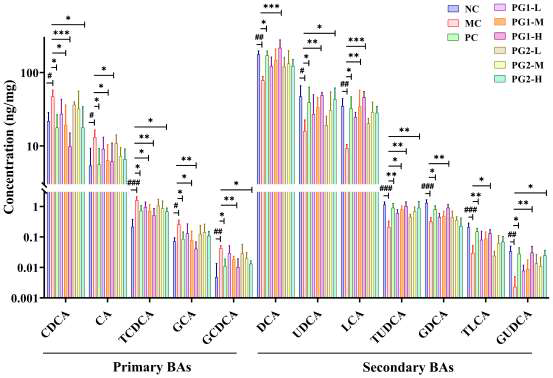
图4 PG对高脂饮食小鼠血清激素水平的影响
PG对高脂饮食小鼠肠道菌群的影响
16S rRNA测序显示,模型组Firmicutes/Bacteroidetes比值升高2.3倍,Akkermansia muciniphila、Muribaculaceae、Lachnospiraceae_NK4A136、Eubermium coprostanoligenes等有益菌丰度降低,而Helicobacter、Allobaculum、Romboutsia等潜在致病菌增多。PG1高剂量干预后,F/B比值恢复至接近正常,Akkermansia丰度增加5.2倍,Muribaculaceae、Lachnospiraceae_NK4A136、Eubermium coprostanoligenes分别增加3.7、4.4、3.2倍,Helicobacter等致病菌丰度下降60%以上。PCoA分析显示PG1组菌群结构明显向正常对照组靠拢,说明PG1能有效逆转高脂饮食导致的菌群失衡,重建有益共生网络。
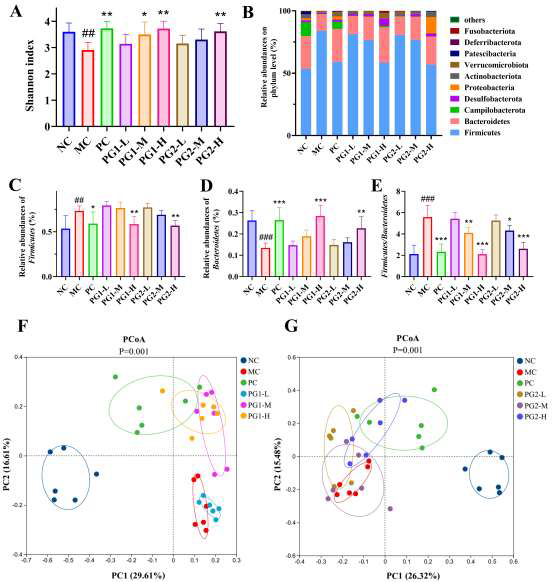
图5 PG对高脂饮食小鼠肠道菌群的影响
肠道菌群与SCFAs代谢及BAs代谢的相关性分析
Spearman相关性分析表明,Eubacterium coprostanoligenes、Lachnospiraceae_NK4A136、Muribaculaceae与乙酸、丙酸、丁酸水平呈显著正相关(r>0.7,P<0.01),而Allobaculum、Romboutsia、Clostridium sensu stricto 1与SCFAs呈负相关。次级BAs(DCA、LCA)与Eubacterium coprostanoligenes、Lachnospiraceae_NK4A136丰度正相关,与初级BAs及Clostridium sensu stricto 1等负相关,提示特定菌群通过调节BA去结合及7α-脱羟基化反应影响BA谱。结果进一步证实PG1通过选择性富集SCFA及次级BA产生菌,协同发挥降脂减重作用。
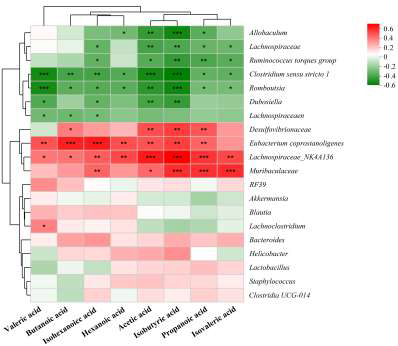
图6 肠道菌群与SCFAs代谢及BAs代谢的相关性分析
PG对LPS水平及肠道完整性相关基因和蛋白表达的影响
模型组血清LPS升高4.1倍,结肠组织紧密连接蛋白ZO-1、Occludin、Claudin-1 mRNA及蛋白表达显著下调,提示肠屏障破坏、内毒素易位。PG1高剂量干预后,LPS下降54.1%,ZO-1、Occludin、Claudin-1 mRNA分别上调2.1、1.9、2.3倍,蛋白表达恢复至接近正常水平,结肠杯状细胞数量增加,隐窝深度加深,表明PG1可通过上调紧密连接蛋白表达、增强黏液层厚度,修复肠屏障,减少LPS入血,缓解低度炎症。
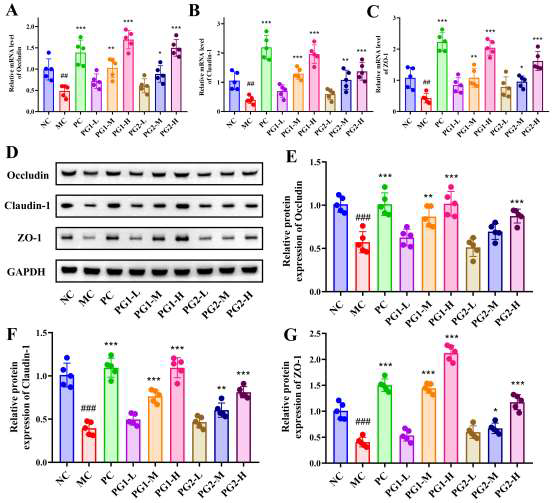
图7 PG对LPS水平及肠道完整性相关基因和蛋白表达的影响
PG对调控胆汁酸代谢相关基因和蛋白表达的影响
高脂饮食激活回肠FXR-FGF15信号,模型组回肠FXR、FGF15 mRNA升高2.3、2.7倍,肝脏FGFR4表达上调,而CYP7A1表达下调60.2%,抑制胆固醇向胆汁酸转化。PG1处理后,回肠FXR、FGF15 mRNA分别下降37.8%、42.1%,FXR核转位减少,FGF15蛋白表达降低;肝脏FGFR4蛋白下降33.5%,CYP7A1表达上调2.4倍,促进胆固醇7α-羟化酶活性,加速BA合成与胆固醇清除。结果提示PG1通过抑制肠道FXR-FGF15信号、解除其对肝脏CYP7A1的抑制,增强胆固醇-胆汁酸代谢通路,发挥降脂效应。
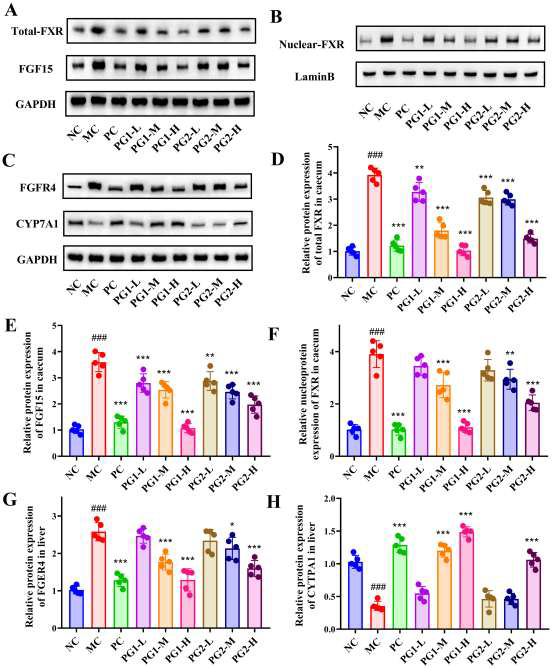
图8 PG对LPS水平及肠道完整性相关基因和蛋白表达的影响
小结
综上所述,桔梗多糖PG1通过“肠-菌-肝”轴多靶点干预肥胖:一方面重塑菌群结构,富集SCFA及次级BA产生菌,激活GPR信号、抑制FXR-FGF15通路;另一方面修复肠屏障,降低LPS及炎症因子,恢复激素平衡,改善脂质代谢。该研究为中药多糖干预肥胖提供了创新机制阐释,也为临床运用桔梗或含桔梗复方治疗代谢综合征提供了科学依据。
参考文献:
Zhi N, Chang X, Zha L, Zhang K, Wang J, Gui S. Platycodonis radix polysaccharides suppress progression of high-fat-induced obesity through modulation of intestinal microbiota and metabolites. Phytomedicine. 2025 Jul;142:156653. doi: 10.1016/j.phymed.2025.156653. Epub 2025 Mar 16. PMID: 40354675.


