【Genes Dis】体内CAR-T的进展与挑战
时间:2025-08-31 12:14:28 热度:37.1℃ 作者:网络
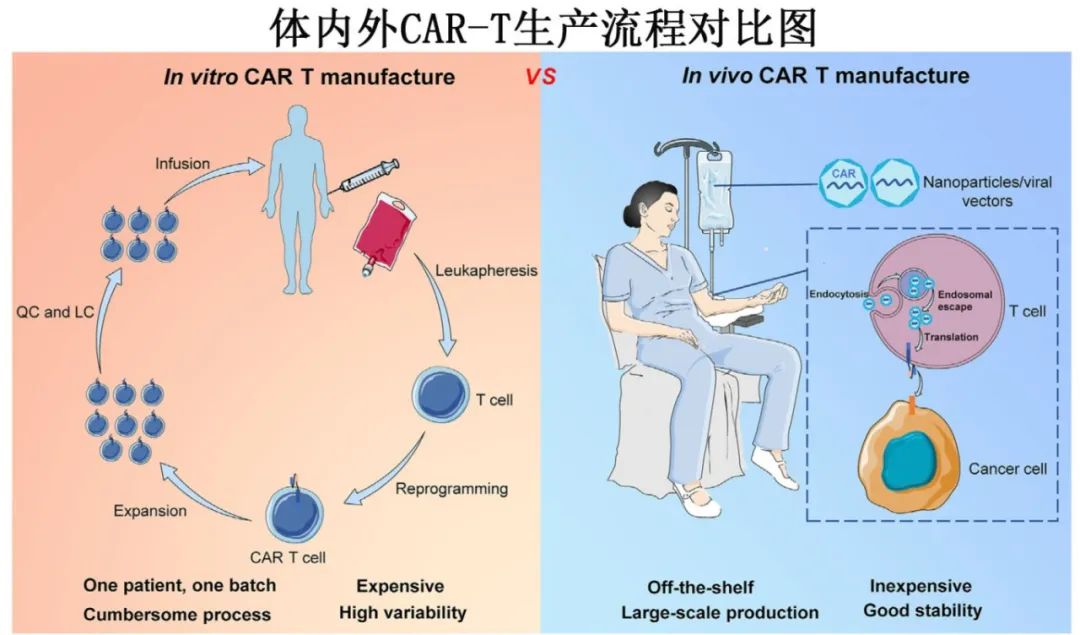
嵌合抗原受体T细胞(CAR-T)疗法在血液恶性肿瘤治疗中取得了显著疗效。然而,传统的体外病毒载体介导的CAR-T细胞生产流程耗时、昂贵,且可能损害T细胞功能。体内生产CAR-T细胞是一种新方法,可以避免复杂的生产过程,通过大规模生产降低成本,并且相比体外生产更能保护T细胞功能。临床前研究已证明体内CAR-T疗法在血液恶性肿瘤模型中具有良好的抗肿瘤活性。
《Genes & Diseases》近日发表综述,描述了体内CAR-T细胞疗法的最新进展,并讨论了其临床应用的潜在挑战。

传统体外CAR-T的挑战
高成本: 个性化定制(“一患者,一批次”)导致费用高昂。
耗时长: 从细胞采集到回输通常需要2-3周,可能不适合疾病快速进展的患者(这部分需要桥接治疗)。
流程复杂: 涉及白细胞分离、激活、基因修饰、扩增、冷冻、质控等多个步骤,可变性高。
T细胞功能受损: 体外培养和激活过程可能导致T细胞耗竭。
需要清淋化疗: 输注前需要进行淋巴清除化疗,会增加感染等风险。
体内CAR-T的机遇
“现货型”产品 (Off-the-shelf): 像常规药物一样可随时使用,无需等待。
可行性: 纳米颗粒等载体已有成熟的GMP生产平台,可实现大规模、低成本生产。纳米药物价格相对低廉,且稳定性好。
保留T细胞功能: T细胞在体内生理环境中被改造,避免了体外培养的压力和耗竭。
可能无需清淋化疗: 体内改造的T细胞处于生理环境,可能不需要强力的清淋预处理。
主动靶向与持续作用: 相比需要重复给药的双特异性抗体(如贝林妥欧单抗),体内产生的CAR-T细胞可以主动靶向肿瘤、自我扩增并持续杀伤。
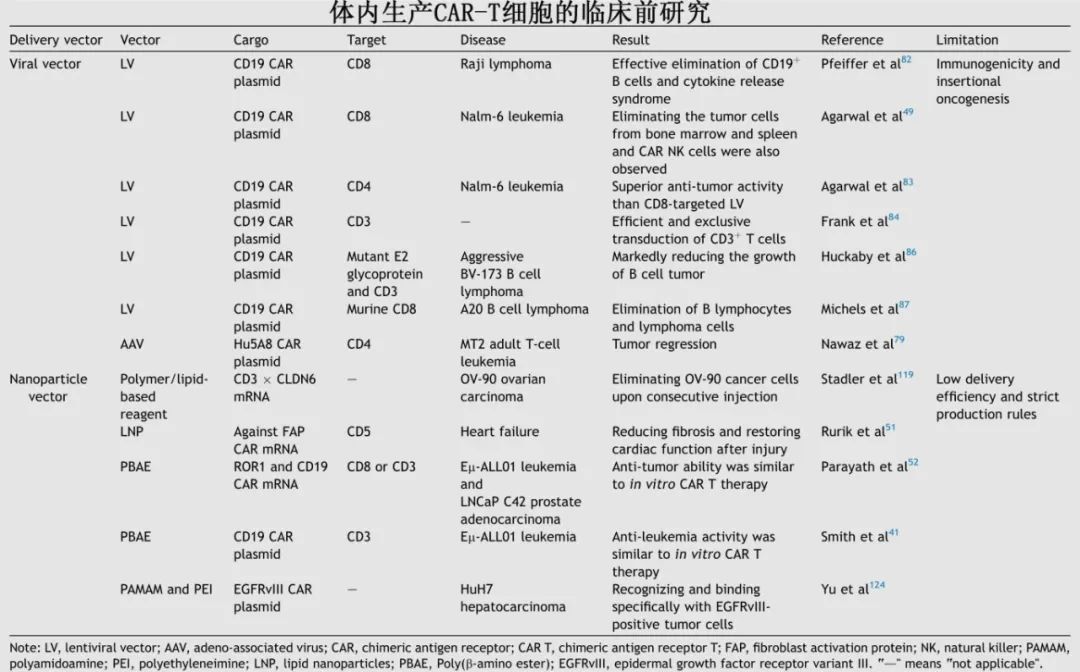
体内生产技术
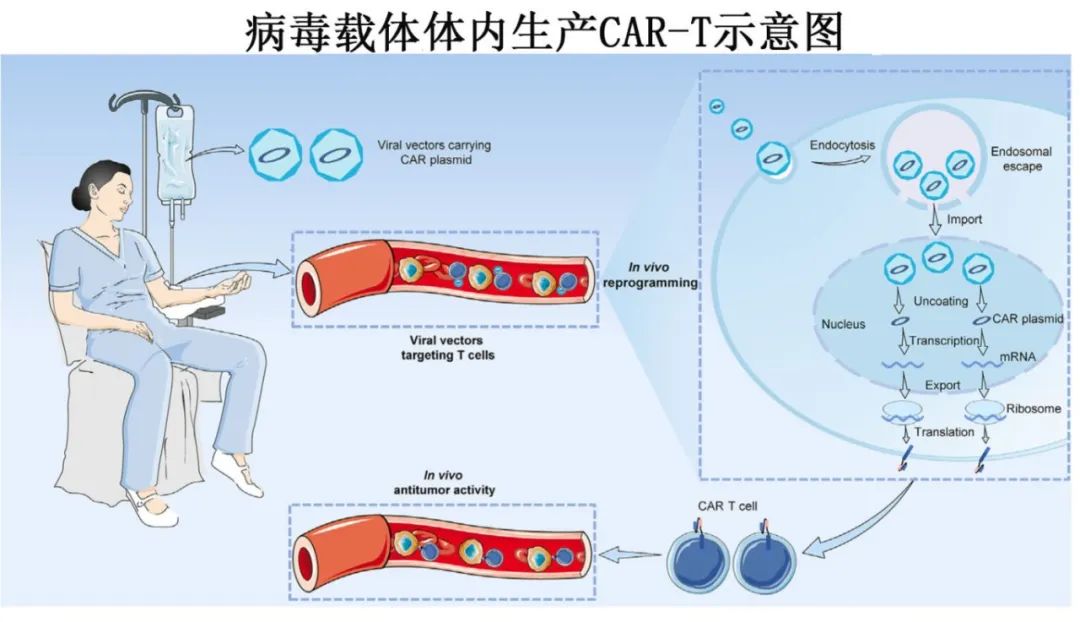
病毒载体
慢病毒 (LV): 转染效率高,可以稳定地将基因插入分裂和非分裂细胞,携带容量大(~10 kb)。研究已成功使用靶向CD3、CD4、CD8的LV在体内生成抗CD19、抗CD20等的CAR-T细胞,并在小鼠模型中显示出抗肿瘤效果。挑战包括插入突变风险、免疫原性、靶向特异性(脱靶效应)和高成本。
腺相关病毒 (AAV): 安全性较好,免疫原性相对较低,因其低整合率和非致病性而被广泛使用。已用于体内生产抗CD4 CAR-T治疗T细胞白血病。挑战包括包装容量有限(~4.4 kb)和仍存在的免疫原性。
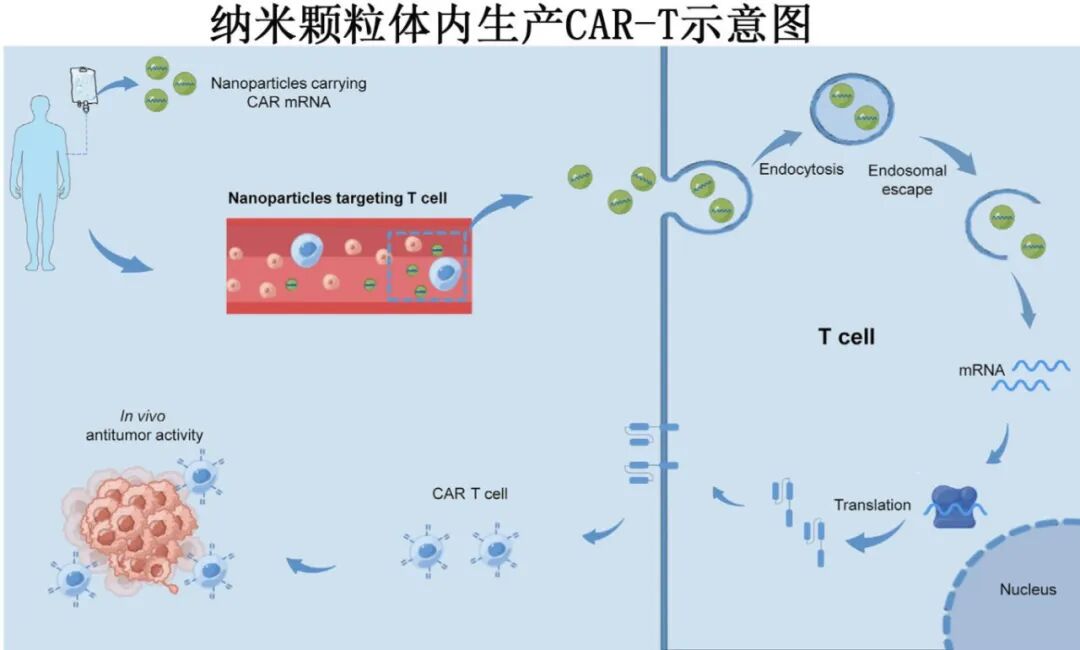
非病毒载体 (主要为纳米颗粒)
瞬时转染 (mRNA): 通过靶向性纳米颗粒(如脂质纳米颗粒LNP, PBAE聚合物)递送CAR mRNA。优点是无基因组整合风险、表达快速。但表达时间短(约7天),需要重复给药才能维持疗效。已用于治疗心脏纤维化、白血病、前列腺癌等模型。
持久转染 (DNA): 通过纳米颗粒递送CAR DNA,并利用转座子系统(如睡美人、PiggyBac)或S/MARs( scaffold/matrix attachment regions)元件实现基因组整合或染色体外持久表达。可避免重复给药。挑战是转染效率通常低于病毒载体,且生产过程需要严格控制以确保批次间稳定性。
其他技术: 电穿孔、工程化蛋白(如Cas9 RNP复合物)等,但也各有其局限(如操作难度、免疫原性)。
挑战与局限性
安全性: 病毒载体的插入突变风险;非病毒载体的潜在毒性(如阳离子脂质);基因编辑技术(如CRISPR/Cas9)可能导致的非预期基因变异(大片段缺失、复杂重排)。
效率: 非病毒载体的转染效率(尤其是进入细胞核的效率)通常低于病毒载体。低效率可能导致需要重复给药或细胞数量不足。
靶向性与脱靶效应: 确保载体精准靶向T细胞而非其他细胞类型至关重要,否则可能导致毒性或疗效下降。
免疫原性: 针对病毒载体外壳或外源蛋白(如Cas9)的免疫反应可能降低转染效率、清除转导细胞或影响载体稳定性。
生产成本与监管: 病毒载体的生产成本和监管要求仍然很高。纳米颗粒的大规模生产需要严格的质控。
未来展望与策略
靶向整合: 使用CRISPR等基因编辑技术将CAR基因精准插入基因组的特定位点(如TRAC, PD-1 locus),以提高安全性和有效性。
非整合DNA载体: 利用S/MARs等元件实现CAR基因的染色体外持久表达,完全避免插入突变风险。
联合策略: 将体内CAR-T与其他技术结合,如光热疗法、光穿孔技术提高转染效率、改造CAR-T细胞(如敲除GM-CSF以减少细胞因子释放综合征CRS)等。
其他CAR免疫细胞: 探索体内生成CAR-NK细胞、CAR-M(巨噬细胞)等,这些细胞在对抗实体瘤方面可能具有独特优势(如更好的浸润性、克服免疫抑制微环境)。
细胞膜包被纳米颗粒: 利用同源靶向和免疫逃逸功能提高递送效率和减少脱靶效应。
总结
体内生产CAR-T细胞疗法因其简化流程、降低成本、“现货”可用等巨大优势而备受关注,有望让更广泛的患者群体受益。尽管在临床前研究中取得了鼓舞人心的成果,但其安全性、转染效率和临床疗效仍需进一步提高。通过开发靶向整合/非整合策略、联合治疗以及探索其他CAR免疫细胞等方法,有望克服当前挑战,推动体内CAR-T疗法走向临床现实。
参考文献
Genes Dis . 2025 Mar 25;12(6):101612. doi: 10.1016/j.gendis.2025.101612.


