近五分之一早发性结直肠癌存在遗传易感变异,且家族史并非基因检测可靠指标
时间:2025-09-12 12:10:37 热度:37.1℃ 作者:网络
早发性结直肠癌(EO-CRC)的发病率呈上升趋势。虽然大多数EO-CRC病例为散发性,但遗传性癌症易感综合征的患病率仍是一个存在争议的话题。此外,传统上与EO-CRC发生不相关的基因很少被纳入胚系检测panel中。研究者收集了在意大利两所大学机构(圣拉斐尔科学研究所IRCCS和尼瓜尔达大都会综合医院)就诊的EO-CRC患者的胚系图谱数据。采用下一代测序和多重连接探针扩增技术进行多基因胚系图谱分析。分析胚系变异与临床病理变量之间的关联。
研究者共筛查了130例EO-CRC患者。EO-CRC诊断时的中位年龄为42岁(范围22-49岁)。在23例(18%)患者中发现了与遗传性癌症易感综合征相关的胚系致病性或可能致病性变异(PVs/LPVs),在47例(36%)患者中发现了意义未明的胚系变异。67例(52%)患者未观察到与癌症易感性相关的高外显率基因变异。微卫星稳定的BRAF突变型(n=5)或印戒细胞型结直肠癌(n=2)患者均未出现胚系PVs/LPVs。与散发性EO-CRC相比,遗传性EO-CRC在临床病理特征上没有显著富集。在2例EO-CRC患者中发现了FLCN和SDHAF2基因的胚系PVs。
虽然大多数EO-CRC病例为散发性,但约五分之一发生于遗传性癌症易感综合征背景下。由于FLCN和SDH目前未被纳入EO-CRC的现行指南中,这些基因中的PVs/LPVs可能被低估。为了更好地理解它们的意义,研究者建议在所有EO-CRC患者中纳入对它们的评估。
-
虽然大多数EO-CRC为散发性,但五分之一发生于遗传性癌症易感综合征背景下;
-
无论结直肠癌家族史如何,FLCN和SDHAF2基因都应添加到EO-CRC的胚系检测panel中;
-
未发现能够区分遗传性与散发性EO-CRC的临床病理特征。
研究背景
结直肠癌(CRC)是全球第三大常见癌症和第三大致命癌症。尽管在总体人群中,CRC的发病率和死亡率呈下降趋势,这在很大程度上归因于广泛筛查活动的日益开展以及在免疫治疗和分子靶向治疗方面取得的显著进展,但自20世纪90年代初以来,50岁以下成年人的发病率却在稳步上升。值得注意的是,35岁以下人群的这一增长速度最为迅猛。尽管当前的筛查建议基于年龄而非生物学原理,但发生在年轻个体中的CRC通常被称为早发性结直肠癌(EO-CRC)。这种流行病学变化在美国尤为明显,EO-CRC已成为20-49岁男性癌症相关死亡的主要原因。在全球范围内,包括欧洲国家,也观察到了类似的趋势。此外,流行病学模型表明,到2030年,约三分之一的新发CRC病例将出现在50岁以下人群中。因此,EO-CRC的增多已成为临床和癌症研究中一个显著的未被满足的需求。
尽管大多数EO-CRC为散发性,但据报道,50岁以下患者中遗传性癌症易感综合征的患病率高于老年CRC患者。事实上,9.0%-26.4%的EO-CRC患者存在潜在的致病性变异,在35岁以下患者中这一比例可能更高。这些遗传性EO-CRC绝大多数发生在林奇综合征(LS)或家族性腺瘤性息肉病(FAP)背景下。然而,除了与LS和FAP相关的基因外,其他基因中的一系列胚系致病性变异(PVs)也可能增加早于预期发生CRC的风险。非LS遗传性易感的患病率在2.3%-26.4%之间。然而,一个关键的未解决问题是,由非LS和非FAP的胚系变异引起的EO-CRC是否具有独特的临床病理特征,从而支持开发针对性和个性化的诊断panel。此外,基于特定的临床病理特征确定一部分可能无需进行胚系基因分析的EO-CRC病例,这一可能性值得进一步研究。事实上,在最近的指南中,研究者建议所有EO-CRC患者都必须进行遗传性癌症综合征的筛查,无论其肿瘤家族史和疾病临床病理特征如何。
研究者开展了一项观察性回顾性研究,旨在回顾在意大利两所机构连续收集的EO-CRC患者队列中进行扩展胚系图谱分析的结果。研究者分析了该队列的临床病理和分子特征,以确定可能的指标,用于完善遗传性癌症综合征的筛查策略,最终旨在改善EO-CRC患者的管理。
研究结果
2018年1月至2025年2月期间,所有在该专科门诊就诊并被诊断为EO-CRC的患者均接受了多基因胚系检测,最终纳入130例连续的EO-CRC患者。患者特征汇总于表1。其中男性69例(53%),女性61例(47%)。诊断时的中位年龄为42岁(范围22-49岁)。尽管大多数患者(119/130,92%)为意大利人,但有11/130(8%)来自其他国家,具体而言,6/11(55%)来自其他欧洲国家,3/11(27%)来自南美洲,其余2/11(18%)来自非洲。
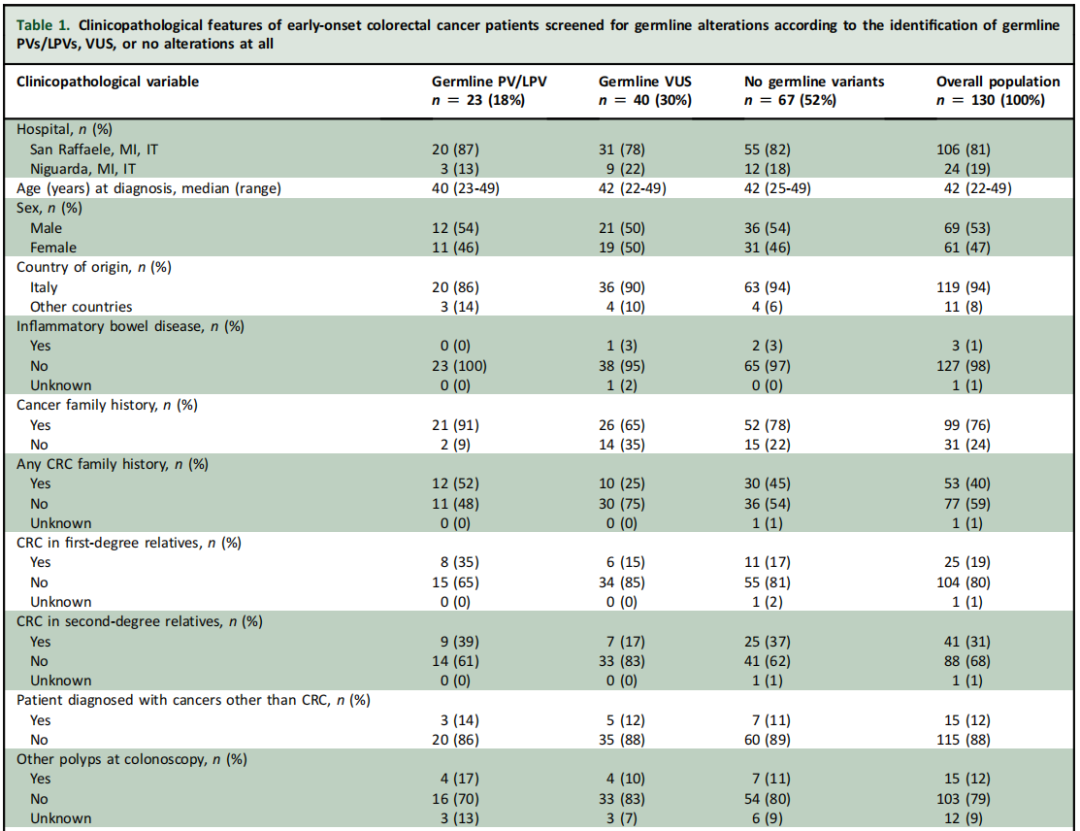
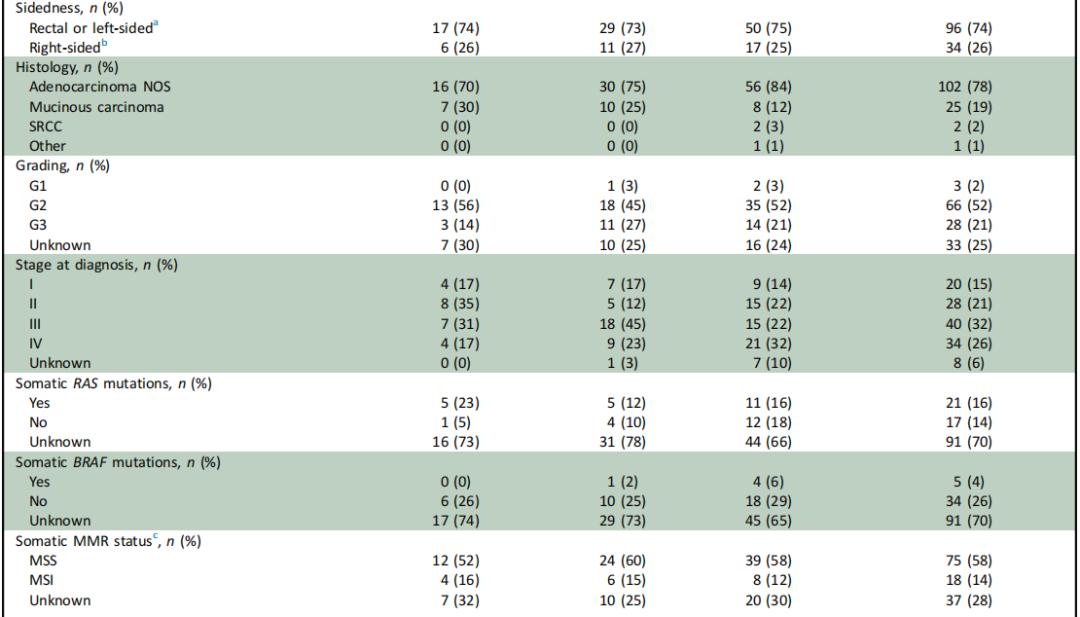
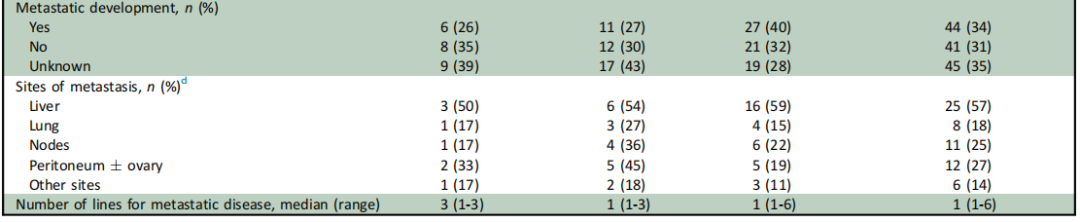
表1
总体而言,本队列观察到的临床病理特征与EO-CRC患者的典型预期特征一致。队列中大多数患者(96/130,74%)的原发肿瘤位于直肠或左半结肠,且相当比例(27/130,21%)表现为黏液性或印戒细胞特征。在发生转移的患者亚组中,12/44(27%)存在腹膜或卵巢受累。最后,99/130(76%)有癌症家族史,25/130(19%)有一级亲属在任何年龄被诊断为CRC,其中12%(3/25)有EO-CRC家族史。
研究者在23例患者中发现了至少1个胚系PV或LPV(18%;图1)。在这23例中,20例(87%)发现至少1个PV,4例(17%)发现至少1个LPV(表2)。此外,130例患者中有47例(36%)发现至少1个意义未明的变异(VUS)(表3),其中40例(30%)仅携带VUS,无任何伴随的PV/LPV。其余67例被诊断为EO-CRC的患者未检测到胚系变异(52%;图1)。在所有至少携带1个PV/LPV的患者中,48%(11/23)存在影响错配修复(MMR)基因的胚系致病性变异。此外,本队列中至少携带1个胚系PV/LPV的EO-CRC患者中,26%(6/23)存在MUTYH基因变异,包括3例纯合子携带者和3例杂合子携带者。在其他与CRC相关的具有临床可干预性的高外显率基因中,5/23(22%)患者的DNA损伤应答(DDR)基因(如ATM、BRCA2(n=2)、BRCA1和CHEK2)中至少存在1个PV/LPV(表2)。2例患者携带2个胚系LPV/PV:1例微卫星稳定(MSS)EO-CRC患者同时存在胚系ATM和CHEK2 PV,另1例微卫星不稳定(MSI)EO-CRC患者同时存在胚系MLH1和MUTYH PV(表2)。
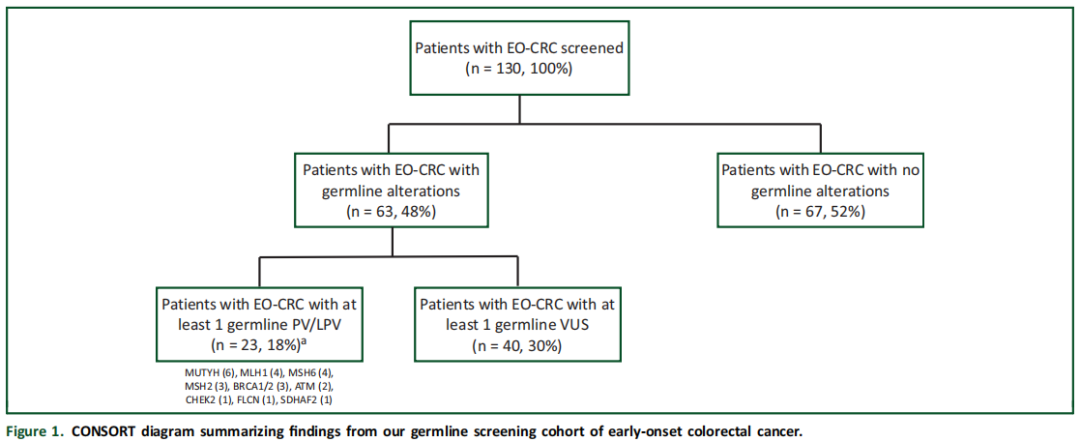
图1
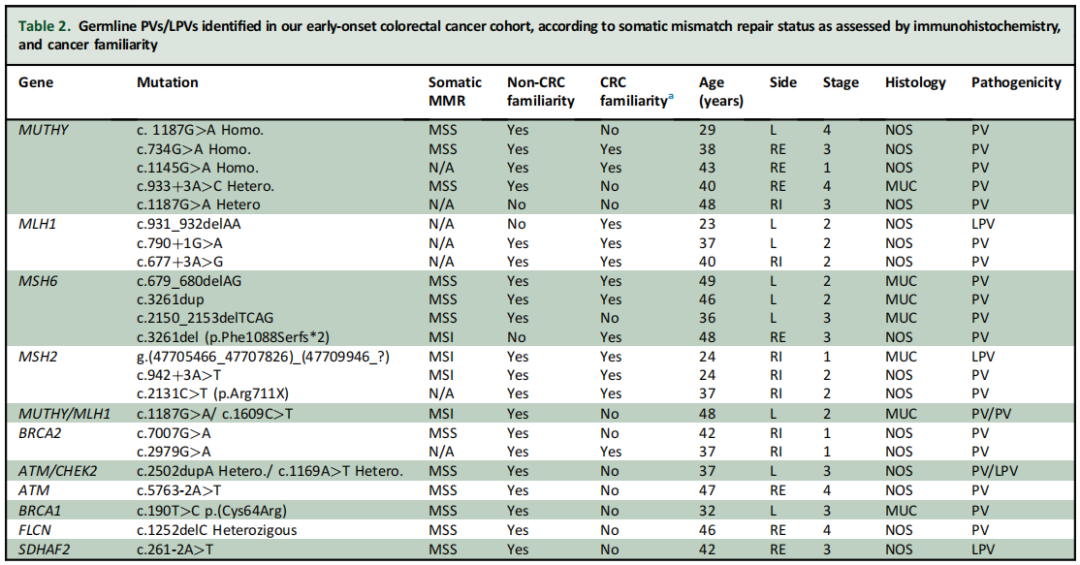
表2
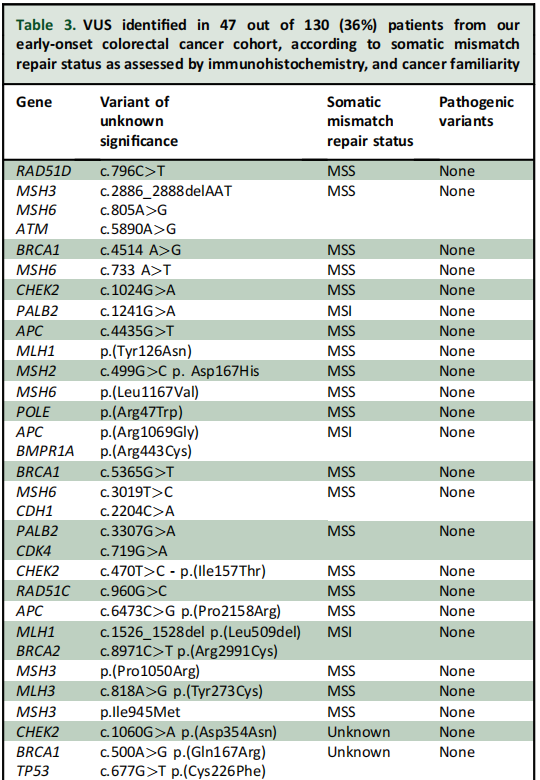
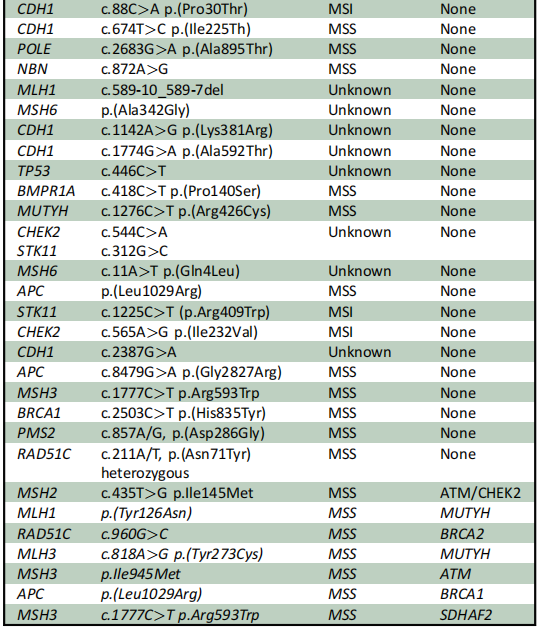
表3
其余2例为在通常与早发CRC发生不相关的基因中检测到罕见胚系PV的患者。1例患者携带FLCN c.1252delC(p.Leu418Trpfs*50)杂合变异,已知该变异可导致Birt-Hogg-Dubé综合征。该患者无CRC家族史,但其一母亲在40岁时被诊断为卵巢癌,62岁时被诊断为头颈部癌(图2)。该患者被诊断为IV期MSS RAS/BRAF野生型直肠癌。循环肿瘤DNA的FoundationOne Liquid CDx下一代测序(NGS)检测到APC R1114*、ARAF S214F、ARID1A Q553fs70、PIK3R1 L570_D578del、FLCN L418fs50和TP53 E286D突变。无实体瘤NGS图谱数据。该患者接受了四线标准治疗,肿瘤逐渐产生耐药性,在初始诊断后27个月死亡。另1例患者存在胚系SDHAF2 c.261-2A>T杂合LPV。SDHAF2胚系PV/LPV可导致遗传性副神经节瘤-嗜铬细胞瘤综合征,但有报道称其可能是EO-CRC的驱动因素。该患者否认有CRC家族史,但父系有1位二级亲属在60岁后被诊断为乳腺癌,另1位二级亲属在80岁时被诊断为卵巢癌;母系有1位二级亲属在62岁时被诊断为脑癌,另1位二级亲属在55岁时被诊断为肛门癌。该患者在42岁时初步被诊断为III期MSS直肠癌。初始诊断后17个月,患者出现局部复发,伴淋巴结和腹膜受累。经过三线转移灶治疗后,肿瘤逐渐产生耐药性,患者在初始诊断后34个月死亡。
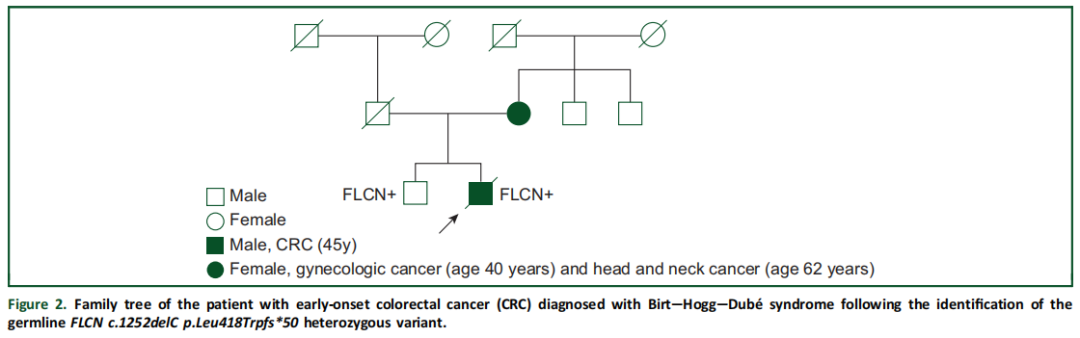
图2
研究者根据PV/LPV和VUS的存在与否分析了临床病理和分子特征,结果汇总于表1。未发现任何临床病理变量与胚系PV/LPV检测可能性增加存在统计学显著关联。CRC家族史不能预测胚系PV/LPV,因为在携带胚系PV/LPV的患者中,仅12/23(52%)报告有任何一级或二级亲属的CRC家族史。在携带胚系PV/LPV的患者中,6例被诊断为转移性EO-CRC,其中5例为RAS突变型,无1例为BRAF突变型。值得注意的是,基于免疫组织化学,研究者在3例因MSH6胚系PV/LPV而被诊断为林奇综合征(LS)的患者中发现了体细胞MSS EO-CRC病例(表2)。此外,尽管绝大多数至少携带1个PV/LPV的患者(21/23,91%)报告有癌症家族史,但在除MSH2、MSH6或MLH1之外的其他基因(即MUTYH、ATM、BRCA1、BRCA2、FLCN、SDHAF2、CHEK2)中携带PV/LPV的患者,其CRC家族史发生率显著更低(3/12,25%;P=0.03)。
在无PV/LPV或VUS的患者中,被诊断为BRAF突变型MSS EO-CRC(n=5;4例为BRAF V600E,1例为BRAF D594D)或MSS印戒细胞癌(SRCC;n=2)的患者均未发现任何胚系PV/LPV。值得注意的是,已知BRAF V600E与LS互斥。然而,由于样本量较小,仍需进一步研究以确定此类体细胞特征的存在是否有助于识别遗传性癌症易感综合征发生率较低的EO-CRC亚组。
讨 论
全球范围内,EO-CRC的发病率正在上升。尽管EO-CRC以散发性为主,但高达30%的患者可能存在潜在的遗传性癌症易感综合征。本文呈现了一组连续收集的EO-CRC确诊患者队列,这些患者在标准临床诊疗中接受了胚系癌症易感性检测。
本队列中,潜在可干预的高外显率基因中胚系PVs/LPVs的检出率为18%,这凸显了对EO-CRC患者及其高危亲属进行遗传性癌症综合征筛查的重要性。与既往研究一致,研究者强烈支持所有EO-CRC患者均应接受胚系筛查的建议。理想情况下,筛查应在初始诊断时进行,因为这可能对手术决策和系统治疗规划产生影响。
对本EO-CRC患者队列的临床病理和分子数据的分析显示,其结果与多个机构和国家先前发表的数据基本一致。与遗传性癌症易感综合征相关的EO-CRC病例比例在10%-33%之间,其中35岁以下患者的比例更高。在这项基于意大利北部的队列中,约五分之一的EO-CRC诊断与遗传性癌症综合征相关,这进一步证实了先前的观察结果。胚系PVs/LPVs的识别对患者及其家属的筛查策略和治疗决策具有重要意义。因此,研究者再次强调,所有EO-CRC患者都应接受全面的胚系图谱分析,无论其癌症家族史或体细胞肿瘤图谱结果如何。
关于EO-CRC患者基于NGS的胚系panel的基因选择,最新的EO-CRC临床管理DIRECt指南提出了一种全面的多步骤方法。首先纳入与CRC明确相关的核心基因集,然后纳入其他患病率较高且具有临床可干预性的基因。前瞻性队列研究表明,预先扩展初始胚系panel,纳入更多可能与CRC相关的遗传性癌症综合征驱动基因,可能为患者及其亲属带来显著的临床益处。在此背景下,除了已明确参与的MMR和MUTYH基因外,基于先前的报道,本队列中DDR基因占所有胚系PVs/LPVs的22%。值得注意的是,一名患者在有明确非CRC癌症家族史的情况下,同时携带ATM和CHEK2 PVs。这一发现具有临床意义,因为在正在进行的临床试验中,DNA修复通路的变异正越来越多地被探索作为转移性CRC的治疗靶点。这些试验涉及多种DDR抑制剂,包括但不限于PARP抑制剂。此外,识别DDR基因(如ATM、BRCA1/2和CHEK2)中的PV/LPV,有助于制定针对性的预防性监测和/或预防性手术方案,作为专项筛查的一部分,使患者及其亲属受益。
在本队列中,总体癌症家族史和CRC家族史均不能显著预测胚系PVs/LPVs的检出。在被识别出患有遗传性癌症易感综合征的患者中,研究者仅观察到癌症或CRC特异性家族史在数量上有富集的趋势,这可能是由于样本量较小。值得注意的是,EO-CRC患者且在非MMR基因(即DDR基因、FLCN和SDHAF2)中存在胚系PV/LPV的患者,报告CRC特异性家族史的可能性显著更低。这表明,将胚系筛查范围扩大到典型的CRC相关基因之外,可能有助于识别更多与早发CRC发生不常相关的遗传性癌症易感综合征。值得注意的是,尽管DDR基因已被纳入指南讨论的panel中,但研究者在2例EO-CRC患者中发现了FLCN和SDHAF2基因的胚系突变——这两个基因未被纳入DIRECt胚系panel。
FLCN基因在多种组织中生理性表达,其编码的蛋白质与细胞生长和存活、代谢以及细胞黏附的调节有关。FLCN与多种信号通路相互作用,包括蛋白激酶B/雷帕霉素靶蛋白通路。尽管潜在机制尚未完全阐明,但FLCN的失调会增加Birt-Hogg-Dubé综合征患者的肿瘤发生风险。值得注意的是,有报道称Birt-Hogg-Dubé综合征患者的FLCN胚系PVs会增加EO-CRC的发病风险,尽管FLCN并不在EO-CRC患者通常筛查的胚系变异基因之列。Birt-Hogg-Dubé综合征患者患CRC的风险有中度但显著的增加(5.1% vs 1.5%;P=0.0068),其中高达35%的患者符合修订后的Bethesda标准。然而,FLCN胚系突变在EO-CRC中的发生率仍有待系统研究。
SDHAF2胚系PVs会导致遗传性副神经节瘤-嗜铬细胞瘤综合征,但也有报道称其与EO-CRC相关。SDH基因编码琥珀酸脱氢酶的各个亚基,琥珀酸脱氢酶是参与三羧酸循环和电子传递链的关键呼吸酶。具体而言,SDHAF2编码SDH复合体组装因子2(SDHAF2),该因子对SDHA蛋白的黄素化和酶活性至关重要。SDH PVs通常使个体易患嗜铬细胞瘤和副神经节瘤、胃肠道间质瘤、肾细胞癌和垂体腺瘤。然而,在过去二十年中,SDH相关肿瘤的范围已扩大到包括CRC。尽管SDHAF2 PVs与CRC之间的直接机制关联仍不明确,但SDHAF2在肠道水平的表达使其潜在关联具有一定合理性。SDHAF2是SDHA活性所必需的,且SDHA PVs已被证实与CRC的发生相关,这一事实进一步支持了上述假设。因此,如果在其他队列和国际研究中,通过系统评估FLCN和SDHAF2基因在EO-CRC患者中的发生率得到证实,那么这两个基因都可被纳入用于筛查EO-CRC中遗传性癌症易感综合征的标准诊断NGS panel。
研究者认为,描述前瞻性EO-CRC队列中遗传性癌症综合征筛查情况的出版物,对于逐步确定用于EO-CRC患者的最全面NGS panel具有重要意义。在本研究发现36%的EO-CRC患者存在VUS的情况下,这一点尤为重要。基于本研究结果,研究者建议不仅要增加对PVs/LPVs的报告,还要增加对EO-CRC中识别出的VUS的报告,以帮助在未来重新定义它们潜在的病理作用。这对于科学文献和EO-CRC患者的临床管理都可能至关重要。
在对无任何胚系变异的EO-CRC患者进行回顾时,研究者观察到所有CRC为BRAF突变型或具有印戒细胞癌(SRCC)特征的患者均未检测到胚系PVs/LPVs。然而,在BRAF V600E突变和林奇综合征(LS)的背景下,这一结果并不意外。由于本队列中这些CRC亚组的样本量较小,需要更多数据来确定具有这些特征的EO-CRC患者是否具有更低的遗传性癌症综合征发生率。
本研究存在一些局限性。首先,尽管130例患者的队列为EO-CRC提供了有价值的见解,但样本量仍然相对有限。其次,两个参与机构使用的NGS panel的基因覆盖范围并不完全一致。第三,本队列主要为意大利裔,仅8%的患者来自其他国家,这可能限制了本研究结果对其他种族和全球人群的普遍性。第四,由于国际指南尚未推荐对CRC进行体细胞NGS图谱分析,因此无法获得体细胞NGS数据与胚系检测结果进行直接比较。
总之,这项在日常临床实践中进行的前瞻性队列研究证实,约五分之一的EO-CRC病例源于胚系PVs,属于遗传性癌症综合征范畴,这与DIRECt指南一致。癌症家族史并未被证明是胚系PV的可靠预测指标,在非MMR基因中存在胚系PV的EO-CRC患者中,报告CRC家族史的可能性显著更低。随着对VUS的系统报告及其未来可能的重新分类,EO-CRC中遗传性癌症综合征的患病率可能会增加。最后,本研究还提供了FLCN和SDHAF2基因存在胚系变异的证据,值得在未来的EO-CRC胚系panel研究中进一步探讨。研究者还建议开展更大规模的胚系筛查研究,重点关注BRAF V600E突变型或SRCC EO-CRC队列,以评估它们与遗传性癌症综合征的潜在关联。
参考文献:
Mauri, G. et al. Germline genomic profiling of patients with early-onset colorectal cancer. ESMO Gastrointestinal Oncology, Volume 8, 100182


